Ардатская М. Д., Минушкин О. Н. Современные принципы диагностики и фармакологической коррекции // Гастроэнтерология, приложение к журналу Consilium Medicum. – 2006. — Т. 8. – №2.
. С тех пор, как биологию стали разрабатывать
в свете эволюционной теории, в области органической
природы также начали исчезать одна за другой
застывшие разграничительные линии классификации;
с каждым днем множатся почти не поддающиеся
классификации промежуточные звенья, более
точное исследование перебрасывает организмы
из одного класса в другой, и отличительные признаки,
ставшие почти символом веры,
теряют свое безусловное значение.
Со времени открытия микроорганизмов постоянно возникал вопрос о роли и механизмах воздействия микрофлоры на организм человека. Воззрения на микрофлору менялись в зависимости от уровня ее познания. Можно условно выделить несколько основных этапов в развитии учения о микробиоценозе.
Первый — »эвристический» — это открытие Левенгуком присутствия в организме человека и животных микроорганизмов. Второй — »накопительный» — включает исследования по обнаружению и идентификации микроорганизмов в различных биотопах. Начинается изучение не только агрессивной, но и защитной роли отдельных видов микроорганизмов в жизни человека и животных (A. Nissle, И.И. Мечников, Л.Г. Перетц, Н.Ф. Гамалея, Г.Н. Габричевский и др.). Третий (80-90-е годы XX века) — этап »детализации», когда широкое использование современных методов культивирования облигатно-анаэробных бактерий и использование принципов гнотобиологии дали возможность начать прицельное изучение роли нормальной микрофлоры и ее отдельных представителей в поддержании гомеостаза макроорганизма, а также оценить ее роль в возникновении некоторых патологических состояний, вызванных различными представителями микрофлоры (О.В. Чахава, А.О. Тамм, Б.А. Шендеров и др.).
Четвертый этап (конец 90-х годов) — »аналитический» (И.В. Домарадский, В.Н. Бабин, А.В. Дубинин, О.Н. Минушкин, М.Д. Ардатская и др.), основанный на изучении молекулярных и биохимических механизмов, управляющих связью микробиоты и организма-хозяина, позволил констатировать масштаб той пользы, которую получает человек от симбиоза с микрофлорой, и выяснить возможные причины перехода от »благополучного сосуществования» к взаимной агрессии.
Необходимо отметить, что именно на этом этапе была создана основа для формулирования принципиально нового воззрения на состояние микробиоценоза с позиций клинической медицины. Однако, несмотря на успехи, достигнутые в конце XX века, среди большинства практикующих врачей бытует устаревшее представление о «дисбактериозе», что приводит к его гиперболизации и недооценке основной патологии, приведшей к нарушениям микрофлоры.
Задача данной публикации — ознакомить практикующих врачей с современным состоянием вопроса о микробиоценозе кишечника с позиций доказательной медицины, осветить методы диагностики нарушений микрофлоры и основные принципы лечебной коррекции.
Согласно различным этапам учения о микробиоценозе кишечника было принято несколько определений дисбактериоза.
Впервые данный термин был введен A. Nissle в 1916 г., который под дисбактериозом первоначально понимал изменения, касающиеся только кишечной палочки.
Л.Г. Перетц (1962 г.) определял дисбактериоз как патологическое состояние кишечной микрофлоры, которое характеризуется уменьшением общего количества типичных кишечных палочек, понижением их антагонистической и ферментативной активности, появлением лактозонегативных эшерихий и кишечных палочек, дающих гемолиз на кровяном агаре, увеличением количества гнилостных, гноеродных, спороносных и других видов микробов.
В определении А.М. Уголева (1972 г.) дисбактериоз характеризовался как изменение качественного и количественного состава бактериальной флоры кишечника, возникающее под влиянием различных факторов: характера питания, изменения перистальтики кишечника, возраста, воспалительных процессов, лечения антибактериальными препаратами, изменения физико-химических условий жизнедеятельности бактерий (физический, психический стресс, тяжелые заболевания, оперативные вмешательства, экстремальные условия, которым подвергается человек при длительном пребывании в нехарактерных для него зонах обитания, — спелеологические, высокогорные, подводные, арктические и антарктические зоны; различные загрязнения окружающей среды; иммунодефицитные состояния; нарушения пищеварения с попаданием значительного количества питательных веществ в среду микробного обитания; голодание и т.д.).
Главной особенностью, позволяющей отнести это биологическое явление к дисбактериозу, по мнению А.М. Уголева, является стойкий его характер и нарушенные механизмы аутостабилизации.
До настоящего времени широко использовалось и другое определение дисбактериоза как состояния, характеризующегося нарушением подвижного равновесия кишечной микрофлоры и возникновением качественных и количественных изменений в микробном пейзаже кишечника (В.Н. Красноголовец, 1989) [19].
Некоторыми авторами [3, 25, 32] дисбактериоз (не только кишечника) рассматривался как изменение микробиоценозов различных биотопов человеческого организма, выражающееся в нарушении инфраструктурного отношения анаэробы/аэробы, популяционных изменениях численности и состава микробных видов биотопов, в том числе в появлении нерезидентных для данного биотопа видов (контаминация, транслокация), изменения их метаболической активности, что является следствием и/или одним из патогенетических механизмов многих патологических состояний.
Термин «дисбактериоз» присутствует только в отечественной литературе. Анализ источников литературы, проведенный В.В. Василенко [15], показал, что данный термин «присутствует в заголовках 257 научных работ, опубликованных с 1966 по 2000 г., 250 из них — в русскоязычных медицинских журналах, еще 4 принадлежат авторам из стран прежнего социалистического лагеря».
Но, как видно из представленных определений, «дисбактериоз» — не столько клиническое понятие, сколько микробиологический (лабораторный) термин, и по своей сути является следствием воздействия неблагоприятных факторов, в том числе различных заболеваний.
В зарубежной литературе применяется термин «Bacterial overgrowth syndrome» — синдром избыточного бактериального роста [39, 40, 43, 47, 54, 59, 64], включающий в себя изменение количественного и видового состава микроорганизмов, характерных для биотопа, и в ряде случаев включает феномены контаминации и транслокации [41, 42, 52, 53, 60].
Основное отличие понятия «синдром избыточного бактериального роста» от термина «дисбактериоз кишечника» заключается не столько в терминологических нюансах, сколько в том содержании, которое в него вкладывается: при синдроме избыточного бактериального роста бактерий речь идет не об изменении «микробного пейзажа» толстой кишки, а об изменении состава микрофлоры тонкой кишки.
К причинам синдрома избыточного бактериального роста можно отнести: снижение желудочной секреции, нарушение функции или резекция илеоцекального клапана, нарушение кишечного переваривания и всасывания, нарушение иммунитета, непроходимость кишечника, последствия оперативных вмешательств (синдром приводящей петли, энтероэнтероанастомозы, структурные нарушения стенки кишечника [34].
Таким образом, нарушение микробиоценоза кишечника является следствием органической или функциональной патологии не только желудочно-кишечного тракта (ЖКТ), но и других органов и систем [5-8, 28, 35]. Например, в наших работах [5, 24] по изучению короткоцепочечных жирных кислот (КЖК) у больных с бронхолегочной патологией мы отметили выраженные изменения со стороны микрофлоры кишечника. Мы связали этот эффект с изменением динамики водорода. Неполное высвобождение Н2 в легких, обусловленное наличием патологии, приводит к возврату и накоплению его в полости кишечника. Это в свою очередь вызывает смещение окислительно-восстановительного потенциала внутрипросветной среды в сторону резкоотрицательных значений, при которых блокируются ферредоксинсодержащие ферменты, обеспечивающие жизнедеятельность облигатных анаэробов [57].
Учитывая изложенное, необходимо подчеркнуть, что диагноз формулируется согласно Международной классификации болезней 10-го пересмотра. Самостоятельной нозологической единицы «дисбактериоз» не существует.
Преходящие нарушения микробиоценоза под влиянием различных факторов, в первую очередь антибиотикотерапии, рассматриваются с позиции дисбактериальных реакций и требуют в большей степени проведения профилактических мероприятий.
Необходимо рассмотреть вопрос о закономерностях расселения микрофлоры и ее функциях.
Общая численность микроорганизмов, обитающих в различных биотопах человеческого организма, достигает величины порядка 10 15 , т.е. число микробных клеток примерно на два порядка превышает численность собственных клеток макроорганизма. Отношения в этом сообществе имеют филогенетически древнее происхождение и жизненно важны для обеих частей системы организм-микробиота [12, 13, 17, 25].
Значительная часть (более 60%) микрофлоры заселяет различные отделы ЖКТ. Примерно 15-16% микроорганизмов приходится на ротоглотку. Урогенитальный тракт, исключая вагинальный отдел (9%), заселен довольно слабо (2%); остальная часть приходится на кожные покровы (12%) [19, 37, 38].
В любом микробиоценозе, в том числе кишечном, всегда имеются постоянно обитающие виды бактерий (главная, автохтонная, индигенная, резидентная микрофлора) 90%, а также добавочные (сопутствующая, факультативная) — около 10% и транзиторные (случайные виды, аллохтонная, остаточная микрофлора) — 0,01% [19, 21, 38].
Ранее считалось, что тонкая кишка стерильна. Однако установлено, что в физиологических условиях содержание бактерий в тонкой кишке колеблется от 10 4 на 1 мл содержимого в тощей кишке до 10 7 на 1 мл в подвздошной, при этом в проксимальных отделах тонкой кишки обнаруживаются преимущественно грамположительные аэробные бактерии, в дистальных — грамотрицательные энтеробактерии и анаэробы (табл. 1) [37].
Главная микрофлора толстой кишки включает в себя анаэробные бактерии родов Bacteroides, Вifidobacterium. Аэробные бактерии, представленные кишечными палочками, лактобациллами, энтерококками и др., составляют сопутствующую микрофлору. К остаточной микрофлоре относят стафилококки, клостридии, протей, грибы [19, 34, 38]. Однако такое деление крайне условно. В толстой кишке человека в различном количестве присутствуют бактерии родов Actinomyces, Bacillus, Сitrobacter, Corynebacterium, Enterobacter, Peptococcus, РeptoStreptococcus, Рseudomonas, Veillonella, Acidaminococcus, Anaerovibrio, Butyrovibrio, Acetivibrio, Campylobacter, Disulfomonas, Eubacterium, Fusobacterium, Propionibacterium, Roseburia, Ruminococcus, Selenomonas, Spirochetes, Succinomonas, Wolinella. Помимо указанных групп микроорганизмов можно обнаружить также представителей и других анаэробных бактерий (Gemiger, Anaerobiospirillum, Methanobrevibacter, Megasphaera, Bilophila), различных представителей непатогенных простейших родов (Chilomastix, Endolimax, Entamoeba, Enteromonas) и более десяти кишечных вирусов [37, 38].
Анализируя видовой, численный состав и инфраструктуру микробного ценоза макроорганизма, можно кратко сформулировать три основных положения: первое — общее число видов более 500, второе — к основным по своей патогенетической сущности следует отнести род бифидобактерий и семейство бактероидов (последнее в связи с трудностью анаэробного культивирования и, следовательно, с высокой стоимостью исследования во многих лабораториях не определяется), третье — отношение анаэробов к аэробам в норме постоянно: 10:1 (или 102-3:1) зависимо от биотопа [12, 25, 46, 64]. Облигатных и факультативных анаэробов всегда на порядок больше аэробов, как в «анаэробных органах» — толстая кишка, так и на кожных покровах. Это достигается благодаря наличию своеобразной зоны в области, непосредственно прилегающей к эпителию. Основная особенность этой зоны состоит в том, что в ней благодаря работе натриевых насосов на плазматических мембранах эпителиоцитов и своеобразию структуры поверхностных гликопротеидов поддерживается отрицательный потенциал [12]. В различных отделах величины его колеблются от -50 до -220 мВ. Кислород и его токсичные метаболиты (супероксид-ион и т.д.) в этой зоне в норме отсутствуют. Этим же объясняется и »этажность» расселения различных видов бактерий по вертикали: в непосредственном адгезивном контакте с эпителием находятся строгие анаэробы (бифидобактерии, бактероиды), далее располагаются факультативные анаэробы, еще выше — аэробы [12, 13, 51, 54, 57].
На основании проведенного анализа совокупность физиологических эффектов [12, 25, 38, 47, 48, 51, 54, 56, 64], оказываемых микробиотой, т.е. всей совокупностью живых микроорганизмов: бактерий, вирусов, простейших и др., на организм хозяина, представлена в табл. 2.
Прежде всего это трофическая (пищеварительная) функция микробиоты. В физиологии принято различать дистанционное, просветное, аутолитическое и мембранное пищеварение, осуществляемое собственными ферментами организма, и симбионтное пищеварение, происходящее при содействии микрофлоры, которое длительное время считалась только прерогативой жвачных. Однако стало ясно, что энергообеспечение клеток эпителиальных тканей человека также базируется на утилизации в рамках цикла Кребса низкомолекулярных метаболитов (КЖК: в первую очередь уксусной, пропионовой, масляной), получающихся в результате отщепления моносахаридных фрагментов слизи, гликокаликса и продуктов экзогенного происхождения посредством внеклеточных гликозидаз анаэробов-сахаролитиков с последующим брожением этих сахаров [12, 13, 22].
Кроме того, при расщеплении полисахаридов и гликопротеидов внеклеточными гликозидазами микробного происхождения образуются моносахариды (глюкоза, галактоза и т.д.), при окислении которых в окружающую среду выделяется в виде тепла не менее 60% их свободной энергии [12, 13, 22, 25].
Другой важный эффект — стимуляция локального иммунитета, в первую очередь обусловленный усилением секреции ключевого звена системы местного иммунитета, а именно секреторного IgА [12, 16, 19, 25, 34, 38].
Низкомолекулярные метаболиты сахаролитической микрофлоры, в первую очередь КЖК, лактат и др., обладают заметным бактериостатическим эффектом [11, 25, 48, 51, 61]. Они способны ингибировать рост сальмонелл, дизентерийных шигелл, многих грибов. В то же время бактериостатический эффект не распространяется на резидентную микрофлору. С другой стороны, низкомолекулярные метаболиты, блокируя своими адгезинами рецепторы эпителиоцитов, препятствуют адгезии патогенной микрофлоры к эпителию и обладают способностью индуцировать хемотаксис бактерий [11-13]. Этот эффект, с одной стороны, дает возможность нормальной микрофлоре, не обладающей локомоторным аппаратом (например, бактероидам [57]), но ассоциированной с подвижными видами, заселять свои экологические ниши. С другой стороны, низкомолекулярные метаболиты и некоторые короткие пептиды играют роль репеллентов по отношению к ряду болезнетворных бактерий [12, 13, 25, 38].
Многие резидентные бактерии имеют специализированные лигандные структуры, обеспечивающие адгезию — адгезины. Бактериальные колонии и ассоциации также укрепляются за счет ионных, полярных и гидрофобных взаимодействий в гликопротеидном слое гликокаликса и оказываются резидентами, проявляя естественный антагонизм чужеродным агентам. Это обеспечивается путем контактных взаимодействий, представленных обычной адгезией бактериальных клеток к эпителию, где играют роль как неспецифические (физико-химические) факторы, так и специфические лиганд-рецепторные взаимодействия [12, 13, 25, 38].
Обсуждается вопрос о ключевом участии микрофлоры в обеспечении противовирусной защиты хозяина [12, 21, 38, 46, 48, 54]. Благодаря феномену молекулярной мимикрии и наличию рецепторов, приобретенных от эпителия хозяина, микрофлора приобретает способность перехвата и выведения вирусов, обладающих соответствующими лигандами [12].
Следует также подчеркнуть, что резидентные виды микрофлоры помогают эпителию поддерживать необходимые значения физико-химических параметров гомеостаза — редокс-потенциал, рН, реологические характеристики в контактной зоне [12, 21, 38, 56, 64].
По результатам экспериментальных данных, опубликованных в зарубежной литературе, активно обсуждается участие микрофлоры в обеспечении и контроле моторной активности кишечника, посредством продукции монокарбоновых (короткоцепочечных) жирных кислот [2, 20, 44, 46, 49, 61].
Системные функции микробиоты осуществляются путем реализации дистанционных и внутриклеточных взаимодействий [12, 13, 25, 64]. Дистанционные взаимодействия поддерживаются за счет обмена метаболитами, в основном низкомолекулярными и »сигнальными молекулами» »микробиотного» происхождения: монокарбоновыми и дикарбоновыми кислотами и их солями, циклическими нуклеотидами, оксикислотами, аминокислотами, аминами и др. Например, g-аминомасляная кислота (ГАМК) — антистрессорный медиатор, которая продуцируется в больших количествах бактериальной микрофлорой, образует единый пул с эндогенной фракцией ГАМК. Изменение уровня ГАМК у больных синдромом раздраженного кишечника (СРК), возможно, объясняет наличие низких порогов возбуждения, склонность к повышенной возбудимости и тревожности, пониженного порога болевой чувствительности у данной группы пациентов по сравнению со здоровыми субъектами [17, 18].
Микробиота является своего рода хранилищем микробных плазмидных и хромосомных генов [12, 25, 38, 64], обмениваясь генетическим материалом с клетками хозяина. Реализуются внутриклеточные взаимодействия путем эндоцитоза, фагоцитоза и др. При внутриклеточных взаимодействиях достигается эффект обмена клеточным материалом. В результате этого микробиота приобретает рецепторы и другие антигены, присущие хозяину и делающие ее »своей» для иммунной системы макроорганизма. Эпителиальные ткани в результате такого обмена приобретают бактериальные антигены [12, 47, 51].
Системная стимуляция иммунитета — одна из важнейших функций микробиоты. Известно, что у безмикробных лабораторных животных иммунитет не только подавлен, но и происходит инволюция иммунокомпетентных органов [12, 16, 38, 46, 47]. Другая важнейшая функция — участие в поддержании ионного гомеостаза организма, поскольку всасывание эпителием монокарбоновых кислот тесно сопряжено с транспортом натрия [12, 17, 22, 61].
Еще один эффект обусловлен продуцированием вторичных метаболитов, т.е веществ стероидной природы — конъюгатов желчных кислот с образованием эстрогеноподобных субстанций, оказывающих влияние на дифференцировку и пролиферацию эпителиальных и некоторых других тканей, на экспрессию генов или изменяющих характер их действия [12, 25, 38, 47, 64].
Микробиота выполняет витаминосинтезирующую функцию (витамины группы В, К), является поставщиком коферментов (токоферолы, b-аланин, необходимый для синтеза пантотеновой кислоты, и т.д.) [19, 21, 38, 47, 54, 64].
Участие в регуляции газового состава кишечника и других полостей организма хозяина осуществляется функционированием метанообразующих бактерий, использующих водород для своего метаболизма. Известно, что водород создает восстановительную среду в просвете кишечника, а чрезмерное понижение окислительно-восстановительного потенциала приводит к блокированию ферредоксинсодержащих терминальных ферментов редокс-цепей анаэробов [57]. Газы диффундируют в кровоток, образуя нестабильные комплексы с гемоглобином, впоследствии высвобождаются в легких, влияя на регуляцию кислородного обмена [3, 5, 12, 13, 25].
Микробиота также принимает участие в детоксикации экзогенных и эндогенных субстратов и метаболитов (амины, меркаптаны, фенолы, мутагенные стероиды и др.), с одной стороны, представляя собой массивный сорбент, выводя из организма токсичные продукты с кишечным содержимым, с другой — утилизируя их в реакциях метаболизма для своих нужд [12, 16, 19, 21, 38].
Итак, взаимоотношения хозяин-микробиота носят сложный характер, реализующийся на метаболическом, регуляторном, внутриклеточном и генетическом уровнях [12, 13, 25].
Участие микробиоты в формировании целого ряда функций (или их поддержания) доказано на моделях безмикробных животных. Экспериментальные данные [38] свидетельствуют, что у безмикробных животных истончена в кишечнике собственная пластинка (Lamina propria) за счет уменьшения числа клеточных элементов и сниженной гидратации тканей. Это приводит к уменьшению удельной и общей площади поверхности слизистой оболочки кишечной ткани, увеличению секреции желудочного сока, экскреции ионов натрия и общего количества белка в поджелудочной железе. Заметно снижены митотическая активность энтероцитов и скорость их миграции по микроворсинкам. У безмикробных животных на 25% по сравнению с физиологической нормой снижен основной обмен, нарушена перистальтика кишечника, всасывание воды, усвоение насыщенных жирных кислот, продукция витаминов групп В, К и др., печеночно-кишечная циркуляция желчных кислот, холестерина, желчных пигментов. У гнотобиотических животных отмечена ареактивность гладкой мускулатуры сосудов и кишечника к воздействию катехоламинов, имеет место мышечная гипотония. Вазодилатация обусловливает снижение ударного объема сердца и циркулирующей крови. Снижение гемопоэтической функции проявляется в падении числа лейкоцитов и лимфоцитов в крови. У подобных животных изменены функции гипофиза, надпочечников и поджелудочной железы, отмечена гипоплазия лимфоидной ткани, нарушены организация и созревание ретикулоэндотелиальной системы, понижены уровни комплемента, лизоцима, снижена фагоцитарная активность лейкоцитов.
Таким образом, микрофлора выполняет ряд важнейших функций как на местном, так и на системном уровнях, и можно сказать, что основная их часть осуществляется участием ее метаболитов в различных биологических процессах макроорганизма, в частности КЖК, которые обеспечивают многочисленные физиологические эффекты (табл. 3).
Нормальный состав кишечной микрофлоры может быть только при нормальном физиологическом состоянии организма. Как только в организме происходят патологические изменения, меняются состав и свойства кишечной микрофлоры, нарушаются ее локальные и системные функции [16, 19, 21, 25, 34, 38, 47, 64].
Приведем примеры изменения микробиоценоза кишечника при различной патологии ЖКТ.
По результатам изучения КЖК в кале при СРК с преобладанием запора и диареи (СРК-З и СРК-Д), нами установлены противоположные изменения в родовом составе кишечной микрофлоры при различных типах нарушения моторики кишечника. Так, при СРК-З происходит активизация родов аэробных бактерий, в частности обладающих протеолитической активностью (так как кишечные палочки, фекальные стрептококки рассматриваются как сильнейшие протеолитики). При СРК-Д наблюдается повышение активности анаэробных микроорганизмов родов бактероидов, пропионибактерий, клостридий и т.д. Это связано с переключением метаболизма колоноцитов с цикла Кребса на активацию гексозомонофосфатного шунтирования (ГМШ), что при СРК-З приводит к увеличению продукции токсичных форм кислорода и «аэробизации» среды, способствующих активизации аэробных микроорганизмов; при СРК-Д — к активации анаэробного типа гликолиза, приводящего к угнетению жизнедеятельности облигатных анаэробов за счет блокирования терминальных ферредоксинсодержащих ферментов и активизации условно-патогенных штаммов анаэробов, в частности бактероидов [2, 3].
При неспецифическом язвенном колите (НЯК) по результатам изучения КЖК также отмечается усиление активности анаэробных микроорганизмов, однако при этом превалируют роды клостридий, фузобактерий, эубактерий, причем штаммы, обладающие гемолитической активностью [20, 47, 48, 54]. Однако надо отметить, что изменение качественного состава КЖК [10], характеризующего родовой состав микрофлоры кишечника, находится в четкой зависимости от локализации воспаления, активности патологического процесса и степени тяжести заболевания. Объясняется это тем, что в различных отделах толстой кишки доминируют различные популяции микроорганизмов, утилизация и абсорбция данных кислот в различных отделах толстой кишки происходит по-разному, и кроме того, с повышением кровоточивости происходит нарастание активности гемолитической флоры [61, 58, 62, 63].
У больных с повышенным риском камнеобразования в желчном пузыре и при желчно-каменной болезни (ЖКБ) по результатам изучения КЖК в кале нами выявлено изменение качественного состава микрофлоры, выражающееся в повышении активности тех родов микроорганизмов, которые задействованы в 7-a-дегидроксилировании желчных кислот, а именно аэробных микроорганизмов (в частности E. coli и т.д.) и анаэробов: некоторых штаммов родов бактероидов, клостридий, эубактерий. Причем эти изменения носили стойкий характер вне зависимости от типа нарушений моторно-эвакуаторной функции кишечника [3].
С другой стороны, микрофлора не может не участвовать в поддержании функциональных расстройств или патологического процесса.
Например, в экспериментах in vitro Т.Yajima (1985 г.) [44] установил влияние аппликации пропионовой, масляной, валериановой кислот на возникновение сокращений изолированных сегментов толстой кишки. Наши результаты изучения содержания КЖК в кале у больных с различными вариантами СРК [2, 3] подтверждают данную концепцию, а именно: увеличение или уменьшение концентраций кислот, продуцируемых микрофлорой, четко соотносится с типом моторно-эвакуторных расстройств кишечника при данной патологии.
Приведем другой пример. В последнее время большое значение уделяется роли индигенной микрофлоры в качестве одной из причин поддержания патологического процесса при НЯК. Объясняется это тем, что в результате нарушения муцинообразования и т.п. просветные микробные агенты и/или продукты их жизнедеятельности получают доступ к слизистой оболочке через нарушенный слизистый барьер, где они активируют кишечные воспалительные клетки, которые секретируют цитокины, метаболиты арахидоновой кислоты, протеазы, оксид азота и токсические кислородные радикалы, закрепляя воспалительный ответ. При этом нарушенное регулирование местного и системного звеньев иммунной системы приводит к активации самоподдерживающегося воспалительного каскада. Этот каскад может вовлекать некоторые или все провоспалительные и противовоспалительные медиаторы. Увеличение всасывания бактериальных агентов, нарушение симбионтных отношений между микрофлорой и организмом оказывают стимулирующий эффект на иммунную систему, поддерживают и усиливают воспаление.
Как было указано, микрофлора продуцирует огромное количество метаболитов, в том числе эндогенных нейротрансмиттеров (аммиак, меркаптаны, коротко- и среднецепочечные кислоты и т.д.) не только полезных, но и потенциально опасных для макроорганизма. Так, при заболеваниях печени, в частности при развитии портосистемного шунтирования (цирроз печени), они не метаболизируются гепатоцитами в связи с их функциональной несостоятельностью и, проникая в центральный кровоток, оказывают токсическое влияние на астроглию, вызывая клинические признаки печеночной энцефалопатии.
Нельзя не учитывать и потенциальную опасность самой микрофлоры (а не только ее метаболитов), когда происходит транслокация микроорганизмов в нерезидентные биотопы и стерильные полости. В частности, проникновение кишечной микрофлоры в брюшную полость приводит к ее инфицированности и развитию спонтанного бактериального перитонита. Причем смертность больных с циррозом печени классов В, С по Чайлд-Пью в этом случае достигает 50%, а у 69% больных наблюдается рецидив в течение года.
Можно было бы продолжить перечень иллюстраций, однако даже из этих примеров видно, какая тесная, можно сказать интимная, взаимосвязь существует между макроорганизмом и населяющей его микрофлорой.
Существуют общие и специфические методы оценки микробной экологии и колонизационной резистентности: гистохимические, морфологические, молекулярно-генетические методы исследования микроорганизмов, комбинированные методы исследования биоматериала, нагрузочные пробы и др. [38]. Однако эти методы, находящиеся в арсенале крупных НИИ микробиологии, не могут быть полностью использованы в общей практике.
Наиболее обсуждаемые и применяемые методы диагностики состояния микробиоценоза (дисбактериоз) — рутинное бактериологическое исследование кала, диагностика с помощью полимеразной цепной реакции (ПЦР), хромато-масс-спектрометрия [33] и исследование микробных метаболитов [36].
В результате многолетнего изучения кишечной микрофлоры Р.В.Эпштейн-Литвак и Ф.Л.Вильшанская (1970 г.) разработали методы лабораторной диагностики дисбактериоза. В зависимости от оснащения лаборатории количество определяемых показателей колеблется от 14 до 25. Частота выделения и среднее количество основных представителей кишечной микрофлоры в 1 г кала практически здоровых лиц представлено в табл. 4. Основным достоинством метода является точная верификация патогенных бактерий семейства кишечных.
Наиболее информативным является микробиологическое исследование микроорганизмов с применением анаэробного культивирования в биоптатах, полученных из различных отделов кишечника. Однако в силу технических сложностей в практике не может быть использовано.
В последние годы широкое распространение получил способ определения видов микроорганизмов с помощью ПЦР-диагностики. В основе метода ПЦР лежит комплементарное достраивание участка геномной ДНК или РНК возбудителя, осуществляемое in vitro с помощью фермента термостабильной ДНК-полимеразы. С помощью ПЦР-диагностики определяются некоторые представители микрофлоры с внутриклеточной или мембранной локализацией. Метод отличает быстрота выполнения. Однако информативность исследования высока только в отношении ограниченного круга условно-патогенных и патогенных микроорганизмов и вирусов. Данный метод применяется в основном для верификации инфекционной патологии.
В диагностике родового состава сообщества микроорганизмов, получаемых методом хромато-масс-спектрометрии [33], внедренном в клиническую практику в конце 80-х годов ХХ столетия, определяется 35-40 показателей. К преимуществам метода можно отнести специфичность диагностики анаэробных инфекций, особенно родов клостридиум, метод дает возможность оценки живых и мертвых микроорганизмов, возможны определение малых концентраций клеток микроорганизмов на преобладающем фоне биологической жидкости, быстрота получения результата (3 ч). Его универсальность доказывается сопоставлением результатов с методом ДНК-ДНК-гибридизации и амплификации гена. К недостаткам можно отнести: требование многократных исследований для анализа широкого диапазона микроорганизмов, особенности компьютерной обработки и др., большая стоимость исследования, зависящая от технического оборудования и многое другое.
Существуют методы диагностики дисбактериоза кишечника по метаболитам (индикан, паракрезол, фенол, 14СО2, аммиак и др.) микрофлоры (табл. 5), способные дать быстрый результат. Однако методы различаются специфичностью (от 50 до 90%) и чувствительностью (от 25 до 100%) исследования в отношении анаэробно-аэробных популяций микроорганизмов.
К способам диагностики синдрома избыточного бактериального роста, кроме перечисленных, можно отнести исследование выделяемого водорода (дыхательный тест) и тесты с меченым 14СО2, используемые для определения анаэробных микроорганизмов, участвующих в энтерогепатической циркуляции желчных кислот. Однако данные методы имеют также различную чувствительность и специфичность в отношении популяций микроорганизмов (от 25 до 70%), техническую сложность и стоимость, что ограничило их внедрение в широкую практику.
С 70-х годов прошлого столетия начали разрабатываться и в 90-е годы были внедрены в клиническую практику хроматографические (газожидкостная, ионно-обменная, высокоэффективная жидкостная хроматография) методы определения метаболитов индигенной микрофлоры. Они различались трудоемкостью и несовершенством методики пробоподготовки, приводящей к потере 15-20% метаболитов [32], стоимостью оборудования и др.
Однако на основании полученных данных был создан метаболический паспорт при эубиозе кишечника (табл. 6) [32]. Были предприняты попытки по соотнесению выбранных параметров с клинической картиной заболеваний кишечника [3]. Это стало началом нового качественного этапа в понимании взаимоотношенй макроорганизма и микрофлоры при патологических состояниях.
Несмотря на достаточно широкий арсенал методов, которые могут быть использованы в оценке состояния микрофлоры, в настоящее время остается приоритетным метод микробиологического исследования.
Следует учитывать, что данный метод имеет ряд общепринятых издержек: длительность получения результатов, использование дорогостоящих питательных сред, зависимость от соблюдения сроков транспортировки и качества сред, преимущественное определение внутрипросветной флоры и наряду с ней транзитной (пассажной), неоднородность выделения микроорганизмов из разных отделов испражнений, низкая воспроизводимость результатов и др., невозможность воссоздания нативных условий обитания микроорганизмов, живущих в иммобилизационном состоянии в приэпителиальном слое и многие другие.
Все перечисленные недостатки не дают полного представления о населяющей гликокаликс автохтонной (резидентная) микрофлоре. Довольно часто забывают о низкой чувствительности данного метода и возможности получения ложноотрицательных результатов [2, 16, 19, 21, 25]. Кроме того, основным и по-существу главным недостатком является отсутствие возможности приблизить врача к выявлению органической или функциональной патологии ЖКТ, приведшей к изменению микробиоценоза, и проводить не симптоматическое, а этиопатогенетическое лечение.
Резюмируя, можно отметить, что в настоящее время в основном в диагностике доминирует микробиологический подход. И именно это привело к тому, что микробиологический термин «дисбактериоз» со всеми его недостатками и издержками остался на том же уровне, на каком был внедрен в практику в 70-е годы прошлого столетия.
Для преодоления перечисленных издержек нами разработан и внедрен в практику новый способ диагностики состояния микробиоценоза различных биотопов, в том числе кишечника, основанный на определении КЖК, являющихся метаболитами в основном анаэробных родов микроорганизмов (табл. 7), именно тех, которые не определяются при рутинном бактериологическом исследовании, требующем специальных условий культивирования анаэробов, методом ГЖХ-анализа. Метод позволяет быстро и точно оценить состояние индигенной микрофлоры. Кроме того, отличительной особенностью разработанного метода является то, что в результате накоплен материал не только по верификации родового состава микроорганизмов, но и составлена клиническая база данных содержания КЖК (учитывая их физиологические эффекты) во многих биологических субстратах при различной патологии ЖКТ, разработана адекватная система прогнозирования и мониторирования клинического течения, степени тяжести, стадии патологического процесса и развития осложнений при патологии ЖКТ, отработаны эффективные схемы лечения с учетом индивидуального «метаболитного» статуса пациента [2, 4, 6-8, 10, 28, 35].
Таким образом, использование нового методологического подхода позволяет клиницисту не только правильно оценить состояние микробиоценоза, но и выявить патологию, которая привела к его нарушению, и дифференцированно подобрать лечение.
Этот метод прошел регистрацию в Министерстве здравоохранения и социального развития РФ (№ рег. удостоверения ФС-2006/030-у от 17.03.2006 г.), активно внедрен в широкую клиническую практику и лабораторную диагностику (в том числе в работу независимых лабораторий, в частности «Гемотест»).
- Оценка состояния микрофлоры кишечника.
- Скрининговая диагностика и дифференциальная диагностика заболеваний кишечника.
- Диагностика распространенности и активности воспалительного процесса НЯК.
- Оценка дезинтоксикационной функции печени при хроническом гепатите, циррозе печени (по исследованию КЖК в сыворотке крови).
- Диагностика портальной гипертензии и портосистемного шунтирования (по исследованию КЖК в сыворотке крови).
- Диагностика стадии и дифференциальная диагностика печеночной энцефалопатии (по исследованию КЖК в сыворотке крови).
- Диагностика состояния энтерогепатической циркуляции желчных кислот и холестерина (по исследованию КЖК в кале и сыворотке крови).
- Диагностика внешнесекреторной недостаточности поджелудочной железы у больных хроническим панкреатитом.
- Диагностика спонтанного бактериального асцит-перитонита при циррозе печени (по исследованию КЖК в асцитической жидкости).
- Выбор индивидуального лечения пациентов с указанными заболеваниями ЖКТ и их осложнениями и оценка его эффективности.
Переходя к вопросам лечения, необходимо остановиться на том, что на разных этапах развития учения о микробиоценозе претерпевали изменения и принципы коррекции микробиологических сдвигов — от широкого применения антибактериальных средств до полной замены их бактериальными препаратами и фагами.
Причем если первый тип лечения до настоящего времени широко применяется (что, по мнению многих авторов, глубоко ошибочно, так как приводит к еще большему дисбалансу микроорганизмов, за исключением случаев применения антибактериальных средств при верификации инфекционных агентов), то «увлечение» фагами прошло сравнительно быстро, когда выяснилось, что они несут «островки патогенности» и приводят к появлению у представителей индигенной микрофлоры свойств патогенности и вирулентности за счет обмена генетическим материалом [38].
Таблица 1. Основные резидентные виды микроорганизмов тонкой и толстой кишки (В.В.Тец, 1994)
Тонкая кишка
(10 3 -10 5 в 1 мл)
Толстая кишка
(10 11 — 12 в 1 г кала)
Таблица 2. Локальные и системные функции микробиоты (В.Н.Бабин, О.Н.Минушкин, А.В.Дубинин и др., 1998)
| Эффект Трофические и энергетические функции — тепловое обеспечение организма Энергообеспечение эпителия Регулирование перистальтики кишечника Участие в регуляции дифференцировки и регенерации тканей, в первую очередь эпителиальных Поддержание ионного гомеостаза организма Детоксикация и выведение эндо- и экзогенных ядовитых соединений, разрушение мутагенов, активация лекарственных соединений Образование сигнальных молекул, в том числе нейротрансмиттеров Стимуляция иммунной системы Стимуляция местного иммунитета, образование иммуноглобулинов Обеспечение цитопротекции Повышение резистентности эпителиальных клеток к мутагенам (канцерогенам) Ингибирование роста патогенов Ингибирование адгезии патогенов к эпителию Перехват и выведение вирусов Поддержание физико-химических параметров гомеостаза приэпителиальной зоны Поставка субстратов глюконеогенеза Поставка субстратов липогенеза Участие в метаболизме белков Участие в рециркуляции желчных кислот, стероидов и других макромолекул Хранилище микробных плазмидных и хромосомных генов Регуляция газового состава полостей Синтез и поставка организму витаминов группы В, пантотеновой кислоты и др. |
Таблица 3. Некоторые физиологические эффекты низкомолекулярных метаболитов микрофлоры, в частности КЖК
| Эффект | Метаболиты |
| Энергообеспечение эпителия | КЖК (уксусная, пропионовая, масляная) |
| Антибактериальный эффект | Пропионовая кислота, пропионат |
| Регуляция пролиферации и дифференцировки эпителия | Пропионовая кислота, пропионат, масляная кислота, бутират |
| Поставка субстратов глюконеогенеза | Пропионовая кислота, пропионат |
| Поставка субстратов липогенеза | Ацетат, бутират |
| Блокировка адгезии патогенов к эпителию | Пропионовая кислота, пропионат |
| Активация фагоцитоза | Формиат |
| Регулировка моторной активности кишечника | ГАМК, глутамат, КЖК и их соли |
| Поставка субстратов для синтеза коферментов | b-Аланин |
| Усиление местного иммунитета | Бутират, масляная кислота |
| Поддержание ионного обмена | Все КЖК и их соли |
Таблица 4. Частота выделения и среднее количество основных представителей кишечной микрофлоры в 1 г кала практически здоровых лиц (С.Д.Митрохин, 1997)
| Название микроорганизма | Частота обнаружения М±m,% | Среднее содержание в 1 г кала M±m, lg |
| Бифидобактерии | 98,0±1,0 | 9,6±0,6 |
| Бактероиды | 90,0±3,0 | 9,2±0,5 |
| Лактобациллы | 96,0±1,0 | 6,9±0,3 |
| Эшерихии, из них | 100 | 7,7±0,3 |
| лактозоотрицательные | 50,0±4,0 | 6,5±0,4 |
| гемолитические | 0 | 0 |
| Протей | 2,0±0,5 | 3,4±0,2 |
| Другие цитратассимилирующие энтеробактерии | 3,0±0,5 | 4,3±0,3 |
| Неферментатирующие бактерии, | 2,0±0,5 | 3,9±0,4 |
| из них синегнойные палочки | 0 | 0 |
| Энтерококки (фекальные стрептококки), | 80,2±2,0 | 5,6±0,5 |
| из них гемолитические | 0 | 0 |
| Стафилококки, | 15,0±3,0 | 3,2±0,3 |
| из них коагулазоположительные | 0 | 0 |
| Пептострептококки | 55,0±5,0 | 6,4±0,6 |
| Вейлонеллы | 23,0±3,0 | 4,7±0,7 |
| Клостридии | 60,0±4,0 | 4,8±0,4 |
| Дрожжевые грибы (Candida albicans) | 0 | 0 |
Таблица 5. Метаболиты кишечной микрофлоры, используемые лабораториями в диагностике дисбиоза кишечника (А.О.Тамм, 1987)
| Метаболит | Исходные вещества | Микроорганизмы, участвующие в расщеплении |
| Индикан | Триптофан | Индолположительные микроорганизмы |
| n-Крезол | Тирозин или фенилаланил | Анаэробные и аэробные микроорганизмы |
| Фенол | То же | Анаэробные и аэробные микроорганизмы |
| Н2, СН4, СО2, С2-С6 жирные кислоты | Глюкоза, лактоза, крахмал, растительная клетчатка | Строгие анаэробы |
| Деконъюгированные желчные кислоты (14СО2) | Конъюгированные желчные кислоты(14С-глицин-гликохолевая кислота) | Бактероиды, бифидобактерии, клостридии, стрептококки и энтеробактерии(?) |
| Аммиак (NH3) | Пептиды, аминокислоты, мочевина | Грамположительные и грамотрицательные анаэробы, энтеробактерии и стрептококки |
Таблица 6. Микробный метаболический паспорт при эубиозе кишечника людей (С.Д.Митрохин, М.Д.Ардатская, 1997)
| Показатели, характеризующие биохимические взаимосвязи в микробиоценозе всей популяции в целом | Значения N, M±m | Показатели, характеризующие внутри- и межгрупповые биохимические взаимосвязи в микробиоценозе | Значения N, M±m |
| Карбоновые кислоты: | . | Профиль ЛЖК: | . |
| пул летучих жирных кислот (ЛЖК), мг/л | 9140±307 | уксусная, % | 63,6±2,4 |
| щавелево-уксусная кислота, мг/л | 9,9±0,8 | пропионовая, % | 23,7±1,6 |
| молочная кислота, мг/л | 378,9±6,9 | масляная, % | 12,8±1,1 |
| a-кетоглутаровая кислота, мг/л | 125,0±9,4 | Анаэробный индекс | -(0,578) |
| . | . | Профиль других карбоновых кислот: | . |
| . | . | молочная, % | 73,7±2,9 |
| Ароматические соединения: | . | a-кетоглутаровая, % | 24,4±1,7 |
| п-крезол, мг/л | 1,0±0,05 | щавелево-уксусная, % | 1,9±0,3 |
| индол, мг/л | 1,2±0,02 | . | . |
| скатол, мг/л | 1,3±0,02 | Профиль фенольных соединений | . |
| фенилпропионовая кислота, мг/л | 1,0±0,01 | п-крезол, % | 28,4±1,9 |
| . | . | индол, % | 34,1±2,2 |
| Амины: | . | скатол, % | 37,2±2,3 |
| метиламин, мг/л | 0,1±0,01 | Профиль аминов: | . |
| гистамин, мг/л | 0,2±0,02 | метиламин, % | 6,8±1,3 |
| серотонин, мг/л | 1,5±0,2 | гистамин, % | 8,5±1,3 |
| . | . | серотонин, % | 84,7±3,2 |
Таблица 7. Анаэробные микроорганизмы, продуцирующие КЖК
Приложение 1. Алгоритм диагностики и лечения заболеваний ЖКТ, сопровождающихся нарушениями микробиоценоза

Приложение 2. Алгоритмы выбора фармакологических средств для коррекции нарушений микрофлоры






По поводу применения препаратов-эубиотиков одно время существовало мнение [16, 25, 55], что бактериальные препараты малоэффективны в связи с быстрой элиминацией вводимых в агрессивную среду штаммов. Однако с усовершенствованием биотехнологических процессов создания эубиотиков на рынке появились высокоэффективные жидкие препараты, которые наряду с живыми культурами бифидо- и лактобактерий содержат продукты их жизнедеятельности и компоненты, обеспечивающие их лучшее «приживление» в кишечнике.
Однако, как указывалось выше, нарушения микробиоценоза, как правило, являются следствием функциональной или органической патологии ЖКТ.
Таким образом, современные принципы лечебной коррекции дисбиотических сдвигов и восстановления эубиоза включают более широкий арсенал мероприятий.
- Этиопатогенентическое лечение основной патологии [при СРК — в первую очередь мероприятия, направленные на коррекцию моторно-эвакуаторной функции кишечника, например, с использованием миотропных спазмолитиков, блокаторов Na/Са-каналов — дюспаталин и т.д.; при воспалительных заболеваниях кишечника, в частности НЯК, — на купирование воспаления и т.д. с ипользованием препаратов 5-АСК или глюкокортикоидных гормонов (месалазин, будесонид, гидрокортизон и т.д.); при хроническом панкреатите с внешнесекреторной недостаточностью поджелудочной железы обязательным является проведение ферментно-заместительной терапии (панкреатин и т.д.); при патологии билиарного тракта, сопровождающейся билиарной недостаточностью, необходимо использование препаратов, содержащих желчные кислоты и т.д.]
- Селективная деконтаминация патогенной и условно-патогенной микрофлоры (при необходимости) — с помощью кишечных антисептиков широкого спектра действия (интетрикс, энтерофурил и т.д.), культур бактерий (или фугатов*), обладающих антагонистической активностью (бактисубтил, энтерол, бактистатин* и др.), или с использованием энтеросорбентов (смекта, полифепан, карболен и т.п.).
- Коррекция автохтонной микрофлоры — применение препаратов-эубиотиков (нормофлорины Л, Б, биовестин лакто, аципол, примадофилус и др.), симбиотиков (нутралин) на фоне приема препаратов-пребиотиков метаболитного типа (хилак форте) или препаратов лактулозы (дюфалак и т.п).
- Коррекция местного и системного иммунитета — комплексные иммунные препараты (КИП) [1, 14], рекомбинантные пробиотики (субалин, бифилиз, вигел).
- Функциональное питание с большим количеством балластных веществ (пищевые волокна, отруби), продукты, обогащенные живыми культурами бактерий (кефир »Бифидок», «Данон», кисломолочные смеси »Нарине», йогурты и др.).
По нашим данным, мы можем констатировать, что у 100% больных как с патологией ЖКТ, так и при патологии других органов и систем диагностируются изменения со стороны микрофлоры и ее активности [5-8, 24, 28, 35]. Например, исследования КЖК в кале проведены более чем у 500 пациентов с функциональными и воспалительными заболеваниями кишечника (функциональный запор и диарея, различные варианты СРК, НЯК) на фоне проводимого лечения препаратами различных фармакологических групп: миотропные спазмолитики, прокинетики, слабительные средства, антидиарейные препараты, про- и пребиотики, кишечные антисептики и антибактериальные препараты, энтеросорбенты и др. [6, 8, 9, 23, 26, 27, 29, 31].
Результаты работы показали, что использование средств, как непосредственно воздействующих на микрофлору, так и не оказывающих прямое влияние на нее, приводило к восстановлению микробиоценоза кишечника. Причем в первом случае данный факт легко объясняется. Во втором случае, по нашему мнению, нормализация моторно-эвакуаторных расстройств кишечника приводит к естественной деконтаминации условно-патогенной микрофлоры за счет изменения внутриполостного окислительно-восстановительного потенциала кишечника. С нормализацией среды обитания активизируется метаболизм и увеличивается численность облигатной микрофлоры, что в свою очередь влияет на преэпителиальный и эпителиальный барьер защиты кишечной стенки и восстанавливает чувствительность рецепторного аппарата кишечника.
На основании полученных фактов изучения КЖК были разработаны критерии, позволяющие индивидуализировать подбор проводимого лечения, что привело к повышению эффективности терапии у данной категории больных [2, 29]. Были выделены типы изменения КЖК, являющиеся параметрами выбора фармпрепаратов различных групп (см. Приложение 2. «Алгоритмы выбора фармакологических средств»).
- первом типе изменений спектра КЖК, характеризующем активность анаэробных микроорганизмов в основном родов Propionibacterium, Bacteroides (отдельных штаммов), наиболее эффективной является терапия с использованием препарата из группы пребиотиков — энтеросана;
- втором типе изменений спектра КЖК, характеризующем активность анаэробных микроорганизмов в основном родов Bacteroides, Clostridium, Eubacterium, Coprococcus, Fusobacterium и штаммов анаэробных микроорганизмов, обладающих протеолитической активностью, наиболее эффективной является терапия с использованием антидиарейных препаратов биологического происхождения (бактисубтил или бактистатин);
- третьем типе изменений состава и спектра КЖК, характеризующем активность некоторых штаммов анаэробных микроорганизмов (в основном родов Bacteroides, Clostridium, Eubacterium, Coprococcus, Clostridium, Fusobacterium), принимающих участие во вторичном обмене желчных кислот и холестерина (в 7a-дегидроксилировании), наиболее эффективной является терапия с использованием невсасывающегося и непереваривающегося в тонкой кишке синтетического дисахарида — лактулозы или препаратов метаболитного типа (хилак форте);
- четвертом типе изменений состава и спектра КЖК, характеризующем активность факультативных аэробных микроорганизмов, обладающих протеолитической активностью (Е. coli, энтерококки, стрепто-, стафилококки) наиболее эффективной является терапия с использованием препаратов лактулозы, обладающих осмотическим слабительным эффектом, бифидогенным и лактогенным свойствами;
- пятом типе изменений состава и спектра КЖК, характеризующем повышение активности факультативной и появление условно-патогенных аэробных микроорганизмов, обладающих протеолитической и гемолитической активностью (гемолитические штаммы Е. coli и др., клебсиелла, протей и др.), наиболее эффективной является терапия с использованием препаратов — невсасывающихся кишечных антисептиков (интетрикс, энтерофурил и т.п);
- шестом типе изменений состава и спектра КЖК, характеризующем незначительное изменение активности облигатной и факультативной микрофлоры, нерезко выраженном дисбалансе анаэробно-аэробных популяций микроорганизмов наиболее эффективной является терапия с использованием препаратов — про- и пребиотиков (хилак форте, нормофлорины Л,Б, биовестин лакто).
Таким образом, в результате работы разработаны адекватные подходы к лечению пациентов с заболеваниями ЖКТ с учетом индивидуальных показаний, включающие подбор эффективной дозы препаратов, проведение комбинированного лечения для достижения максимальной эффективности терапии и предотвращение резистентности.
Кроме того, установленный факт изменения состава и активности микрофлоры на фоне лечения привел к выводу, что ремиссия основной патологии приводит к стабилизации и нормализации микробиоценоза. С другой стороны, целенаправленное воздействие на микрофлору приводит к повышению эффективности лечения основного заболевания.
Подводя итог изложенному, хотелось бы отметить, что на настоящем этапе кишечную микрофлору следует рассматривать с позиции одной из функциональных систем макроорганизма, которая находится в тесной взаимосвязи с другими функциональными системами; при этом конечный результат их взаимодействия направлен на выравнивание нарушенного равновесия.
Кишечная микрофлора, неся большую функциональную нагрузку, не может не участвовать в возникновении и поддержании функциональных и патологических расстройств, и поэтому выбор терапии должен быть корректным и направлен на то звено нарушенной регуляции, которое утратило возможность самовосстановления.
Необходимо подчеркуть важность врача общей практики в ведении пациентов с нарушениями микробиоценоза кишечника, так как именно к нему обращаются пациенты со словами: «Доктор, у меня страшная болезнь — дисбактериоз».
В первую очередь нельзя гиперболизировать данный синдром, а необходимо верифицировать патологию ЖКТ, приведшую к его нарушениям. Назначение адекватной диагностической программы, с использованием в первую очередь исследования метаболитов микрофлоры (биохимический экспресс-анализ кала на «дисбактериоз»), позволит избежать ряд трудоемких и инвазивных процедур, правильно оценить ситуацию и проводить как этиопатогенетическое лечение основной патологии, так и коррекцию микроэкологических нарушений.
Это приведет не только к повышению эффективности лечения, но и позволит снизить стоимость лечения и избежать полипрагмазии.
Дисбактериоз — симптомы и лечение
Что такое дисбактериоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Людевиг Анны Алексеевны, терапевта со стажем в 10 лет.
Над статьей доктора Людевиг Анны Алексеевны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
От редакции: диагноз «дисбактериоз» не включён в международную классификацию болезней (МКБ-10), его используют врачи только в России и странах СНГ. Дисбактериоз сопутствует другим патологиям, но было бы неверно однозначно утверждать, что эти патологии вызывает именно нарушение баланса микрофлоры. Изучение взаимосвязи между деятельностью микробиома и возникновением различных заболеваний — одно из перспективных направлений в медицинских исследованиях.
Что такое микрофлора кишечника и для чего она нужна
Организм человека населяют свыше триллиона бактерий. В их микробиоме в сто раз больше генов, чем в нашем собственном геноме. Они живут на коже, слизистых, в пищеварительном тракте.
Кишечное сообщество, которое мы приютили в своём организме, обладает метаболической активностью, как у целого органа. Оно помогает нам выжить, поэтому мы в корне зависим от наших колонизаторов, как и они от нас.
В норме кишечник обеспечивает среду для роста микроорганизмов, а флора поддерживает «равновесие» в организме хозяина:
- стимулирует рост энтероцитов — клеток кишечной стенки;
- помогает перерабатывать и усваивать питательные вещества;
- подавляет рост патогенных микроорганизмов;
- регулирует иммунитет и воздействует на его нарушенные звенья;
- контролирует энергетический и липидный обмен;
- участвует в развитии и функционировании мозга.
Микрофлора или микробиота — это экосистема, в которой преобладают бактерии, в основном строгие анаэробы, которым для жизни не нужен кислород. В ней есть и другие микроорганизмы: вирусы и бактериофаги, простейшие, археи (одноклеточные живые организмы) и грибы. Всего в микробиоте свыше семи тысяч штаммов.
Дисбактериоз, или дисбиоз — это синдром, при котором нарушается соотношение между представителями микрофлоры. Он не является болезнью, но лежит в основе множества заболеваний — кишечных, общевоспалительных, аутоиммунных и нейропсихических.
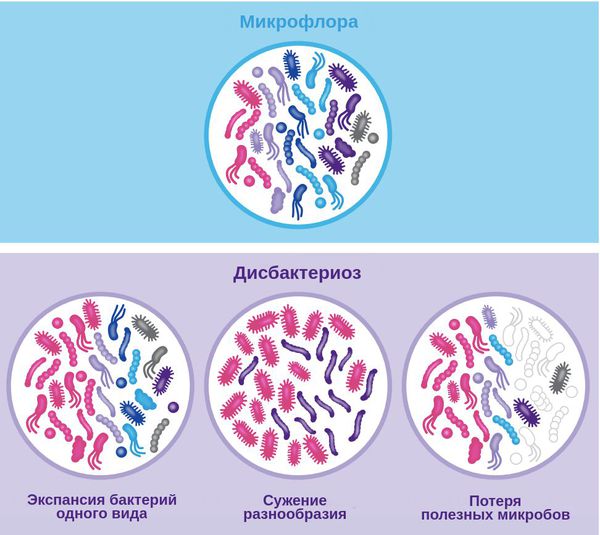
Нарушение состава микрофлоры также может влиять на поведение человека и скорость старения: при сужении микробного разнообразия оно происходит быстрее в сравнении с темпами здорового старения [1] .
Соотношение различных видов микроорганизмов нарушается по многим причинам:
- Диета и режим питания — пища с высоким содержанием животных жиров, сахара и крахмала, ограничением клетчатки и избытком животных белков.
- Продукты с пищевыми добавками — бисульфитом и сульфитом натрия, наночастицами металлов и антибиотиками [3][4] .
- Избыточная гигиена — нарушение водно-жировой мантии кожи из-за использования бактерицидных средств для умывания (особенно с салицилатами).
- Гормональный дисбаланс . При избытке андрогена у женщин состав микробиоты нарушается, а при низком альфа- и бета-разнообразии сообществ бактерий в кишечнике повышается риск развития синдрома поликистозных яичников [5] .
- Употребление алкоголя — уменьшается количество лактобактерий и появляются микроорганизмы, которые могут повредить слизистую. Например, Neisseria из этанола синтезирует такое ядовитое вещество, как ацетальдегид [26] .
- Первичный и вторичный иммунодефицит . Из-за нарушения звеньев иммунитета растёт число микроорганизмов и формируется новая микрофлора, которая меняет иммунный ответ, образуя порочный круг.
- Травма и острое воспаление . В ответ на нарушение целостности тканей организма иммунитет экстренно активируется и нарушает соотношение бактерий [6] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы дисбактериоза
Когда защитная функция слизистой оболочки кишечника нарушается, иммунная система перестаёт адекватно реагировать на кишечную микрофлору. В связи с этим возникают разнообразные симптомы:
- При нарушении дисбактериозе кишечника могут беспокоить запоры, диарея или их сочетание, вздутие, урчание в животе, отрыжка, чувство тяжести после еды, повышенная чувствительность к определённой пище (особенно злаковой и молочной), боли и дискомфорт.
- При нарушении кожной микрофлоры появляются разнообразные сыпи, шелушение, покраснение, зуд, сухость или жирность кожи.
- При генитальном дисбактериозе типичным признаком является кандидоз (молочница). Иногда могут возникать нетипичные выделения и дискомфорт вплоть до болезненности.
- При дисбактериозе полости рта развиваются стоматит, пародонтоз и кариес , появляется неприятный привкус и запах изо рта, постоянный налёт на языке.
Когда под влиянием дисбиоза начинают развиваться различные болезни, появляются другие симптомы:
- При нейропсихических заболеваниях появляется усталость, апатия, тревога, снижается настроение, ухудшается концентрации внимания, возникают навязчивые мысли, усиленная реакция на стресс, судороги.
- При инсулинорезистентности происходит набор веса, повышение сахаров и липидов в крови, возникает тяжесть в правом боку.
- При системном воспалении и аутоиммунитете до полноценного развития болезни и постановки диагноза появляются отдельные проявления в виде болей в суставах, кожных высыпаний, неадекватных сосудистых реакций, примесей слизи или крови в кале, неинфекционного подъёма температуры тела, озноба, общей слабости.
- При аллергии появляется диарея после употребления аллергенных продуктов (особенно молочных, злаковых, цитрусовых, красных фруктов и овощей, ягод, шоколада, орехов) и зудящий дерматит.
Патогенез дисбактериоза
Колонизация кишечника бактериями начинается при прохождении младенца через родовой канал. В этот момент он получает микробиоту своей матери — лактобациллы, Prevotella и другие. При кесаревом сечении микробный состав изменяется. Он напоминает кожу матери: появляются стафилоккоки, коринебактерии и пропионобактерии.
Во время грудного вскармливания увеличивается количество бифидобактерий. Они необходимы для использования олигосахаридов материнского молока. При недостаточном питании формирование этих бактерий нарушается, что приводит к стойкой незрелости микробиоты и риску развития дисбактериоза.
В зависимости от типа дисбиоза и особенностей организма могут включаться различные патологические пути.
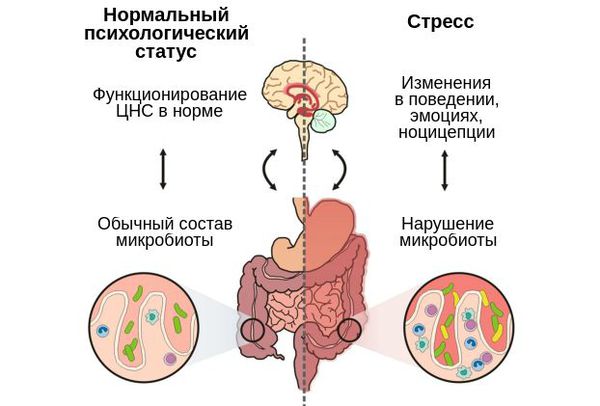
Путь «Дисбактериоз — кишечник — мозг»
Микробиота кишечника влияет не только на физическое, но и на психологическое состояние человека. Её связь с мозгом осуществляется через блуждающий нерв (вагус) и ключевые центральные медиаторы :
- бифидобактерии infantis влияют на центральную передачу серотонина [11] ;
- лактобациллы и бифидобактерии продуцируют гамма-аминомаслянную кислоту (ГАМК);
- кишечные палочки, Bacillus и Saccharomyces spp. могут производить норадреналин;
- кандида, стрептококки, кишечные палочки и энтерококки синтезируют серотонин;
- Bacillus может продуцировать дофамин;
- лактобациллы способны производить ацетилхолин.
Ось гипоталамус-гипофиз-надпочечник регулирует реакции на стресс и может значительно влиять на ось микробиом-кишечник-мозг [12] .
Путь «Микробиота — воспаление — инсулинорезистентность»
Полезные бактерии вырабатывают короткоцепочечные жирные кислоты, которые усиливают связи между клетками кишечника, препятствуя попаданию токсичных соединений в кровоток [8] . Когда численность нормальной флоры снижается, изменяется состав кишечной слизи — муцина. В связи с этим защитный барьер слабеет, развивается так называемый “синдром дырявого кишечника” — токсины из пищеварительной системы попадают в кровоток, запуская системное воспаление [14] .
Организм разделяет флору на “свой-чужой” при помощи толл-рецепторов. Когда к рецептору присоединяется патоген, происходит передача информации об опасности внутрь клетки, где через каскад реакций запускается иммунный ответ, направленный на борьбу с возбудителем. Высвобождаются секреторный IgA, антимикробные пептиды и хемокины [15] . Это ведёт к активации макрофагов, которые начинают выделять интерлейкин-1b и фактор некроза опухоли альфа. Эти вещества блокируют путь инсулина внутрь клетки. В результате развивается инсулинорезистентность [7] [17] . Без своего проводника глюкоза накапливается в крови,что приводит к диабету II типа .
Путь «Дисбактериоз — ожирение — печень»
О количестве съеденного организм узнаёт по уровню всё тех же короткоцепочечных жирных кислот, вырабатываемых флорой. При низком потреблении клетчатки — овощей и отрубей — этих жирных кислот вырабатывается мало. В ответ на это кишечник замедляет эвакуацию, чтобы запасти побольше энергии. В итоге запускается адипогенез — отложение жира.
Ещё одним веществом, которое обеспечивает передачу сигналов о чувстве сытости из кишечника в гипоталамус, является гуанилилциклаза C. При дисбиозе эта передача ослабляется, что ведёт к перееданию и набору веса [18] .
При синдроме избыточного бактериального роста запускается процесс местного воспаления, повышается проницаемость кишечной стенки. Это ведёт к попаданию токсинов в кровь и общей воспалительной реакции, в результате которой поражается различный органы, в том числе и печень. При развитии инсулинорезистентности запускается глюкокиназный путь поступления глюкозы в клетки печени, из-за чего в органе накапливаются жировые включения. В дальнейшем развивается неалкогольная жировая болезнь печени [19] .
Путь «Дисбактериоз — аутоиммунитет»
Изменённая композиция микробиоты воздействует на кишечную иммунную систему. Иммунитет, активированный дисбактериозом кишечника, запускает каскад воспалительных реакций, что приводит к поражению суставов, кожи, почек, кишечника и т. д. Если реакция защитных сил чрезмерна, развиваются аутоиммунные заболевания.
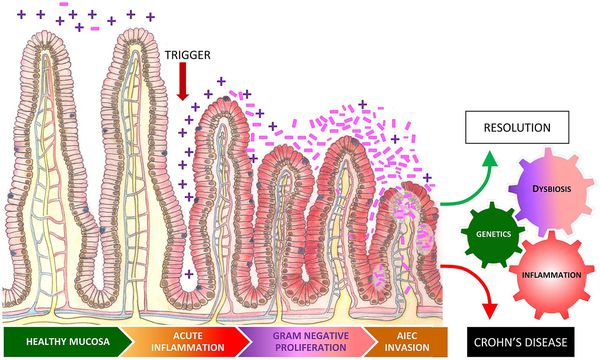
Хронический воспалительный ответ, который вызывает дисбиоз, также может поспособствовать развитию ревматических заболеваний.
Путь «Дисбактериоз — аллергия»
Полезные бактерии поддерживают баланс иммунного ответа в организме.
Они стимулируют подавление IgE и лимфоцитов Th1 и Th2, которые сдерживают паразитарную инфекцию. Если популяция полезных микроорганизмов не развивается, это может привести к аллергическим ответам.
Полезная микрофлора формируется во младенчестве и сохраняется на всю жизнь вместе с особенностями иммунных ответов [9] . Помешать появлению адекватного альфа-разнообразия микробиомов в этот период, помимо рождения через кесарево сечение, могут такие факторы, как:
- раннее воздействие антибиотиков;
- отсутствие домашних животных;
- постоянная обработка дома обеззараживающими средствами.
В итоге, если слишком тщательно оберегать ребёнка от столкновения с инфекциями, у него резко повышается риск развития аллергических заболеваний.
Классификация и стадии развития дисбактериоза
Из-за разнообразия агентов микрофлоры и проявлений дисбиоза, классификация нарушения микрофлоры весьма условна.
Традиционно выделяют три степени дисбиоза:
- I степень — снижение нормофлоры;
- II степень — развитие условно-патогенной флоры;
- III степень — присоединение патогенной флоры.
Кроме изменений микрофлоры важно знать, в микробиоме какого органа произошло нарушение. В связи с этим различают кишечный и внекишечный дисбактериоз. К внекишечным формам относятся:
- дисбиоз ротовой полости;
- дисбиоз кожи;
- дисбиоз половых органов;
- дисбиоз мочевыводящих путей;
- дисбиоз дыхательной системы.
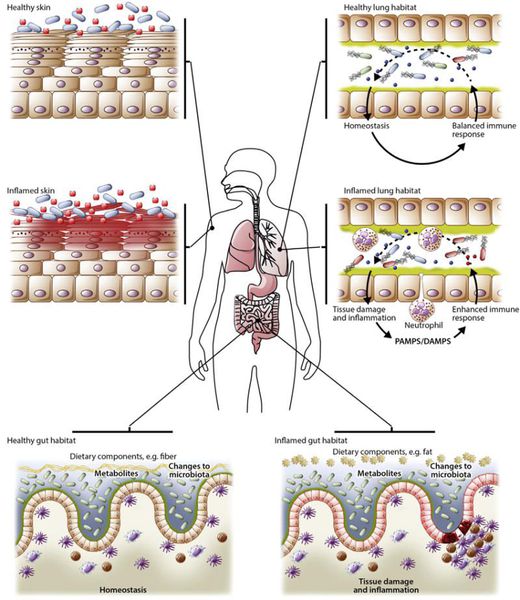
По течению дисбактериоз кишечника условно подразделяют на три стадии:
- латентный дисбиоз — без проявлений, выявляется только по результатам анализов;
- дисбиоз с кишечной симптоматикой — возникает нарушение стула, боли в животе;
- стадия развития осложнений — инсулинорезистентности, нейровегетативных нарушений, хронического колита , дерматита и вагинита.
В зависимости от того, в каком отделе кишечника возникло нарушение, выделяют:
- дисбактериоз тонкого кишечника — диарея водянистая, вздутие живота появляется сразу после еды;
- дисбактериоз толстого кишечника — кал кашицеобразный, вздутие возникает к вечеру.
Осложнения дисбактериоза
Симптомы дисбактериоза кишечника с трудом можно отличить от симптомов его осложнений. Всё потому, что дисбиоз — синдром, который вносит существенный вклад в развитие многих болезней.
Осложнения можно разделить на несколько групп:
- нейропсихические болезни : депрессия , болезнь Альцгеймера , рассеянный склероз , тревожное расстройство , шизофрения , аутистические расстройства, болезнь Паркинсона ;
- болезни, связанные с невосприимчивостью к инсулину : инсулинорезистентность, дислипидемия , ожирение , сахарный диабета II типа , гипертония , неалкогольная жировая болезнь печени[7] ;
- аутоиммунные патологии : сахарный диабет I типа, ревматоидный артрит, системная красная волчанка, первичный склерозирующий холагнит [8] ;
- аллергические заболевания — бронхиальная астма , атопический дерматит , пищевая аллергия [9] ;
- системные воспаления — болезнь крона, язвенный колит , синдром раздражённого кишечника, целиакия и колоректальный рак.
Нейропсихические болезни
Депрессия и тревожное расстройство коррелируют с преобладанием Firmicutes над Bacteroides [12] .
Рассеянный склероз связан с значительным сокращением видов Clostridia XIVa и IV, увеличением содержания Methanobrevibacter и Akkermansia и уменьшением числа Butyricimonas [8] .
На мышиной модели болезни Альцгеймера в амилоидных бляшках накапливается микробиота [13] .
Связь шизофрении, аутистических расстройств и болезни Паркинсона с дисбиозом доказана. Но о том, являются ли эта связь основной или сопутствующей, до сих пор ведутся споры.
Аутоиммунные патологии
Сахарный диабет I типа связан с положительной корреляцией между аутоантителами и микрофлорой — островковыми клеткам, Bacteriodes и Bilophila. Также обнаружена отрицательная связь со Streptococcus и Ruminococcaceae. Кроме того, распространение Faecalibacterium приводит к снижению уровня гликированного гемоглобина [8] .
Ревматоидный артрит усиливается из-за молекулярной мимикрии — бактерии Prevotella copri, Parabacteroides sp. и Butyricimonas воспроизводят структуру двух аутоантигенов организма. В результате антигенов в воспалённой синовиальной ткани становится намного больше. И чем больше антител GNS, тем выраженнее симптомы артрита(8). Снизить боль, отёчность и улучшить показатели крови во время различных фаз артрита можно с помощью пробиотиков [22] .
Системная красная волчанка сопровождается снижением видового разнообразия микрофлоры. При это в пять раз увеличивается число бактерии Ruminococcus gnavus. Количество антител к этим бактериям напрямую связано с активностью заболевания [20] .
Первичный склерозирующий холагнит связан с уменьшением разнообразия микрофлоры. После трансплантации фекальной микробиоты альфа-разнообразие увеличивается. Из-за этого щелочная фосфатаза снижается более чем в два раза, что свидетельствует о влиянии микробиоты на аутоиммунные процессы в протоках печени [21] .
Аллергические заболевания
Бронхиальная астма связана с увеличением респираторной микрофлоры — гемофильной палочки, стрептококков, бактерий Moraxella — и снижением кишечного микробиома — бифидобактерий, бактерий Akkermansia, Faecalibacterium, Morganella, Lactobacillus. Ослабить аллергическую реакцию может вдыхание «сельскохозяйственной пыли», которая насыщена бактериями и их компонентами.
Атопический дерматит возникает при колонизации кожи золотистым стафилококком на фоне повышенной чувствительности иммунной системы и нарушения кожного барьера. Суперантигены стафилококков усиливают концентрацию IgE — антител, призванных защищать организм от паразитов. Если антитела отсутств уют, антигены атаку ют собственные ткани и вызывают аллергию — активируют воспалительные лимфоциты Th2 / Th22 и способствуют появлению дендритных клеток [23] .
Обратный эффект достигается при эпидермальном стафилококке. Он подавляет выработку CD4 — белых кровяных телец, участвующих в иммунном ответе. Мембранный белок TLR-2, связываясь с нормальной флорой кожи , стимулирует выработку антимикробных пептидов и увеличение плотных контактов, что усиливает кожный барьер.
Аллергия на еду появляется при чрезмерном разнообразии микрофлоры. Избыточное микробное обогащение кишечника у 3-месячных детей увеличивает риск развития гиперчувствительности к пище к годовалому возрасту. При обогащении кишечника микробами в 12 месяцев этого уже не происходит.
Когда количество бактерий Ruminococcaceae и Lachnospiraceae повышается, у детей развивается аллергия на молоко. Если же флора обогащена бактериями Firmicutes, включая Clostridia, то аллергия может разрешиться к школьному возрасту.
Аллергии на арахис или древесные орехи возникает при уменьшенном микробном разнообразии и увеличении числа бактерий Bacteroidetes. Выраженность симптомов аллергии и диарея могут ослабнуть при наличии или пероральном введении 17 штаммов Clostridia.
Системные воспаления
Болезнь Крона и язвенный колит возникают из-за чрезмерно агрессивного иммунного ответа на полезную кишечную флору у генетически восприимчивых людей. Разложение флорой белков, пептидов и аминокислот в дистальной части толстой кишки приводит к образованию различных биологически активных метаболитов, которые могут влиять на жизнеспособность клеток эпителия. Снижение количества видов бактерий, которые вырабатывают бутират, ведёт к чрезмерной активация толл-рецепторов, которая может нарушить иммунитет за счёт изменения в активности работы генов .
Синдром раздражённого кишечника связан с уменьшением количества лактобацилл, бифидобактерий и повышением числа аэробов по сравнению с анаэробами. Это нарушение микрофлоры модифицирует болевые и моторные реакции [12] .
Микробиота в данном случае становится и причиной, и мишенью нарушений моторики кишечника, висцеральной гипер чувствительности и нейроиммунных сигналов. Происходит это из-за нарушения слизистого барьера, активации рецепторов, к которым крепятся бактерии, а также дисфункции оси гипоталамус-гипофиз-надпочечник (ось ГГН).
Как возникает дисфункция оси ГГН? Цитокины и избыток короткоцепочечных жирных кислот повышают уровень кортизола — гормона стресса. Он поступает в гипофиз, гипоталамус, миндалину, гиппокамп и префронтальную кор у . Обратный сигнал из мозга привод и т к изменению моторики и чувствительности кишечника, нарушается эпителиальный барьер и выработка нейротрансмиттеров в виде повышенной реакции на факторы окружающей ср еды.
Почему нарушается моторика кишечника? Микробиота модулирует моторную функцию кишечника. Её состав может измениться через толл- и нод-рецепторы. В результате повышается проницаемость кишечной стенки, и метаболиты бактерий получают доступ к подслизистой оболочке. Это изменяет экспрессию генов, которые участвуют в работе гладких мышц и нейротрансмиссии. Нормальная кишечная палочка усиливает сокращение толстой кишки, а патогенные штаммы E. coli нарушают сократимость мышечных клеток и угнетают моторику. Воздействие Lactobacillus rhamnosus значительно ухудшает ацетилхолин-стимулируемое сокращение.
Целиакия — уникальное аутоиммунное заболевание. Его причиной являются генетические факторы DQ2 / DQ8 и триггер среды — глютен, но их недостаточно для развития болезни. Пусковой механизм целиакии — нарушение микробиоты у предрасположенных детей в момент введения прикорма — высокие пропорции Firmicutes, Proteobacteria, Corynebacterium, Gemella, Clostridium, Enterobacteriaceae и Raoultella и более низкие Actinobacteria, Bifidobacterium [32] .
Так как непереносимость глютена во взрослой жизни после многих лет употребления злаков встречается всё чаще, дополнительным фактором формирования целиакии становится воздействие окружающей среды.
Колоректальный рак — рак прямой кишки — также связан с нарушением микрофлоры. Запущенный дисбактериоз запускает хроническое воспаление. Из-за этого накапливаются продуцируемые хозяином антибактериальные пептиды, секреторные IgA, муцины, цитокины или нейромедиаторы. Также в организме скапливаются остатки повреждённых клеток и много активных форм кислорода и азота. При ошибках копирования во время деления кишечных клеток (дисплазии) эти вещества способствуют злокачественному перерождению.
Развитие рака происходит по модели «водитель — пассажир»:
- «водители» — определённые штаммы бактерий — нарушают микросреду слизистой оболочки, повреждая ДНК;
- «пассажиры» — патологическая флора — после повреждения оболочки колонизируют её, что приводит к хроническому воспалению, прямому повреждению тканей и зарождению опухоли [15] .
Другие осложнения дисбактериоза
Повышается риск заражения венерическими заболеваниями , в том числе ВИЧ-инфекцией . У девушек этому способствует дефицит бактерий Lactobacillus, которые продуцируют молочную кислоту и пероксид водорода для защиты от патогенных микроорганизмов [29] . У мужчин риск приобретения ВИЧ-инфекции повышается при высокой концентрации анаэробных бактерий в микробиоте под крайней плотью.
Угроза преждевременных родов . У женщин до 24 недели беременности маркером такого риска могут служить более низкие вагинальные уровни Lactobacillus crispatus и более высокие уровни BVAB1, Sneathia amnii, TM7-H1, Prevotella и девять дополнительных таксонов [7] .
Риск развития сердечно-сосудистых заболеваний . ДНК бактерий пародонта была обнаружена в атеросклеротических бляшках у пациентов, страдающих ишемической болезнью сердца и атеросклерозом . Бактерии могут инициировать или усугублять атеросклеротические процессы. При этом активируется врождённый иммунитет, напрямую вовлекаются медиаторы, которые активируются антигенами зубного налёта [15] .
Риск развития рака пищевода — аденокарциномы и плоскоклеточного рака. Этот риск связан с составом микробиома полости рта. Пародонтальные патогены Tannerella forsythia и Porphyromonas gingivalis коррелируют с повышенным риском аденокарциномы. Более низкий риск этой болезни наблюдался в связи с истощением полезного рода Neisseria и Streptococcus pneumoniae. Также есть взаимосвязь бактериального биосинтеза каротиноидов с защитой от развития аденокарциномы [27] .
Диагностика дисбактериоза
Диагностика дисбактериоза проводится:
- для лабораторной оценки состояния больного в момент обращения;
- для научно-исследовательской работы, чтобы понять механизмы возникновения заболеваний и разработать методы их лечения, направленные на блокирование механизмов развития патологий.
Исследователи чаще используют генотипирование микробиоты методами ПЦР Real-time (в режиме реального времени), исследуя 16S pРНК бактерий. В клинической практике врач проводит посевы микрофлоры, реже ПЦР и микроскопию.
Молекулярная идентификация — это определение последовательностей ДНК или РНК представителей микрофлоры. Проводится не для всех видов бактерий и вирусов, но их число становится всё больше. Бывают одноцелевые (видовые) и мультиплексные (таксонные) анализы.
Для увеличения количества копий ДНК и улучшения качества идентификации используют амплификацию — многократный повтор исследования. Она позволяет обнаружить даже незначительное количество микроорганизмов.
Существует несколько вариантов амплификации:
- целевая амплификация — к ней относятся ПЦР и обратная транскриптаза-ПЦР;
- амплификация транскрипции и смещения цепи;
- аплификация сигнала — гибридный захват и анализ разветвлённой ДНК;
- ПЦР Real-time — анализ микроматрицы и кривой ликвидуса.
Чаще всего разнообразие микрофлоры изучается с помощью метода ПЦР. Ген 16S рРНК является идеальной мишенью для классификации бактерий из-за его девяти областей, которые помогают различить виды с помощью отдельных нуклеотидных полиморфизмов.
Методы биоинформатики — QIIME, Mothur и Genboree — были разработаны для обработки таксономической информации, полученной из исследований 16S. Эти инструменты упрощают процесс фильтрации качества, выбора таксономических единиц работы, удаления химерной последовательности и назначения таксономии. Они также могут выполнять базовый анализ микрофлоры, включая измерение альфа-разнообразия (в пределах сообщества) и бета-разнообразия (между сообществами). При этом необходимо учитывать вклад вирусов и грибов в микробиомные взаимодействия [29] .
Посевы (тест-культура) — исследования, которые выявляют рост микробов на питательной твёрдой или жидкой среде для дальнейшей идентификации и определения чувствительности к антибиотикам . Они особенно важны в клинической практике, так как позволяют подобрать лечение при обнаружении инфекции на фоне дисбактериоза.
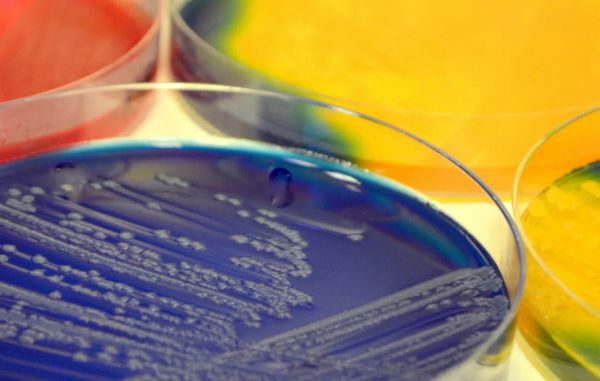
Хотя большинство образцов материала высевают на среду общего назначения (например, кровяной или шоколадный агар), некоторые болезнетворные микроорганизмы требуют определённых питательных веществ, ингибиторов или других специальных условий. Если есть подозрение на наличие особых микроорганизмов, если пациент принимал антибактериальные препараты, а также при некоторых особых случаях (например, при наличии ВИЧ-инфекци), нужно об этом сообщить в лабораторию.
Микроскопия охватывает не все микроорганизмы, зато проста и помогает в предварительном выборе антибиотиков при подозрении на инфекцию, пока ожидаются результаты окончательной идентификации.
Научные открытия в области диагностики
Благодаря комплексным исследованиям микробных сообществ MetaHit и Human Microbiome Project стал известен состав и молекулярный профиль здорового кишечного микробиома. Это знание позволило более точно анализировать последовательности ДНК хозяина, микробной ДНК (генома) и РНК (транскриптома) [34] .
Недавние достижения в технологиях молекулярной биологии — омикс-технологиях — позволили контролировать концентрации различных биологических молекул. Благодаря этому теперь можно определить их вариации микроорганизмов в различных биологических состояниях в масштабе генома.
Несколько популярных «омических» платформ включают:
- транскриптомику , которая измеряет уровни транскриптов мРНК;
- протеомику , которая количественно определяет содержание белка;
- метаболомику , которая определяет содержание мелких клеточных метаболитов;
- интерактомику , которая разрешает весь набор молекулярных взаимодействий в клетках;
- флюксомику , которая устанавливает динамические изменения молекул внутри клетки с течением времени.
Лечение дисбактериоза
Диета
Рацион питания оказывает сильнейшее влияние на микробиоту кишечника. Достичь здорового статуса микрофлоры можно при низком потреблении животных жиров и простых углеводов, включении в рацион овощей и пищи с высоким содержанием клетчатки, а также при разнообразии потребляемых продуктов.
Диета при нарушении микробиома должна быть максимально полной: чем шире рацион, тем богаче микробное разнообразие. При наличии симптомов метеоризма и неустойчивого стула следует избегать сырых овощей (лучше есть их в виде рагу) и фруктов натощак.
Если есть пищевые непереносимости, приводящие к дисбиозу, то придётся исключить:
- молочные продукты при лактазной недостаточности;
- глютен — при целиакии;
- продукты, на которые есть подтверждённая кишечная аллергия.
Кишечник и флора не любят зажаристую мясную корочку, поэтому тушение продуктов всегда лучше, чем жарка.
Пробиотики
Однозначного мнения о пользе приёма пробиотиков для лечения дисбактериоза пока нет. В исследованиях отмечалось такие положительные эффекты:
- улучшение по шкале Бека при депрессии;
- уменьшение висцеральной чувствительности и нормализация моторики кишечника при синдроме раздражения кишечника и инфекционном энтероколите;
- снижение активности аутоиммунитета при воспалительных заболеваниях кишечника, системной красной волчанки и ревматоидном артрите.
О снижении инсулинорезистентности данные неоднородны.
В западных странах терапия пробиотиками является дополнением к патогенетическому лечению — блокировки механизмов развития болезни. Решение о её назначении остаётся за врачом.
В России лакто-бифидопробиотики в дозах от 10 9 бактерий в капсуле рекомендованы при болезнях кишечника и как дополнительная терапия аутоиммунных и аллергических заболеваний. Тем не менее, остаётся вопрос длительности применения пробиотиков, так как изолированные заселяемые бактерии (в отличие от фекалотрансплантации) не приживаются, но помогают вытеснить патобионтов и дают возможность угнетённой нормофлоре самостоятельно восстановиться.
Важно, что для лечения различных патологий нужны различные штаммы бактерий :
- при болезни Крона и аллергии эффективен и безопасен Lactococcus lactis, экспрессирующий IL-10;
- при диабете добавление пробиотиков в течение восьми недель предотвращает повышение FPG, снижает уровень hs-CRP в сыворотке и увеличивает общий GSH в плазме [35] ;
- при диабете у беременных приём пробиотических добавок в течение 12 недель в первой половине беременности благотворно влияют на маркеры метаболизма инсулина, триглицериды, биомаркеры воспаления и окислительный стресс;
- при запоре добавки с некоторыми пробиотическими штаммами Lactobacillus или Bifidobacterium увеличивают частоту стула и снижают время транзита содержимого кишечника;
- при диарее живые пробиотики высокой концентрации (10 10 КОЕ/мл) замедляют сокращение мышц толстой кишки [36] ;
- при ревматоидном артрите приём добавок пробиотика в течение 8 недель снижает активность заболевания, уровень инсулина и его выделение [37] ;
- при атопическом дерматите и пищевой аллергии пробиотики улучшают их течение [9] .
Пребиотики
Эти питательные вещества выступают в качестве «удобрений» для полезных видов бактерий кишечника. К пребиотикам относятся неперевариваемые олигосахариды, инулин, масляная кислота, многоатомные спирты, аминокислоты и пептиды, лактулоза и пищевые волокна.
Применение БАДов с пребиотическим эффектом, таких как » Максилак «, » Лактофильтрум «, «Закофальк», » Эубикор » и других, обоснованно и является перспективным методом лечения [38] . Например, при выраженной тревожности у пациентов с синдромом раздражённого кишечника ежедневный приём пребиотической смеси галактоолигосахаридов в течение четырёх недель снижает чувство тревоги и положительно влияет на качество жизни [12] .
Метабиотики (постбиотики)
Они являются структурными компонентами пробиотиков и их метаболитов. Препараты этой группы недостаточно изучены, хотя различные продукты распада бактерий содержатся в кисломолочных и квашеных продуктах питания. В аптеке можно встретить такие метабиотики, как » Хилак форте » и » Бактистатин «, однако их эффективность не доказана ни в одном крупном исследовании. Поэтому лечение метабиотиками остаётся пока только на уровне концепции.
Антибиотики
При воспалительных заболеваниях кишечника и тяжёлых формах дисбактериоза лечение состоит в том, чтобы устранить микрофлору, которая активировала иммунный ответ, может приём метронидазола и ципрофлоксацина, тогда как пробиотики и пребиотики предотвращают рецидив колита [38] .
При колоректальном раке рост Fusobacterium nucleatum (палочки Плаута) предсказывает агрессивность течения болезни, её устойчивость к химиотерапии и вероятность рецидива. В связи с этим химиотерапию рекомендуется проводить вместе с приёмом антибиотиков, направленных на борьбу с патогенными бактериями [15] .
Улучшить течение ревматоидного артрита может подавление роста бактерией Prevotella copri, так как именно этот патобионт участвует в развитии заболевания [8] .
При синдроме раздражённого кишечника для уменьшения симптомов, в т. ч. вздутия, показано использование местных неабсорбируемых антисептиков неомицина и рифаксимина [38] .
Фекалотрансплантация
В отличие от приёма пробиотиков пересадка кала имеет долгосрочный устойчивый эффект. Сейчас она активно применяется только для лечения от псевдомембранозного колита, вызванного бактериями C. Difficile [33] . Также проводятся множественные исследования об эффекте фекалотрансплантации в лечении аутоиммунных, неврологических заболеваний и инсулинорезистентости.
Бактериофаги
Бактериофаги (вирусы, избирательно поражающие бактериальные клетки) эффективны для борьбы с инфекцией — дисбактериозом 2 степени. Препарат подбирают по результатам посевов кала с чувствительностью к фагам. Однако этот метод применяется крайне редко из-за высокой стоимости препаратов и сложности их использования. Выпивать «бульон» с фагами нужно за час до еды 3 раза в день, предварительно выпивая большое количество воды, чтобы разбавить желудочную кислоту, в которой бактериофаги разрушаются. Сейчас этот метод лечения чаще используют в педиатрии, когда нет возможности дать антибиотик.
Иммуномодуляторы
Использование иммуномодуляторов для лечения дисбактериоза кишечника обсуждается, однако убедительных данных пока нет. Хорошо зарекомендовали себя только витамин Д и Омега-3, дефицит которых однозначно негативно сказывается на взаимодействии кишечной стенки с микробиомом.
Могут ли помочь народные средства
Суть народности метода в его популярности среди людей без наличия доказательной базы. Когда какой-то метод лечения проходит клинические испытания, он становится лекарством традиционной практики. Из фитотерапии положительно воздействуют на слизистую пищеварительного тракта и флору настои календулы, ромашки, шалфея и солодки.
Прогноз. Профилактика
Прогноз при дисбактериозе благоприятный. Восстановление нормальной флоры — процесс не быстрый, но достижимый.
Начинать профилактику дисбактериоза у детей необходимо с нормализации вагинальной и кишечной микрофлоры будущих мам. Роды лучше проводить естественным способом.
Следующий шаг на пути правильного формирования микрофлоры кишечного — грудное вскармливание, в ходе которого в организме появляются бифидобактерии. Слишком раннее введение глютенового прикорма поможет избежать возможного развития местного воспаления и целиакии.
Основная микробиота формируется только в первый год жизни. Воздействия на организм после года, в том числе терапевтические, влияют на бактериальные сообщества намного меньше [9] .
В дальнейшей жизни важнейшее значение в профилактике дисбактериоза имеет образ питания, разнообразие рациона и режим приёма пищи. Диета должна быть обогащена кисломолочными продуктами, овощами, фруктами и отрубями. Преобладание растительных масел над животными жирами способствует балансу жирных кислот и противовоспалительной активности в кишечнике.
На фоне погрешности в диете, стресса и после перенесённых инфекций могут появиться первые симптомы кишечного дискомфорта — вздутие, нарушение стула, нарастание висцеральной чувствительности.
Отказ от вредных привычек (курения, злоупотребления алкоголем), минимизация консервантов, потребляемых с пищей, а также амортизация стресса помогут избежать запуска воспалительных процессов и нарушения микрофлоры, связанного с иммунным ответом.
В современном мире инфекции распространяются с огромной скоростью, поэтому отказ от антибиотиков невозможен. Важно применять их разумно, только по назначению врача и с одновременным приёмом пробиотиков.
Регулярное мытьё рук, фруктов и овощей, отказ от косметических средств с антимикробной активностью защищают от инфекций и сохраняют естественную нормофлору.
С возрастом разнообразие микробиоты естественным образом снижается. Это повышает склонность к запорам, ослабляет иммунную защиту и вызывает общую слабость. В таких ситуациях профилактикой дальнейшего развития дисбиоза будет своевременный приём курсов про- и пребиотиков или их постоянное поддерживающее применение.
КИШЕЧНЫЙ ДИСБАКТЕРИОЗ
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
Нормальная микробная флора кишечника
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические особенности дисбактериоза
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Основным симптомом псевдомембранозного колита является обильная водянистая диарея, началу которой предшествовало назначение антибиотиков. Затем появляются схваткообразные боли в животе, повышается температура тела, в крови нарастает лейкоцитоз. Эндоскопическая картина псевдомембранозного колита характеризуется наличием бляшковидных, лентовидных и сплошных «мембран», мягких, но плотно спаянных со слизистой оболочкой. Изменения наиболее выражены в дистальных отделах ободочной и прямой кишок. Слизистая оболочка отечная, но не изъязвлена. При гистологическом исследовании обнаруживают субэпителиальный отек с круглоклеточной инфильтрацией собственной пластинки, капиллярные стазы с выходом эритроцитов за пределы сосудов. На стадии образования псевдомембран под поверхностным эпителием слизистой оболочки возникают экссудативные инфильтраты. Эпителиальный слой приподнимается и местами отсутствует; оголенные места слизистой оболочки прикрыты лишь слущенным эпителием. На поздних стадиях болезни эти участки могут занимать большие сегменты кишки.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
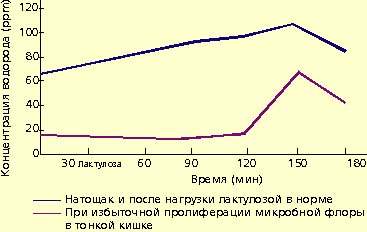 |
| Рисунок 1. Концентрация водорода в выдыхаемом воздухе |
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
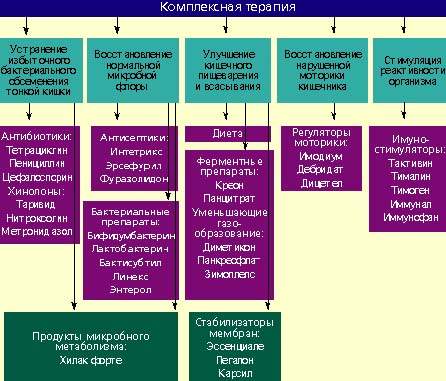 |
Лечение
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Совсем недавно появились сообщения о возможности лечения острой диареи, ассоциированной с антибактериальной терапией и Cl. difficile, большими дозами пре- и пробиотиков.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Источник https://www.gastroscan.ru/literature/authors/3248
Источник https://probolezny.ru/disbakterioz/
Источник https://www.lvrach.ru/2001/05-06/4528776