Мукополисахаридоз I типа у детей
Термины и определения
Ферментная заместительная терапия – лечение, заключающееся во введении препарата (рекомбинантная человеческая альфа-L-идуронидаза) пациентам с наследственным нарушением метаболизма.
Лизосомные болезни накопления – группа наследственных моногенных заболеваний, связанных с нарушением функции лизосом.
Мукополисахаридозы (МПС) — группа наследственных болезней обмена веществ, связанных с нарушением метаболизма гликозаминогликанов (ГАГ), приводящее к поражению органов и тканей. Обусловлены данные заболевания мутациями генов, контролирующих процесс внутрилизосомного гидролиза макромолекул.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Мукополисахаридоз I типа (МПС I) — наследственная лизосомная болезнь накопления, обусловленная дефицитом фермента альфа-L-идуронидазы и протекающая с различными клиническими проявлениями: задержкой роста, умственной отсталостью, поражением нервной системы, сердечно-легочными нарушениями, гепатоспленомегалией, множественными дизостозами, помутнением роговицы. Все вышеперечисленные признаки приводят к инвалидизации, а при тяжелом течении болезни — к летальному исходу [1].

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической классификации болезней и проблем, связанных со здоровьем
Согласно МКБ10, заболевание относится к классу IV, болезням эндокринной системы, расстройству питания и нарушению обмена веществ, E76.0 — Мукополисахаридоз I типа.
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В соответствии с дефицитом/отсутствием лизосомных ферментов, соответствующим генным дефектам и тяжести клинической симптоматики, выделяют 11 типов МПС (приложение А3.2).
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Причиной МПС I типа является мутация в гене, кодирующем лизосомный фермент альфа-L-идуронидазу. Тип наследования: аутосомно-рецессивный. Ген IDUA, кодирующий альфа-L-идуронидазу локализован в хромосомной области 4p16.3.
Из-за снижения активности фермента происходит накопление различных типов ГАГ и развивается соматическая манифестация в виде лицевого дисморфизма, гепатоспленомегалии, поражения сердца, дыхательной системы, изменений скелета, неврологической симптоматики, гематологические и офтальмологические изменения. Вариабельность МПС определяется типом накапливаемого субстрата при недостаточной деградации ГАГ: при МПС I типа происходит накопление гепарансульфата и дерматансульфата. Дефицит альфа-L-идуронидазы может привести к развитию различных фенотипов болезни, обусловливая отличия в тяжести симптоматики. Выделяют три клинических фенотипа [3,4,5]:
-синдром Гурлер (мукополисахаридоз I H — тяжелая форма),
-синдром Шейе (мукополисахаридоз I S — легкая форма)
-синдром Гурлер-Шейе (мукополисахаридоз I H/S-промежуточная форма)
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Мукополисахаридоз I типа – это панэтническое заболевание, его частота составляет 1:100 000 новорожденных. Приблизительно 50%-80% пациентов имеют тяжелую форму заболевания. МПС I H/S синдром Гурлер-Шейе встречается с популяционной частотой 1:100 000 — 1:500 000 новорожденных; МПС I S синдром Шейе — 1:500 000 новорожденных [6,7]. Однако, нужно учитывать, что существует определенная погрешность в оценке распространенности различных фенотипов заболевания, что может быть связано с более частым выявлением именно тяжелых форм МПС I.
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
В настоящее время МПС I рассматривается как заболевание с континуумом клинических фенотипов, различающихся по возрасту манифестации, тяжести клинических проявлений и скорости прогрессирования заболевания у пациентов [1-5].
Таким образом, довольно условно выделяют тяжелую форму заболевания (синдром Гурлер), с манифестацией на первом году жизни, с прогрессирующей кардио- респираторной недостаточностью и ярко выраженной неврологической симптоматикой; и мягкую форму (синдромы Гурлер-Шейе и Шейе), при которой симптомы появляются в возрасте 4-10 лет и болезнь медленно прогрессирует, при этом некоторые пациенты доживают до взрослого возраста.
С учетом традиционно используемой классификации, ниже приведены характерные клинические признаки для МПС I различных форм.
Мукополисахаридоз тип I S — легкая форма
Синонимы: синдром Шейе, МПС I S — легкая форма.
Основные клинические проявления: огрубление черт лица, тугоподвижность суставов, множественный дизостоз, помутнение роговицы [3,4].
Внешний вид. Первые признаки заболевания появляются в возрасте 3-8 лет. Пациенты гиперстенического телосложения с сильно развитой мускулатурой, черты лица грубые, характерен широкий рот с пухлыми губами, нижняя прогнатия. Постепенно развивается ограничение движений в суставах верхних конечностей, а также тугоподвижность, возникшие и прогрессирующие контрактуры суставов кистей. Наиболее выраженными все симптомы болезни становятся к периоду полового созревания. Возможно повышенное оволосение, короткая шея.
Костная система: может отмечается небольшая задержка роста. Множественный дизостоз: дисплазия лицевого черепа; плоская переносица, широко расставленные глаза, утолщенные губы, гипоплазированная нижняя челюсть, макроглоссия и гиперплазия десен, короткая шея, сгибательные контрактуры и тугоподвижность конечностей, с возрастом присоединяется болезненность суставов рук и стоп, с формированием «когтистой лапы» и полой стопы, вальгусной деформацией коленных суставов. Нередко развивается туннельный синдром карпального канала, который, наряду с тугоподвижностью, приводит к ограничению функции верхних конечностей.
Органы дыхания: частые респираторные заболевания в виде ринитов, отитов. Возможно развитие обструктивных заболеваний дыхательных путей, синдром обструктивного апноэ сна.
Орган зрения: отмечается раннее неравномерное помутнение роговицы. В дальнейшем, обычно после 30 лет, развивается глаукома, пигментная дистрофия сетчатки. Редко — отек диска зрительного нерва.
Центральная нервная система: психомоторное развитие замедленное.
Краниовертебральный стеноз развивается у пациентов с МПС вследствие гипоплазии зубовидного отростка С2 позвонка, атлантоаксиальной нестабильности, отложения мукополисахаридов в твердой мозговой оболочке и задней продольной связке, что в дальнейшем приводит к компрессионной миелопатии на этом уровне, и как следствие, развитию бульбарных нарушений, центральной дыхательной недостаточности. Симптомы могут включать нарушение походки, мышечную слабость, неуклюжесть при сохранных моторных навыках и дисфункцию мочевого пузыря.
Карпальный туннельный синдром – частая нейропатия сдавления у пациентов в возрасте от 5 до 10 лет и взрослых. При отсутствии лечения может привести к необратимой контрактуре дистальных межфаланговых суставов, а также к нарушению или потере чувствительности первых трех пальцев и парезу мышц тенара. К сожалению, пациенты редко сообщают о болевых ощущениях, пока не происходит потеря функции.
Сердечно-сосудистая система: характерны недостаточность и/или стеноз клапанов сердца (митрального, аортального, трикуспидального и легочного).
Желудочно-кишечная система: отмечаются пахово-мошоночные и пупочные грыжи, нечасто – гепатоспленомегалия, в раннем возрасте -диарея.
Мукополисахаридоз тип I H/S — промежуточная форма
Синонимы: Синдром Гурлер-Шейе.
Основные клинические признаки: лицевые дисморфии, тугоподвижность суставов, низкорослость, помутнение роговицы [1, 2, 5,7].
Внешний вид: первые симптомы болезни появляются к возрасту 3-5 лет. Характерны: скафоцефалия, макроцефалия, запавшая переносица, пухлые губы, помутнение роговицы, микрогнатия, умеренный гипертрихоз, утолщение кожных покровов.
Костная система: на первом году жизни рост в пределах нормы, затем темпы роста снижаются, обусловливая низкорослость. Телосложение диспропорциональное. Множественный дизостоз, скафоцефалия, макроцефалия. Вальгусные деформации голеней незначительно выражены. Умеренно ограничена подвижность в суставах, определяются дизостозы, бочкообразная грудная клетка, кифосколиоз, гиперлордоз.
Органы дыхания: частые респираторные заболевания в виде ринитов, отитов, гипертрофия небных миндалин. Возможно развитие обструкций дыхательных путей, стеноз гортани.
Орган зрения: помутнение роговицы.
Центральная нервная система: отмечается задержка темпов психоречевого развития, позже появляется глубокая деменция. Краниовертебральный стеноз и миелопатия развивается у пациентов с МПС вследствие гипоплазии зубовидного отростка С2 позвонка, атлантоаксиальной нестабильности, отложения ГАГ в твердой мозговой оболочке и задней продольной связке, что в дальнейшем приводит к компрессионной миелопатии на этом уровне, и как следствие, развитию бульбарных нарушений, центральной дыхательной недостаточности. Симптомы могут включать нарушение походки, мышечную слабость, неуклюжесть при сохранных моторных навыках и дисфункцию мочевого пузыря. Туннельный синдром — синдром запястного канала, сообщающаяся гидроцефалия. Характерно развитие пахименингита в шейном отделе, приводящего к сдавлению спинного мозга и последующей миелопатии.
Сердечно-сосудистая система: Сердечно-сосудистая система: характерны недостаточность и/или стеноз клапанов сердца (митрального, аортального, трикуспидального и легочного). Возможны нарушения ритма и проводимости, редко- кардиомиопатия возможно артериальная гипертензия.
Желудочно-кишечная система: гепатоспленомегалия, пахово-мошоночные и пупочные грыжи.
Как и при большинстве рецессивных болезней клинический полиморфизм определяется остаточной активностью ферментов и влияет на тяжесть течения и возраст дебюта. В зависимости от возраста дебюта те или иные клинические проявления могут иметь различную степень выраженности. Выраженность клинических проявлений МПС I в разном возрасте может варьировать (Приложение А3.3).
Мукополисахаридоз I H — тяжелая форма
Синонимы: синдром Гурлер, Пфаундлера-Гурлер синдром.
Основные клинические проявления: задержка психомоторного развития, умственная отсталость, грубые черты лица, пороки клапанов сердца, помутнение роговицы, задержка роста, тугоподвижность суставов [1-3].
У пациентов с синдромом Гурлер первые клинические признаки заболевания появляются на первом году жизни. В ряде случаев, уже с рождения наблюдаются незначительное увеличение печени, пупочные или пахово-мошоночные грыжи. Характерные изменения черт лица по типу «гаргоилизма» становятся очевидными к концу первого года жизни. Другими наиболее частыми манифестными симптомами являются тугоподвижность мелких и крупных суставов, кифоз поясничного отдела позвоночника (поясничный «гибус»), хронические отиты и частые инфекционные заболевания верхних дыхательных путей. По мере прогрессирования заболевания присоединяются симптомы, свидетельствующие о вовлечении в патологический процесс внутренних органов, сердечно-легочной, центральной и периферической нервной систем.
Ведущими неврологическими симптомами являются снижение интеллекта, задержка речевого развития, изменения мышечного тонуса, сухожильных рефлексов, поражения черепных нервов, смешанная и нейросенсорная тугоухость. Часто наблюдается прогрессирующее помутнение роговицы. Пациенты погибают обычно в возрасте до 10 лет от обструкции дыхательных путей, респираторных инфекций, сердечной недостаточности.
Внешний вид. У новорожденного характерных проявлений не отмечают, симптоматика чаще всего развивается на первом году (с 2 месяцев, иногда — позже). Характерны изменения черт лица по типу «гаргоилизма», которые становятся очевидными к концу первого года жизни: большая голова, выступающие лобные бугры, широкие скулы, запавшая переносица, короткие носовые ходы с вывернутыми кнаружи ноздрями, полуоткрытый рот, большой язык, толстые губы. Характерна задержка (максимальный рост составляет около 110 см), который полностью останавливается к 2-5 годам. При низком росте у детей отмечается диспропорциональное телосложение, короткая шея.
Костная система: Со стороны костно-суставной системы при МПС I выявляется множественная симптоматика. У всех пациентов формируется тугоподвижность всех групп суставов, в результате контрактур межфаланговых суставов и укорочения фаланг, образуются деформации кистей по типу «когтистой лапы». Тазобедренные суставы сформированы неправильно, головки бедренных костей маленькие, уплощенные и узурированные, характерна coxa valgum. Подвздошные кости приобретают «треугольную» деформацию. Рентгенологические изменения, видимые при синдроме Гурлер, описываются как множественный дизостоз. Для длинных трубчатых костей характерно расширение диафизов, рентгенологически неправильно проявляющиеся метафизы и эпифизы. Ключицы укорочены, утолщены. Ребра описываются как «веслообразные», их вертебральные концы сужены, а стернальные — утолщены и расширены. Фаланги кистей и стоп укорочены, имеют трапециевидную форму и расширенные диафизы. Формируются платиспондилия, кифоз, кифосколиоз. Позвонки расширены в поперечнике, высота их уменьшена. В участках, где сформирован кифоз или кифосколиоз, выявлено недоразвитие поперечных отростков позвонков или их «языкообразная» деформация.
Центральная нервная система. Прогрессирующие психические расстройства характерны для синдрома Гурлер, в то время как при мягких формах МПС I (синдромы Гурлер-Шейе и Шейе) интеллект пациентов практически не страдает или наблюдаются легкие когнитивные нарушения. Психомоторное развитие при синдроме Гурлер идет с заметным возрастным отставанием и достигает максимального развития на уровне 2- 4 лет, затем останавливается и переходит (вместе с моторным развитием) в стадию регресса, достигая полной деменции. Однако систематические занятия, направленные на развитие когнитивных функций, способствуют более длительному сохранению интеллекта. Поведенческие нарушения: регресс когнитивных функций наряду с тяжёлой потерей слуха, недостатком сна, вызванным обструктивным апноэ, оказывают существенное влияние на поведение ребенка. По мере нарастания когнитивного дефицита к гиперактивности и агрессивности присоединяются аутистические черты. Медикаментозная терапия, направленная на контроль разрушительного поведения, часто бывает неэффективной. Прогрессирующая сообщающаяся гидроцефалия является наиболее частым симптомом синдрома Гурлер и редко встречается при мягких формах МПС I типа (синдромах Гурлер-Шейе и Шейе). При сдавлении спинного мозга, вызванного утолщением его оболочек или нестабильностью атлантоаксиального сустава, отмечают: нарушение походки, мышечную слабость, неуклюжесть при сохранных моторных навыках и дисфункцию мочевого пузыря. При тяжёлой форме заболевания часто наблюдаются судороги, что требует проведения оценки неврологического статуса. У пациентов со слабо выраженными клиническими признаками судорожный синдром встречается намного реже. Прогрессирование заболевания сопровождается генерализованными тонико-клоническими пароксизмами, которые обычно хорошо поддаются монотерапии противоэпилептическими препаратами. Карпальный туннельный синдром – частая нейропатия сдавления у пациентов в возрасте от 5 до 10 лет и взрослых. При отсутствии лечения может привести к необратимой контрактуре дистальных межфаланговых суставов, а также к нарушению или потере чувствительности первых трех пальцев и парезу мышц тенара. К сожалению, пациенты редко сообщают о болевых ощущениях, пока не происходит потеря функции.
Сердечно-сосудистая система: Вследствие отложения ГАГ с раннего возраста клапаны сердца утолщаются, возникает регургитация, либо стеноз. В ряде случаев возможно формирование гипертрофии мышечной ткани сердца, уменьшение ее эластичности, нарушение проводимости, поражение коронарных артерий.
Чаще встречается патология клапанов сердца (недостаточность и/или стеноз митрального, аортального, трикуспидального и легочного клапанов). Имеет место поражение коронарных сосудов. Магистральные сосуды у пациентов с МПС могут иметь утолщенные стенки, но при этом быть суженными или дилатированными. В связи с сужением артерий, у таких пациентов появляются клинически выраженная артериальная гипертензия. Возможно расширение восходящей части аорты, и значительное уменьшение эластичности стенок аорты. При кардиомиопатии (инфильтративной) выявляется гипертрофия миокарда или дилатация камер сердца. Имеет место нарушение ритма и проводимости сердца. Течение сердечной недостаточности (СН) при МПС имеет прогрессирующий характер. Трудности диагностики этого состояния связаны с неспецифичностью клинической симптоматики, отсутствием жалоб, характерных признаков нарушения кровообращения на ранних этапах ее развития.
Органы дыхания: частые респираторные заболевания в виде ринитов, отитов. Накопление ГАГ в миндалинах, надгортаннике, а также в трахее приводит к утолщению и сужению дыхательных путей и развитию обструктивного апноэ.
Органы зрения: помутнение и пигментная дегенерация роговицы, глаукома.
Желудочно-кишечная система: гепатоспленомегалия, диарея в раннем возрасте, пупочная и/или паховая грыжи.
На поздних стадиях у детей выявляют тугоухость, снижение зрения и умственную отсталость.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз МПС тип I устанавливается на основании совокупности: анамнестических данных, клинических данных, результатов лабораторного исследования (биохимического и молекулярно-генетического анализа).
Дифференциальная диагностика проводится с другими типами МПС, альфа- маннозидозом, поздними формами ганглиозидозов, муколипидозом, неинфекционными полиартритами, эпифизарными дисплазиями [5, 7].
Пациентам с установленным диагнозом МПС I проводится динамическое наблюдение (средняя частота проведения консультаций и обследования представлена в Приложении А3.4).
2.1 Жалобы и анамнез
При сборе анамнеза и жалоб рекомендовано обратить внимание на следующие жалобы и анамнестические события:
- отягощенный семейный анамнез (сходные симптомы у родных братьев и сестер пробанда, близкородственный брак);
- низкий рост;
- огрубление черт лица;
- частые респираторные заболевания;
- снижение слуха;
- снижение зрения;
- множественный дизостоз (деформации черепа, грудной клетки, позвоночника, конечностей);
- нарушение осанки — кифоз, сколиоз;
- рецидивирующие грыжи (чаще двусторонние);
- помутнение роговицы;
- ухудшение переносимости физических нагрузок;
- слабость в конечностях;
- тугоподвижность в суставах;
- трудности подъема из положения сидя и лёжа;
- изменение походки;
- неловкость мелкой моторики;
- нарушение контроля за функциями тазовых органов;
- апноэ во сне.
- Жалобы и анамнез также описаны в разделе «клиническая картина».
- грубые черты лица;
- низкорослость;
- тугоподвижность суставов;
- помутнение роговицы;
- гепатомегалия;
- спленомегалия;
- пахово-мошоночные и пупочные грыжи (двусторонние).
- сердечные шумы
Подробно данные физикального обследования описаны в разделе «клиническая картина».
2.3 Лабораторные диагностические исследования
Основные лабораторные методы подтверждения диагноза МПСI включают определение активности фермента альфа-L-идуронидазы, количественный и качественный анализ ГАГ мочи и молекулярно-генетические исследования гена IDUA. Данные исследования проводятся в специализированных генетических лабораториях.
- Рекомендуется с целью подтверждения диагноза и установления типа МПС всем пациентам определение уровня гликозаминогликанов мочи (комплекс исследований для диагностики мукополисахаридоза тип I) [7, 8].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарий: данный тест является одним из первых подтверждающих биохимических тестов для МПС I типа. При количественном анализе выявляют повышение концентрации ГАГ с мочой, при проведении электрофореза ГАГ (Электрофоретическое исследование гликозаминогликанов мочи) — повышенную экскрецию дерматансульфата и гепарансульфата с мочой. Эти изменения наблюдаются также при МПС II, VII типов. Уровень ГАГ является возраст-зависимым параметром. Также при легкой форме МПС I концентрация ГАГ в моче может быть лишь незначительно повышена.
Исследование проводится в динамическом наблюдении пациентам, получающим ферментную заместительную терапию с частотой не реже 1 раза в 6 месяцев, пациентам, не получающим ферментную заместительную терапию — не реже 1 раза в год.
- Рекомендовано всем пациентам для подтверждения диагноза МПС I определение активности альфа-L-идуронидазы в культуре фибробластов, изолированных лейкоцитов, либо в пятнах крови, высушенных на фильтровальной бумаге (фильтр №903) (комплекс исследований для диагностики мукополисахаридоза тип I) [2,7,8].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4).
Комментарии: показатели являются основными лабораторными критериями МПС I типа. У пациентов с МПС I типа определяется снижение активности альфа-L- идуронидазы.
- Рекомендуется всем пациентам со сниженной активностью фермента альфа-L- идуронидазы с целью подтверждения диагноза на молекулярно-генетическом уровне проведение исследования гена IDUA [9, 10].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарии: тест необходим для верификации диагноза на молекулярно- генетическом уровне. Выявление семейной мутации гена IDUA делает возможным обследование родственников пробанда, а также проведение пренатальной и преимплантационной диагностики. Большинство мутаций у пациентов с МПС I могут быть выявлены с помощью секвенирования по Сэнгеру всех экзонов и прилегающих к ним участков интронов гена, но в небольшом проценте случаев мутацию с применением стандартных методов обнаружить не удается.
В соответствии с Приказом Минздрава России от 13 октября 2017 г № 804н «Об утверждении номенклатуры медицинских услуг» название услуги: Комплекс исследований для диагностики мукополисахаридоза тип I
- Рекомендуется всем пациентам с МПС I проведение анализа крови биохимического общетерапевтического для определения функционального состояния печени, которая является одним из органов-мишеней при МПС (определяют аланинаминотрансферазу (АЛТ), аспартатаминотрансферазу (АСТ), общий и прямой билирубин, холестерин, триглицериды. [27,45].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарии: исследование проводится не реже 1 раза в 6 месяцев
- Рекомендуется всем пациентам с МПС I проведение общего (клинического) анализа крови (Общий (клинический) анализ крови развернутый) для оценки основных параметров кроветворения и выявления возможных инфекционных процессов [27].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарии: в связи с высоким риском развития интеркуррентных инфекций, аспирационной пневмонии у пациентов с МПС рекомендуется проведение данного исследования не реже 4 раз в год.
- Рекомендуется всем пациентам с МПС I проведение общего анализа мочи не реже 2 раз в год для оценки состояния мочевыводящих путей и почек [1, 2, 5].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарии: в связи с высоким риском развития интеркуррентных инфекций у пациентов с МПС рекомендуется проведение данного исследования не реже 2 раз в год.
- Рекомендуется всем пациентам с МПС I проведение исследования коагулограммы (Активированное частичное тромбопластиновое время Определение протромбинового (тромбопластинового) времени в крови, Определение тромбинового времени в крови, Исследование уровня фибриногена в крови, Определение концентрации Д-димера в крови) для оценки состояния системы коагуляции и своевременной профилактики развития тромбозов [28].
Комментарии: частота исследования, в среднем, 1 р в год, при необходимости – чаще (перед каждым оперативным вмешательствам).
- Рекомендуется всем пациентам с МПС I проведение Исследования уровня N- терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови для своевременной диагностики сердечной недостаточности, дифференциальной диагностики с одышкой, вызванной респираторными проблемами, для решения вопросов о старте/коррекции кардиотропной терапии [28].
2.4 Инструментальные диагностические исследования
- Рекомендуется пациентам с МПС I проведение магнитно-резонансной томографии органов брюшной полости и/или компьютерной томографии органов брюшной полости и/или ультразвукового исследования (УЗИ) органов брюшной полости (Ультразвуковое исследование органов брюшной полости (комплексное), Ультразвуковое исследование печени, Ультразвуковое исследование селезенки) с целью выявления увеличений размеров печени и селезенки [1].
- Рекомендуется с целью выявления множественного дизостоза всем пациентам с МПС I проведение рентгенографии шейного, грудного и поясничного отдела позвоночника, а также рентгенографии верхних и нижних конечностей [1, 2, 5].
- Рекомендуется всем пациентам с МПС I проведение электронейромиографии (ЭНМГ) (Электронейромиография стимуляционная одного нерва, Электромиография стимуляционная срединного нерва, Электромиография игольчатая), для оценки функционального состояния мышечных тканей, нервов и нервно-мышечной передачи [1, 2, 5].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарии: стимуляционная ЭНМГ позволяет определить сдавление срединного нерва даже до появления симптомов и должна проводиться, начиная с возраста 4-5 лет ежегодно.
- Рекомендована консультация врача-оториноларинголога и врача-сурдолога- оториноларинголога, проведение аудиометрии всем пациентам с МПС I с целью выявления тугоухости (Тональная аудиометрия, Речевая аудиометрия, Игровая аудиометрия, Регистрация вызванных акустических ответов мозга на постоянные модулированные тоны (ASSR тест)), эндоскопия носоглотки и гортани для оценки степени гипертрофии аденоидов и миндалин (Эндоскопическая эндоназальная ревизия полости носа, носоглотки, Эпифаринголарингоскопия, Эпифарингоскопия видеоэндоскопическая) [1, 2, 5]. При подозрении на снижение слуха необходимо проведение отоакустической эмиссии (при отсутствии экссудативного отита) (Исследование вызванной отоакустической эмиссии, Исследование отоакустической эмиссии на частоте продукта искажения).
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: тугоухость разной степени выраженности характерна для данного заболевания. Она может быть кондуктивной или нейросенсорной или носить смешанный характер. Раннее выявление тугоухости позволяет улучшить качество жизни пациентов, обеспечить им лучшее общение и обучение.
Аудиометрию следует проводить не реже 1 раза в год. Частота остальных исследований определяется индивидуально.
- Рекомендовано проведение исследования функции внешнего дыхания (ФВД) методом спирометрии всем пациентам с МПС I, способным выполнить требуемый дыхательный маневр для оценки эффективности проводимой терапии, контроля за состоянием бронхолегочной системы (в среднем, 1р/6 мес). [1, 2, 5].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: в соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг»: Исследование неспровоцированных дыхательных объемов и потоков, Исследование дыхательных объемов с применением лекарственных препаратов.
- Рекомендовано проведение Прицельной рентгенографии органов грудной клетки всем пациентам с МПС I с целью оценки деформаций грудной клетки и изменений легочной ткани [29].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: при наличии аускультативных изменений в легких также следует рассмотреть проведение данного исследования в связи с возможностью развития пневмонии у пациентов с МПС1. Кратность исследования определяется индивидуально, в среднем, 1 р/2 года
- Рекомендовано проведение электроэнцефалографии (ЭЭГ) всем пациентам с МПС I с целью своевременного выявления эпиактивности, назначения и коррекции терапии [30].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4).
Комментарий: как наиболее информативную методику данного исследования следует выбирать электроэнцефалографию с видеомониторингом.
Исследование следует проводить ежегодно при отсутствии противопоказаний.
- Рекомендовано проведение полисомнографии/кардиреспираторного мониторинга пациентам МПС I с подозрением или подтверждённым диагнозом синдрома обструктивного апноэ сна [1, 2, 5].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: для диагностики обструктивного апноэ сна проводится полисомнография/кардиореспираторный мониторинг, которая позволяет определить характер дыхательных нарушений (исключить центральный генез, связь с гипертрофией аденоидов, сердечной недостаточностью или комплекс причин), патологию сердечно- сосудистой системы. Исследование проводится не реже 1 раза в год.
В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг» нет услуги «Полисомнография», в связи с чем возможно использование набора услуг: Электроэнцефалография с видеомониторингом, Суточное мониторирование артериального давления, Регистрация электрокардиограммы, Мониторирование электрокардиографических данных, Холтеровское мониторирование сердечного ритма, Расшифровка, описание и интерпретация электрокардиографических данных, Электромиография накожная (одна анатомическая зона), Электроокулография, Определение парциального давления кислорода в мягких тканях (оксиметрия)).
- Рекомендовано проведение ЭКГ, Эхо-КГ, холтеровского мониторирования ЭКГ и суточного мониторирования артериального давления всем пациентам с МПС I для оценки состояния сердца [31].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: регулярное проведение ЭКГ, Эхо-КГ, холтеровского мониторирования ЭКГ, суточного мониторирования артериального давления необходимо пациентам с данной патологией, так как с раннего возраста у них отмечаются сердечно-сосудистые нарушения. Частота исследований, в среднем, не реже 1 раза в год.
В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг»: Суточное мониторирование артериального давления, Регистрация электрокардиограммы, Мониторирование электрокардиографических данных, Холтеровское мониторирование сердечного ритма, Расшифровка, описание и интерпретация электрокардиографических данных,
- Рекомендовано всем пациентам с МПС I проведение компьютерной томографии или магнитно-резонансной томографии (МРТ) головного мозга и шейного отдела позвоночника с целью выявления компрессии спинного мозга и гидроцефалии, в среднем, 1 р/2 года [1].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: Нестабильность атлантоаксиального сочленения может быть выявлена при рентгенографии шейного отдела позвоночника с функциональными пробами, однако для подтверждения компрессии спинного мозга вследствие утолщения его оболочек и формирующихся аномалий позвонков требуется проведение МРТ и/или КТ. В соответствии с Приказом Минздрава России 13 октября 2017 г № 804н от «Об утверждении номенклатуры медицинских услуг»: КТ (МРТ) шейного отдела позвоночника: Магнитно-резонансная томография шеи, Спиральная компьютерная томография шеи.
- Рекомендовано пациентам с МПС I проведение исследования переднего сегмента глаза методом бокового освещения, измерение внутриглазного давления (Офтальмотонометрия) и оценка состояния глазного дна (Офтальмоскопия, Осмотр периферии глазного дна с использованием трехзеркальной линзы Гольдмана, Биомикрофотография глазного дна с использованием фундус-камеры) с целью выявления глаукомы, изменения прозрачности глазных сред и состояния сетчатки [1].
Комментарии: Кратность исследований, в среднем, 1 р/год.
У пациентов с МПС I отмечается раннее неравномерное помутнение роговицы. В дальнейшем развивается глаукома, пигментная дистрофия сетчатки. Редко — отек диска зрительного нерва.
- Рекомендовано всем пациентам с МПС I типа проведение 6 минутного теста ходьбы (6МТХ) при диагностике или с момента возможности пациента к выполнению теста с целью оценки физической выносливости пациентов, в том числе, на фоне терапии ларонидазой. [32].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: Тест 6-минутной ходьбы является одним из наиболее простых и доступных в мировой практике способов оценки выносливости и функциональных возможностей пациентов с кардиологической и легочной патологиями, а также выявления таковых, в том числе и у детей. Дистанцию, пройденную в течение 6 мин (6МТХ), измеряют в метрах, оценивают в динамике минимум 1 раз в год. и сравнивают с данными предыдущего исследования. Приложение А3.5.
Исследование следует проводить не реже 1 раза в 6 месяцев при условии возможности выполнения пациентом.
- Рекомендовано пациентам с МПС I контроль минеральной плотности костей (рентгеноденситометрия) при первичной диагностике и в процессе динамического наблюдения [33].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарии: доказательных данных по оптимальной частоте проведения исследования нет, проводится, в среднем,1 раз в 1-2 года.
2.5. Иные диагностические исследования
Не требуются
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Лечение МПС тип I включает как патогенетическое лечение назначение ФЗТ, так и проведение симптоматической терапии. Ведение пациентов с МПС тип I предполагает мультидисциплинарный подход с участием врача-педиатра, врача-невролога, врача-генетика, врача-офтальмолога, врача-кардиолога/врача- детского кардиолога, врача-пульмонолога, врача-сурдолога-оториноларинголога, врача-оториноларинголога, врача-хирурга/врача-детского хирурга, врача-челюстно-лицевого хирурга, врача-нейрохирурга, врача-физиотерапевта, медицинского психолога и врачей других специальностей, имеющих опыт в лечении этого редкого заболевания.
3.1 Патогенетическое лечение
- Рекомендовано проведение ферментной заместительной терапии (ФЗТ) всем пациентам с установленным диагнозом МПС I с целью замедления прогрессирования заболевания, уменьшения размеров печени и селезенки, улучшения функции сердца, снижения уровня экскретируемых ГАГ [11-14, 17].
Уровень убедительности рекомендации А (уровень достоверности доказательств – 1).
Комментарии: Препаратом для ФЗТ является ларонидаза** (код ATX A16AB05). В 1 мл раствора содержится 100 ЕД (приблизительно 0,58 мг) ларонидазы. Это рекомбинантная форма человеческой альфа-L-идуронидазы, производимая с использованием технологии рекомбинантной ДНК в клеточной культуре китайских хомячков. ФЗТ предназначена для восстановления уровня ферментной активности, достаточного для гидролиза накопленных ГАГ и для предотвращения их дальнейшего накопления. После введения ларонидаза** быстро выводится из системного кровотока и поглощается клетками, поступая в их лизосомы через маннозо-6-фосфатные рецепторы. Рекомендованный режим дозирования: еженедельное введение в дозе 100 ЕД/кг в виде в/в инфузии. Начальная скорость введения, составляющая 2 ЕД/кг/ч, при хорошей переносимости может постепенно увеличиваться каждые 15 мин, максимально до 43 ЕД/кг/ч. Весь необходимый объем раствора должен быть введен приблизительно в течение 3–4 ч. [12, 13].
Следует обращать внимание на соблюдение интервалов между инфузиями и недопустимость перерывов в терапии, т.к. нарушение режима лечения сопровождается потенциальным риском ухудшения состояния пациента и прогрессирования симптомов МПС I.
Введение осуществляется через периферический венозный катетер (катетер периферический) или через порт-систему (порт инфузионный/инъекционный, имплантируемый***), которые устанавливаются согласно методическим руководствам «Венозный доступ, 2019 (https://msestra.ru/download/file.php?id=4763) с использованием необходимых лекарственных средств. Порт-системы устанавливаются согласно Распоряжению Правительства Российской Федерации от 31.12.2018 № 3053-р «Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи, а также перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг».
Лечение проводится при отсутствии противопоказаний.
Трансплантация гемопоэтических стволовых клеток
- Рекомендовано проведение трансплантации гемопоэтических стволовых клеток (ТГСК) пациентам с МПС 1Н до достижения возраста 2,5 лет при нормальных или субнормальных показателях развития (DQ>70) [11,16].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5).
Комментарии: лучшие результаты получены при использовании стволовых клеток костного мозга HLA-совместимых родственных доноров или стволовых клеток пуповинной крови родственных доноров. ТГСК ведет к уменьшению размеров печени и селезенки, улучшению функций дыхательной и сердечно–сосудистой систем. Проведение ТГСК в раннем возрасте позволяет избежать нарушений когнитивных функций. Претрансплантационная терапия должна обладать выраженной иммуносупрессией. В последнее время увеличилась выживаемость пациентов после ТГСК, хотя риск угрозы для жизни детей сохраняется высоким. Ретроспективный анализ показал, что выживаемость пациентов после ТГСК составляет 85%. Клиническая эффективность ТГСК зависит от возраста ребенка на момент оперативного вмешательства, степени тяжести клинических нарушений, особенно состояния сердечно-сосудистой и нервной систем, а также типа донора и возможности достичь стабильной приживаемости трансплантата без развития реакции трансплантата против хозяина. Наилучший клинический исход наблюдался у детей в возрасте до 2,5 лет с DQ>70.
Одним из наиболее значимых эффектов трансплантации является сохранение интеллектуального развития детей, имеющих тяжелый генотип, ассоциированный с серьезными умственными расстройствами. Помутнение роговицы уменьшается медленно, при этом не исчезает полностью; сформированные изменения скелета, особенно позвоночного столба, также не купируются в полном объеме.
Рекомендовано лечение детей, которые готовятся к ТГСК по схеме:
1. До пересадки 12 недель и после пересадки не менее 15-17 недель проводится ФЗТ.
2. Продолжительность перед пересадкой терапия может быть короче 12 недель и это зависит от общего состояния пациента, наличия подходящего донора.
3. Продолжительность ФЗТ после трансплантации зависит от уровня ГАГ, активности фермента альфа-L-идуронидазы, состояния дыхательной, сердечно — сосудистой систем, общего состояния ребенка, восстановления гематологических параметров [11,16].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарии: Решения о выборе лечения для пациента с MПС I должна принимать мультидисциплинарная команда. В эту группу помимо врача куратора и узких специалистов (врача-невролога, врача-кардиолога/врача детского кардиолога, врача- оториноларинголога, врача-травматолога-ортопеда и других) должны входить имеющие опыт работы с пациентами МПС врач с опытом работы по пересадке костного мозга (если обсуждается пациенты с синдромом Гурлера) и медицинский психолог. Медицинский психолог должен иметь опыт тестирования детей с МПС IH учитывать тяжелое соматическое состояние ребенка, нарушение слуха и зрения, тугоподвижность в суставах и т.д. Дети с MПС I с прогрессирующим поражением ЦНС ( DQ <70) реже получают пользу от трансплантации.
Все пациенты с MПС I могут получить ФЗТ, так как это улучшит соматические симптомы заболевания. Эффективность ФЗТ возрастает при условии терапии в раннем возрасте. Пациенты, которым планируется проведение ТГСК, предварительно должны получить курс ФЗТ, поскольку это улучшает клиническое состояние пациента. ТГСК применяется для пациентов в возрасте до 2,5 лет.
ТГСК у пациентов с синдромом Гурлера более успешна, если выполняется на ранней стадии, и должна проводиться, как только соматическое состояние позволит провести процедуру.
У взрослых пациентов с МПС I, которым в детском возрасте была произведена ТГСК, необходимо производить периодическую клиническую оценку клинических симптомов, контролировать уровень ГАГ в моче и не реже одного раза в год оценивать активность фермента альфа-L-идуронидазы. В случае прогрессирования симптомов, увеличении ГАГ в моче, снижения активности фермента, необходимо рассмотреть назначение ФЗТ.
У пациентов с МПС I, которым была произведена ТГСК, необходимо проводить периодическую клиническую оценку клинических симптомов, контролировать уровень ГАГ в моче и не реже 2 раза в год оценивать активность фермента альфа-L-идуронидазы. В случае прогрессирования симптомов, увеличения уровня ГАГ в моче, снижения активности фермента альфа-L-идуронидазы, необходимо рассмотреть назначение ФЗТ.
- Рекомендовано проведение медикаментозной премедикации при появлении побочных аллергических реакций с последующей инфузией ларонидазы** [18]. Приложение А3.6 и Приложение А3.7
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарии: У пациентов с МПС, получающих ФЗТ, как и при в/в введении любого другого белкового препарата, могут развиться побочные реакции (лихорадка, озноб, рвота, крапивница, тяжелые реакций гиперчувствительности аллергического типа), происходящие или во время инфузии или в течение дня проведения инфузии. При появлении побочных реакций во время/после инфузии рекомендуется соответствующее лечение, при котором необходимо следовать современным стандартам оказания медицинской помощи (антигистаминные препараты системного действия, ибупрофен** или парацетамол**, кортикостероидные препараты системного действия (преднизолон** или дексаметазон**)).
- Рекомендуется пациентам с МПС I консультации следующих специалистов не реже 1 раза в 6 месяцев или чаще при наличии показаний: врачом-оториноларингологом, врачом-неврологом [1, 2, 5, 14, 18].
- Рекомендуется пациентам с МПС I консультации следующих специалистов не реже 1 раза в 6 месяцев или чаще при наличии показаний: врачом-кардиологом/врачом- детским кардиологом, врачом-ортопедом. [1, 2, 5, 14, 18].
- Рекомендуется пациентам с МПС I консультация врачом-хирургом/врачом- детским хирургом (при наличии патологии, требующей хирургического вмешательства) [1,2,5,14,18].
- Рекомендуется пациентам с МПС I консультация врачом-пульмонологом (при наличии патологии со стороны дыхательной системы) [1, 2,5,14,18].
- Лечение хронических заболеваний (поведенческих нарушений, офтальмологических нарушений, ортопедической патологии, судорожного синдрома, АГ, сердечной недостаточности, рецидивирующих отитов, частых респираторных заболеваний и др.) у пациентов с МПС I рекомендовано проводить с учетом действующих клинических рекомендаций, принимая во внимание результаты комплексной оценки со стороны всех органов и систем и персонализированные цели пациента [1,2,5,14,18,34].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарий: Лечение поведенческих нарушений проводится врачом-неврологом, обычно используются седативные средства, анксиолитики и другие.
Выбор препарата, дозировка, длительность курса определяются индивидуально. Начинают прием данных препаратов под тщательным врачебным контролем в условиях круглосуточного / дневного стационара [1,2,5,14,18, 34].
- При офтальмологических нарушениях рекомендуется проводить лечение по показаниям, подбор терапии осуществлять на основании рекомендаций по лечению соответствующих нозологий [1,2,5,14,18].
- Рекомендуется в качестве ортопедической коррекции нарушения осанки, контрактур суставов с использованием нехирургических методов применять физиопроцедуры и лечебную физкультуру, использовать ортопедические устройства. По показаниям осуществлять хирургическое лечение синдрома карпального канала, проводить эндопротезирование тазобедренного или коленного сустава, корригирующие остеотомии для исправления оси конечностей [1,2,5,14,18].
- Рекомендовано при рецидивирующих отитах, частых респираторных заболеваниях верхних дыхательных путей проводить симптоматическую, антибактериальную терапию, при отитах не применять тактику «наблюдать и ждать» [2, 35].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4).
- У пациентов с МПС при наличии эпилептических приступов рекомендовано использование препаратов и схем лечения, на основании рекомендаций по лечению эпилепсий [1,2,5,14,18].
- Рекомендовано участие мультидисциплинарной команды в ведении сердечной недостаточности у пациентов с МПС I [1,2,5,14,18].
- При лечении артериальной гипертонии у пациентов с МПС I рекомендовано назначение антигипертензивной терапии в соответствии с клиническими рекомендациями по артериальной гипертензии [1,2,5,14,18].
- Рекомендуется пациентам с МПС I c нарушениями моторики желудочно- кишечного тракта (запорами) использование слабительных препаратов в соответствии с рекомендациями по запорам [36].
- Рекомендуется пациентам с МПС I при хронической нейропатической боли назначение препаратов, воздействующих на центральные механизмы формирования хронической боли: противоэпилептические препаратамы (доза подбирается индивидуально), антидепрессантов [37].
3.3 Хирургическое лечение
Хирургическое лечение пациентов с МПС I следует проводить при участии мультидисциплинарной команды в соответствии с действующими клиническими рекомендациями.
- Рекомендуется пациентам с сохранным интеллектом и нарушением функции кистей или с нарушением нервной проводимости по результатам ЭНМГ операция декомпрессии нервных стволов (Невролиз и декомпрессия нерва, Рассечение спаек и декомпрессия стволов нервных сплетений), которая приводит к быстрому стойкому улучшению функции [1, 2, 14, 19-22].
Уровень убедительности рекомендации С (уровень достоверности доказательств 4)
Комментарии: частота рецидивов карпального туннельного синдрома у пациентов с различными типами МПС неизвестна. Поскольку повторная компрессия медианного нерва вследствие рубцевания или отложения гликозаминогликанов возможна, необходимо продолжать наблюдение.
- Рекомендуется пациентам с МПС I типа при сообщающейся гидроцефалии с прогрессирующим увеличением желудочков по данным МРТ и/или подтверждённым повышением давления церебро-спинальной жидкости более 250- 300 см водного столба вентрикуло-перитонеальное шунтирование [1, 2, 14, 19-22].
- Рекомендовано проведение хирургического вмешательства для пациентов с диагностированным стенозом шейного отдела — декомпрессии спинного мозга (Декомпрессия позвоночного канала микрохирургическая), что имеет решающее значение в устранении стеноза [1, 2, 14, 19-22].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 4).
Комментарии: сдавление спинного мозга приводит к необратимым неврологическим нарушениям, операцию следует рассматривать даже у пациентов без неврологической симптоматики, если сагиттальный диаметр позвоночного канала сужен более чем на 50%. Хирургическое вмешательство должно выполняться раньше развития неврологических проявлений.
- Рекомендуется проведение хирургической замены тазобедренного или коленного сустава, корригирующие остеотомии костей конечностей при выраженном нарушении функции конечности обусловленной деформацией или артрозом, при отсутствии эффекта от консервативной терапии [1, 2, 14,20,22].
- Рекомендовано пациентам с МПС I типа рассмотреть, при наличии показаний, проведение Аденоидэктомии (Аденоидэктомии с использованием видеоэндоскопических технологий) и/или Тонзилэктомии (Тонзиллэктомии с использованием видеоэндоскопических технологий) с целью улучшения проходимости дыхательных путей [1, 38].
- Всем пациентам с МПС I рекомендуется проведение 6-ти минутного теста с ходьбой для оценки выносливости (контроль эффективности ФЗТ) (Приложение А3.5) [1, 2, 14,17].
6. Организация оказания медицинской помощи
6.1 Показания для госпитализации в медицинскую организацию
- проведение диагностики и лечения, требующих круглосуточного медицинского наблюдения;
- состояние, требующее активного лечения и круглосуточного медицинского наблюдения (грыжесечение, оперативное лечение поражения суставов, позвоночника, сколиоз, аденоэктомия, тонзиллэктомия, нейрохирургическая декомпрессия синдрома запястного канала, установка транстимпанического дренажа при среднем отите, хирургическая коррекция патологии сердечно — сосудистой системы (ССС) и другие);
- состояние, требующее проведения высокотехнологичных методов лечения (в том числе, контроль эффективности ТГСК);
- отсутствие возможности обеспечения ФЗТ в амбулаторных и стационарозамещающих условиях;
- необходимость проведения различных видов экспертиз или обследования в медицинской организации при невозможности проведения их в амбулаторных условиях, требующих динамического наблюдения (в том числе оформление заключения федерального консилиума).
- острые заболевания;
- обострения хронических болезней;
- отравления и травмы, состояния, требующие интенсивной терапии и перевода в реанимационные отделения или отделения интенсивной терапии (в том числе побочные реакции, происходящие в процессе инфузии или в течение дня проведения инфузии ФЗТ, цервикальный стеноз с компрессией спинного мозга и другие угрожающие жизни острые состояния), а также круглосуточного медицинского наблюдения и проведения специальных видов обследования и лечения.
- отсутствие угрозы жизни пациента;
- отсутствие угрозы развития осложнений, требующих неотложного лечения;
- стабилизация состояния и основных клинико-лабораторных показателей патологического процесса по основному заболеванию;
- отсутствие необходимости в постоянном врачебном и круглосуточном медицинском наблюдении по основному заболеванию;
- необходимости перевода пациента в другую больницу или учреждение социального обеспечения.
При проведении наркоза и интубации необходимо помнить о высоком риске компрессии спинного мозга вследствие нестабильности атлантоаксиального сустава. Короткая шея, ограничение подвижности нижней челюсти, увеличение языка, выраженная гипертрофия аденоидов и миндалин создают проблемы при проведении анестезиологического пособия, поэтому предпочтение следует отдавать местному или региональному обезболиванию. Пациент предварительно консультируется врачом-кардиологом/врачом детским кардиологом, врачом-оториноларингологом, врачом-анестезиологом-реаниматологом, врачом-неврологом. Обязательно проведение полного кардиологического обследования, полисомнографии (для выявления степени дыхательных нарушений), при необходимости — эндоскопии носоглотки и компьютерной томографии легких. Оперативное вмешательство с анестезией необходимо проводить в крупных медицинских центрах, имеющих отделение реанимации и интенсивной терапии (ОРИТ), так как интубация и последующая экстубация у таких пациентов может вызвать затруднения [1-3].
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Специфической реабилитации пациентам с МПС I не требуется. В круг реабилитационных мероприятий пациентам с МПС I могут быть включены занятия с медицинским психологом, отдых в специализированных санаториях, а также социальная адаптация с участием специалистов и социальных работников, курсы массажа. Специфические методы реабилитации при наличии осложнений указаны в соответствующих разделах.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется консультация врача-генетика после установления диагноза МПС I пациенту или его официальным представителям, с целью разъяснений генетического риска, обсуждения возможностей пренатальной и преимплантационной диагностики [2, 6].
5.1 Пренатальная диагностика МПС I
- Рекомендуется проведение пренатальной диагностики для любой последующей беременности в семьях, отягощенных хотя бы одним случаем МПС I, но в случае легких форм болезни, решение о ее проведении должно быть принято после подробного обсуждения с семьей всех рисков [1,2].
5.2 Диспансерное наблюдение
Проводится регулярное динамическое наблюдение (Приложение А3.4)
Информация
Источники и литература
- Клинические рекомендации Союза педиатров России
- 1. Muenzer J, Wraith J.E., Clarke L.A. Mucopolysaccharidosis I: management and treatment guidelines. Pediatrics. 2009; 123(1):19-29; 2. Martins AM, Dualibi AP, Norato D et al. Guidelines for the Management of Mucopolysaccharidosis Type I. J Pediatr. 2009; 155(4);(2):32-46; 3. Thomas JA, Beck M, Clarke JTR, Cox GF Childhood onset of Scheie syndrome, the attenuated form of mucopolysaccharidosis I. J Inherit Metab Dis (2010) 33:421–427. 4. Vijay S, Wraith JE. Clinical presentation and follow-up of patients with the attenuated phenotype of mucopolysaccharidosis type I. Acta Paediatr. 2005;94:872–7. 5. Leroy JG. Disorders of lysosomal enzymes: clinical phenotypes. In: Royce PM, Steinman B, eds. Connective Tissue and Its Heritable Disorders: Molecular, Genetic, and Medical Aspects. 2 ed. Hoboken, NJ: John Wiley & Sons; 2003 6. Meikle PJ, Hopwood JJ, Clague AE, Carey WF. Prevalence of lysosomal storage disorders. JAMA. 1999;281:249–54. 7. Neufeld E, Muenzer J. The mucopolysaccharidoses. In: Scriver CR, Beaudet AL, Sly WS, Valle D, Childs B, Kinzler KW, Vogelstein B, eds. The Metabolic and Molecular Basis of Inherited Disease. 8 ed. New York. NY: McGraw-Hill; 2001:3421-52. 8. Oussoren E, Keulemans J, van Diggelen OP, Oemardien LF, Timmermans RG, van der Ploeg AT, Ruijter GJ. Residual α-L-iduronidase activity in fibroblasts of mild to severe Mucopolysaccharidosis type I patients. Mol Genet Metab. 2013;109:377–81. 9. Beesley CE, Meaney CA, Greenland G, Adams V, Vellodi A, Young EP, Winchester BG. Mutational analysis of 85 mucopolysaccharidosis type I families: frequency of known mutations, identification of 17 novel mutations and in vitro expression of missense mutations. Hum Genet. 2001;109:503–11. 0. Aronovich EL, Pan D, Whitley CB. Molecular genetic defect underlying alpha-L- iduronidase pseudodeficiency. Am J Hum Genet. 1996;58:75–85. 1. De Ru MH, Boelens JJ, Das AM, et al. Enzyme replacement therapy and/or hematopoietic stem cell transplantation at diagnosis in patients with mucopolysaccharidosis type I: results of a European consensus procedure. Orphanet Journal of Rare Diseases. 2011;6:55. doi:10.1186/1750-1172-6-55 2. Jameson E, Jones S, Remmington T. Enzyme replacement therapy with laronidase (Aldurazyme®) for treating mucopolysaccharidosis type I. Cochrane Database Syst Rev. 2019 Jun 18;6(6):CD009354 3. Clarke LA, Wraith JE, Beck M, Kolodny EH, Pastores GM, Muenzer J, Rapoport DM, Berger KI, Sidman M, Kakkis ED, Cox GF. Long-term efficacy and safety of laronidase in the treatment of mucopolysaccharidosis I. Pediatrics. 2009;123:229–40. 4. D»Aco K, Underhill L, Rangachari L, Arn P, Cox GF, Giugliani R, Okuyama T, Wijburg F, Kaplan P. Diagnosis and treatment trends in mucopolysaccharidosis I: findings from the MPS I Registry. Eur J Pediatr. 2012;171:911–9. 5. Braunlin EA, Stauffer NR, Peters CH, Bass JL, Berry JM, Hopwood JJ, Krivit W. Usefulness of bone marrow transplantation in the Hurler syndrome. Am J Cardiol. 2003;92:882–6. 6. Eisengart JB, Rudser KD, Tolar J, Orchard PJ, Kivisto T, Ziegler RS, Whitley CB, Shapiro EG. Enzyme replacement is associated with better cognitive outcomes after transplant in Hurler syndrome. J Pediatr. 2013;162:375–80. 7. Dornelles AD, Artigalás O, da Silva AA, et al. Efficacy and safety of intravenous laronidase for mucopolysaccharidosis type I: A systematic review and meta-analysis. PLoS One. 2017;12(8):e0184065. 8. Giugliani R, Federhen A, Rojas MV, et al. Mucopolysaccharidosis I, II, and VI: Brief review and guidelines for treatment. Genet Mol Biol. 2010;33(4):589–604. 9. Eisengart JB, Rudser KD, Xue Y, et al. Long-term outcomes of systemic therapies for Hurler syndrome: an international multicenter comparison. Genet Med. 2018;20(11):1423–1429. 0. Arn, Pamela et al. Characterization of Surgical Procedures in Patients with Mucopolysaccharidosis Type I: Findings from the MPS I Registry The Journal of Pediatrics, Volume 154, Issue 6, 859 — 864.e3 1. Миронов С.П., Колесов С.В., Переверзев В.С., Колбовский Д.А., Кулешов А.А., Ветрилэ М.С., Казьмин А.И. Опыт хирургического лечения краниовертебрального стеноза у пациентов с мукополисахаридозом I, II, VI типов. «Хирургия позвоночника». 2018;15(4):32-40. 2. Williams N., Challoumas D., and Eastwood D. M. Does orthopaedic surgery improve quality of life and function in patients with mucopolysaccharidoses? Journal of Children»s Orthopaedics 2017 11:4, 289-297. 3. ATS statement: Guidelines for the Six-Minute Walk Test. American Journal of Respiratory and Critical Care Medicine. Vol. 166, No.1. Jul 01, 2002 4. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, Khan DA, Lang DM, Park HS, Pichler W, Sanchez-Borges M, Shiohara T, Thong BY. International Consensus on drug allergy.Allergy. 2014 Apr;69(4):420-37. 5. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, Khan DA, Lang DM, Park HS, Pichler W, Sanchez-Borges M, Shiohara T, Thong BY. International Consensus on drug allergy.Allergy. 2014 Apr;69(4):420-37 6. Simons FE, Ebisawa M, Sanchez-Borges M, Thong BY, Worm M, Tanno LK, Lockey RF, El- Gamal YM, Brown SG, Park HS, Sheikh A. 2015 update of the evidence base: World Allergy Organization anaphylaxis guidelines. World Allergy Organ J. 2015 Oct 28;8(1):32 7. Bitencourt FH, Vieira TA, Steiner CE, Neto JC, Boy R, Schwartz IVD. Medical Costs Related to Enzyme Replacement Therapy for Mucopolysaccharidosis Types I, II, and VI in Brazil: A Multicenter Study. Value Health Reg Issues. 2015 Dec;8:99-106 8. Вашакмадзе Н.Д. Мультидисциплинарные принципы ведения детей с мукополисахаридозами в повышении эффективности их диагностики и лечения : автореферат дис доктора медицинских наук: 14.01.08, Екатеринбург, 2019. — 47 с. 9. Berger KI, Fagondes SC, Giugliani R, Hardy KA, Lee KS, McArdle C, Scarpa M, Tobin MJ, Ward SA, Rapoport DM. Respiratory and sleep disorders in mucopolysaccharidosis. J Inherit Metab Dis. 2013 Mar;36(2):201-10 0. Scarpa M, Lourenço CM, Amartino H. Epilepsy in mucopolysaccharidosis disorders. Mol Genet Metab. 2017 Dec;122S:55-61 1. Braunlin EA, Harmatz PR, Scarpa M, Furlanetto B, Kampmann C, Loehr JP, Ponder KP, Roberts WC, Rosenfeld HM, Giugliani R. Cardiac disease in patients with mucopolysaccharidosis: presentation, diagnosis and management. J Inherit Metab Dis. 2011 Dec;34(6):1183-97 2. Dornelles AD, Artigalás O, da Silva AA, Ardila DLV, Alegra T, Pereira TV, Vairo FPE, Schwartz IVD. Efficacy and safety of intravenous laronidase for mucopolysaccharidosis type I: A systematic review and meta-analysis. PLoS One. 2017 Aug 31;12(8):e0184065 3. Lin HY, Shih SC, Chuang CK, Chen MR, Niu DM, Lin SP. Assessment of bone mineral density by dual energy x-ray absorptiometry in patients with mucopolysaccharidoses. Orphanet J Rare Dis. 2013 May 11;8:71 4. Escolar ML, Jones SA, Shapiro EG, Horovitz DDG, Lampe C, Amartino H. Practical management of behavioral problems in mucopolysaccharidoses disorders. Mol Genet Metab. 2017 Dec;122S:35-40 5. Motamed M, Thorne S, Narula A. Treatment of otitis media with effusion in children with mucopolysaccharidoses. Int J Pediatr Otorhinolaryngol. 2000 Jun 30;53(2):121-4 6. Adam MP, Ardinger HH, Pagon RA, et al., editors. Mucopolysaccharidosis Type I Seattle (WA): University of Washington, Seattle; 1993-2020. https://www.ncbi.nlm.nih.gov/books/NBK1162/ 7. Congedi S, Orzalesi M, Di Pede C, Benini F. Pain in Mucopolysaccharidoses: Analysis of the Problem and Possible Treatments. Int J Mol Sci. 2018 Oct 8;19(10):3063 8. Venekamp RP, Hearne BJ, Chandrasekharan D, Blackshaw H, Lim J, Schilder AG. Tonsillectomy or adenotonsillectomy versus non-surgical management for obstructive sleep-disordered breathing in children. Cochrane Database Syst Rev. 2015 Oct 14; (10):CD011165, Bianchi PM, Gaini R, Vitale S. ENT and mucopolysaccharidoses. Ital J Pediatr. 2018 Nov 16;44(Suppl 2):127 9. Yang L, Shan Y, Wang S, Cai C, Zhang H. Endoscopic assisted adenoidectomy versus conventional curettage adenoidectomy: a meta-analysis of randomized controlled trials. Springerplus. 2016 Apr 11;5:426 0. Harrison R, Schaefer S, Warner L, Mercer J, Jones S, Bruce I. Transnasal adenoidectomy in mucopolysaccharidosis. Int J Pediatr Otorhinolaryngol. 2018 Aug;111:149-152 1. Mitchell RB, Archer SM, Ishman SL, Rosenfeld RM, Coles S, Finestone SA, Friedman NR, Giordano T, Hildrew DM, Kim TW, Lloyd RM, Parikh SR, Shulman ST, Walner DL, Walsh SA, Nnacheta LC. Clinical Practice Guideline: Tonsillectomy in Children (Update). Otolaryngol Head Neck Surg. 2019 Feb;160(1_suppl):S1-S42 2. Borg GAV. Psycho-physical bases of perceived exertion. Med Sci Sports Exerc 1982;14:377– 381, 3. Borg, G. Borg»s Perceived Exertion and pain Scales. USA: Human Kinetics, 1998, p. 2. 4. Grant S, Aitchison T, Henderson E, Christie J, Zare S, McMurray J, Dargie H. A comparison of the reproducibility and the sensitivity to change of visual analogue scales, Borg scales, and Likert scales in normal subjects during submaximal exercise. Chest. 1999 Nov;116(5):1208-17 5. Braunlin E, Steinberger J, DeFor T, Orchard P, Kelly AS. Metabolic Syndrome and Cardiovascular Risk Factors after Hematopoietic Cell Transplantation in Severe Mucopolysaccharidosis Type I (Hurler Syndrome). Biol Blood Marrow Transplant. 2018 Jun;24(6):1289-1293
Информация
Список сокращений
АЛТ – аланинаминотрансфераза;
АР – аллергическая реакция;
АСТ – аспартатаминотрансфераза ;
ГАГ — гликозаминогликаны;
КТ — компьютерная томография;
МПС — мукополисахаридоз;
МРТ — магнитно-резонансная томография;
ССС — сердечно — сосудистая система;
ТГСК — трансплантация гемопоэтических стволовых клеток;
УЗИ — ультразвуковое исследование;
ФВД — функция внешнего дыхания;
ФЗТ — ферментная заместительная терапия;
ЭКГ — электрокардиография;
ЭНМГ — электронейромиография;
Эхо-КГ — эхокардиография;
ЭЭГ — электроэнцефалография.Критерии оценки качества медицинской помощи



Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Байдакова Галина Викторовна— к.б.н., ведущий научный сотрудник лаборатории наследственных болезней обмена ФГБНУ «Медико-генетический научный центр им. академика Н.П.Бочкова».
Баранов Александр Александрович— акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей ЦКБ РАН, главный внештатный специалист педиатр Минздрава России.
Вахлова Ирина Вениаминовна- д.м.н., профессор, заведующая кафедрой госпитальной педиатрии Педиатрического факультета ФГБОУ ВО Уральский Государственный медицинский университет
Вашакмадзе Нато Джумберовна— д.м.н., доцент кафедры факультетской педиатрии ПФ ФГБОУ ВО РНИМУ имени Н.И. Пирогова МЗ РФ, Институт педиатрии и охраны здоровья детей ЦКБ РАН.
Воскобоева Елена Юрьевна — к.м.н., в.н.с. лаборатории наследственных болезней обмена ФГБНУ «Медико-генетический научный центр».
Захарова Екатерина Юрьевна -д.м.н., заведующая лабораторией наследственных болезней обмена ФГБНУ «Медико-генетический научный центр им. академика Н.П.Бочкова.
Кузенкова Людмила Михайловна— д.м.н., ФГАУ «НМИЦ здоровья детей» Минздрава России, профессор кафедры педиатрии и детской ревматологии ФГАОУ ВО Первый Московский государственный медицинский университет им. И.М. Сеченова Министерства здравоохранения Российской Федерации (Сеченовский Университет)
Куцев Сергей Иванович — чл.-корр РАМН, д.м.н., директор ФГБНУ «Медико- генетический научный центр им. академика Н.П.Бочкова «, Президент Ассоциации медицинских генетиков (АМГ).
Ларионова Валентина Ильинична— д.м.н., ФГБНУ «Институт экспериментальной медицины.
Лобжанидзе Тина Викторовна— к.м.н., заведующая дневным стационаром и отделением паллиативной медицины ГБУЗ «ГКБ № 64 ДЗМ».
Михайлова Людмила Константиновна — д.м.н., профессор, ученый секретарь ФГБУ «Национальный медицинский исследовательский центр травматологии и ортопедии имени Н.Н. Приорова» МЗ РФ.
Михайлова Светлана Витальевна -д.м.н., заведующая отделением ФГБУ «Российская Детская Клиническая Больница» МЗ РФ.
Моисеев Сергей Валентинович— д.м.н., заведующий кафедрой внутренних, профессиональных болезней и ревматологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет) МЗ РФ.
Назаренко Людмила Павловна- д. м. н., профессор Заслуженный врач РФ,, руководитель лаборатории наследственной патологии НИИ медицинской генетики Томского НИМЦ РАН.
Намазова-Баранова Лейла Сеймуровна— акад. РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей ЦКБ РАН, заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России.
Никитин Сергей Сергеевич — д.м.н., профессор, председатель «Общества специалистов по нервно-мышечным заболеваниям».
Печатникова Наталья Леонидовна — руководитель Центра орфанных и других редких заболеваний ГБУЗ «Морозовская детская городская клиническая больница ДЗМ».
Полякова Ольга Александровна— детский ортопед, травматолог ФГБУ «Национальный медицинский исследовательский центр травматологии и ортопедии имени Н.Н. Приорова» МЗ РФ.
Семячкина Алла Николаевна— д.м.н., г.н.с. отделения клинической генетики ФГБУ «Московский НИИ педиатрии и детской хирургии Минздрава России.
Удалова Ольга Васильевна— к.м.н., ООО «Медико-генетический центр «Геном»», председатель Нижегородского отделения РОМГ, руководитель Центра медицинской генетики ФГБОУ ВО «ПИМУ» Минздрава России, г. Нижний Новгород.
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Настоящие рекомендации предназначены для применения медицинскими организациями и учреждениями федеральных, территориальных и муниципальных органов управления здравоохранением, систем обязательного и добровольного медицинского страхования, другими медицинскими организациями различных организационно-правовых форм деятельности, направленной на оказание медицинской помощи.
Мукополисахаридозы относятся к редким наследственным заболеваниям, что исключает возможность проведения больших когортных и рандомизированных контролированных исследований и для создания протоколов диагностики и терапии используются лишь тематические исследования экспертов, опубликованные в последние два десятилетия.
Оценка качества доказательств и силы рекомендаций применения медицинских технологий проводилась в соответствии с унифицированной шкалой, приведенной в таблицах 1-3.
- Врачи общей врачебной практики (семейные врачи);
- Врачи- педиатры;
- Врачи-терапевты;
- Врачи-генетики;
- Врачи-лабораторные генетики;
- Врачи-кардиологи;
- Врачи-детские кардиологи;
- Врачи- неврологи;
- Врачи – травматологи-ортопеды
- Врачи-хирурги
- Врачи — детские хирурги
- Врачи — анестезиологи-реаниматологи
- Врачи — оториноларингологи
- Врачи -сурдологи-оториноларингологи
- Врачи ревматологи
- Врачи-эндокринологи
- Врачи -детские эндокринологи
- Врачи — рентгенологи;
- Врачи -психиатры
- Врачи функциональной диагностики;
- Медицинские психологи;
- Студенты медицинских ВУЗов;
- Обучающиеся в ординатуре.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД Расшифровка 1 Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа 2 Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа 3 Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования 4 Несравнительные исследования, описание клинического случая 5 Имеется лишь обоснование механизма действия или мнение экспертов Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД Расшифровка 1 Систематический обзор РКИ с применением мета-анализа 2 Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа 3 Нерандомизированные сравнительные исследования, в т.ч. когортные исследования 4 Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай- контроль» 5 Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР Расшифровка A Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) B Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) C Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) Экономический анализ:
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидизации рекомендаций:
- Внешняя экспертная оценка;
- Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать прежде всего то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей первичного звена в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Проект рекомендаций был рецензирован независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Рабочая группа:
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препаратаПриложение А3.1 Нормативные документы, использованные при подготовке клинических рекомендаций
- Приказ Министерства здравоохранения РФ «Об утверждении Порядка оказания медицинской помощи больным с врожденными и (или) наследственными заболеваниями» от 15 ноября 2012 г. N 917н).
- Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н «Об утверждении Порядка оказания педиатрической помощи»
- Приказ Минздрава России от 11.10.2018 № 694н Стандарт первичной медико- санитарной помощи детям при мукополисахаридозе I типа (ферментная заместительная терапия)
- Приказ Минздрава России от 11.10.2018 № 696н Стандарт специализированной медицинской помощи детям при мукополисахаридозе I типа (диагностика и инициация ферментной заместительной терапии)
- Стандарт специализированной медицинской помощи детям при мукополисахаридозе I типа (ферментная заместительная терапия) Приказ Минздрава России от 11.10.2018 N 695н
- Информация о лекарственных препаратах: Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru
- Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011 г., № 48, ст. 6724);
- Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ – 10);
- Приказ МЗ РФ от 20 декабря 2012г. № 1183н «Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников».
- Приказ МЗ РФ от 23 июля 2010 г. № 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
- Федеральный закон от 25.12.2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций».
- Приказ Минздрава России № 103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
- Приказ Минздрава России от 13.10.2017 N 804н «Об утверждении номенклатуры медицинских услуг».
- Приказ Министерства труда и социальной защиты РФ от 27 августа 2019 г. 585н «О классификациях и критериях, используемых при осуществлении медико- социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы»;
- Приказ Министерства здравоохранения РФ от 14 января 2019 г. № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения»
- Приказ Министерство здравоохранения и социального развития Российской Федерации «О порядке применения лекарственных средств у больных по жизненным показаниям» от 9 августа 2005 г. № 494
- Информационное письмо Минздрава России по возможности закупки лекарственного препарата по торговому наименованию (https://www.rosminzdrav.ru/news/2019/12/18/13043-minzdrav-podgotovil- informatsionnoe-pismo-po-vozmozhnosti-zakupki-lekarstvennogo-preparata-po- torgovomu-naimenovaniyu).
- Федеральный закон «О внесении изменений в Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам оказания паллиативной медицинской помощи» от 06.03.2019 № 18-ФЗ.
- Приказ Минздрава России № 345н, Минтруда России от 31.05.2019 № 372н «Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья».
- Приказ Минздрава России № 348н от 31 мая 2019 года «Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому».
- Приказ Минздрава России № 505н от 10 июля 2019 года «Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи».
- Приказ МЗ РФ № 831 от 3 октября 2019 года «Об утверждении ведомственной целевой программы «Развитие системы оказания паллиативной медицинской помощи».
Приложение А3.2 Классификация мукополисахаридозов.
Классификация мукополисахаридозов. [7]

Приложение А3.3 Выраженность клинических проявлений МПС I в разном возрасте
Выраженность клинических проявлений МПС I в разном возрасте
Система Симптом Дети Подростки/ взрослые Сердечно-сосудистая Кардиомиопатия + ++ Утолщение створок клапанов +++ +++ ЦНС Нарушение поведения ++ ++ Цервикальная миелопатия ++ +++ Гидроцефалия ++ ++ Задержка и отставание в развитии +++ ++ Судороги + ++ Нарушение глотания + ± Пищеварительная система Диарея + ± Гепатоспленомегалия +++ +++ Орган слуха Потеря слуха ++ ++ Рецидивирующий средний отит ++ ++ Орган зрения Дистрофия сетчатки ± ± Помутнение роговицы + +++ Скелетно- мышечная Нестабильность атланто- окципитального сочленения + + Туннельный карпальный синдром ++ ++ Грубые черты лица +++ ++ Дисплазия ТБС ++ ++ Множественный дизостоз + + Грыжи +++ ++ Контрактуры суставов +++ +++ Кифоз ++ + Макроцефалия +++ ++ Дыхательная Обструктивное апноэ во сне +++ +++ Рестриктивное заболевание легких + + Обструкция верхних дыхательных путей +++ +++ Специальные лабораторные тесты Дерматан сульфат в моче ↑↑ ↑↑ Гепаран сульфат в моче ↑↑ ↑↑ Идуронидаза ↓↓↓ ↓↓↓ Общие ГАГ в моче ↑↑ ↑↑ Приложение А3.4 Частота проведения обследования у пациентов с МПС I типа
Исследования Первоначальная оценка Каждые 3 мес Каждые 6 мес Каждые 12
месОдин раз в 2 года Прием врача-генетика Х Х Подтверждение диагноза Х Анамнез болезни Х Клинический осмотр врача-педиатра Х Х Рост, вес, окружность головы Х Х Выносливость (6-ти минутный тест ходьбы) 1 Х Х Осмотр врача-невролога Х Х Осмотр врача-хирурга/ врача-детского хирурга Х Х Компьютерная томография или МРТ головного мозга Х Х Когнитивное тестирование (DQ/IQ) 2 Х Х Электроэнцефалограмма Х Х Скорость нервной проводимости/ ЭМГ Х Х Осмотр врача- оториноларинголога Х Х Осмотр сурдолога- оториноларинголога Х Х Аудиометрия Х Х Осмотр врача- офтальмолога Х Х Острота зрения Х Х Осмотр глазного дна Х Х Исследование роговицы Х Х Осмотр врача- пульмонолога Х Х ФВД (исследование неспровоцированных объемов и потоков) Х Х Исследование сна/ полисомнография Кардиореспираторный мониторинг Х Х Осмотр врача- кардиолога/врача- детского кардиолога Х Х Электрокардиограмма Х Х Эхокардиография Х Х Осмотр врача- травматолога-ортопеда Х Х Рентгенография скелета Х Х УЗИ органов брюшной полости; объем селезенки, печени Х Х Осмотр врача- физиотерапевта Х Х Прием врача по лечебной физкультуре Х Х Осмотр врача- стоматолога/врача- детского стоматолога Х Х Лабораторные исследования Определение ГАГ в моче Х Х Анализ крови
Биохимический общетерапевтический (аланинаминотрансфераза (АЛТ),
аспартатаминотрансфераза (АСТ), общий и прямой билирубин, холестерин, триглицериды)Х Х 1 — Для детей старше 5 лет; расстояние, пройденное за 6 минут (предпочтительным является тот же промежуток времени, что и в предыдущих тестах этого пациента); число ступеней, пройденных вверх за 3 минуты. Оцениваются показатели сатурации SpO2, ЧДД, ЧСС до и после нагрузки.
2 — DQ или Коэффициент умственного развития (КУР) — способ сравнения интеллектуального развития, свойственного данному возрасту (умственных способностей ребенка по отношению к его сверстникам), с хронологическим возрастом (фактическим возрастом ребенка).
КУР рассчитывается делением интеллектуального возраста на хронологический и умножением на 100 для получения целого числа. Средний коэффициент умственного развития для любого возраста считается равным 100.
Приложение А3.5 Тест 6 минутной ходьбы (6МТХ) [24]
6MWT – тест 6-минутной ходьбы (6 minutes walking test, 6MWT)
Тест 6-минутной ходьбы является одним из наиболее простых и доступных в мировой практике способов оценки выносливости и функциональных возможностей пациентов с кардиологической и легочной патологиями, а также выявления таковых, в том числе и у детей. Перед началом теста и по истечении шести минут специалистом оценивается пройденный путь с точностью до метра, а также переносимость нагрузки по шкале Борга, артериальное давление, пульс, частота дыхания и сатурация кислородом крови. пациенту необходимо измерить артериальное давление, частота сердечных сокращений, частота дыхания, необходимо провести пульсоксиметрию. Ребёнок должен за 6 минут пройти максимально возможное для себя расстояние в комфортном для себя темпе. Дистанцию, пройденную в течение 6 мин (6МТХ), измеряют в метрах оценивают в динамике 1 раз в 6 мес. и сравнивают с данными предыдущего исследования.
Следует помнить, что для данного теста имеются следующие абсолютные противопоказания: острая боль в грудной клетке, декомпенсированная сердечная и дыхательная недостаточность, острые заболевания, лихорадка, заболевания опорно- двигательного аппарата препятствующие выполнению пробы.
К относительным противопоказаниям можно отнести выраженную брадитахикардию, высокую артериальную гипертензию и возраст ребенка. Малышам трудно осознать и исполнить все правила теста, поэтому он рекомендован для детей от 5 лет и старше.
Если пациент находится на постоянной кислородной поддержке, скорость подачи кислорода при проведении теста должна сохраняться в соответствии с предписанием врача, назначившего и контролирующего терапию.
Проведение теста необходимо немедленно прекратить в случае возникновения боли в груди, сильной одышки, судорог в ногах, головокружения, потери устойчивости, нарастающей слабости и явной бледности следует немедленно прекратить тест.
6MWT проводится в помещении, хорошо знакомом пациенту, имеющем достаточно длинный коридор с твердым покрытием. Длина проходимого пути должна составлять не менее 30 метров с разметкой каждые 5-10 метра, а также точками поворотов/ разворотов. На обоих концах пути нужно разметить кресла для подготовки и отдыха пациентов. Кроме того, необходимо позаботиться о наличии источника кислорода и дефибриллятора.
Также для теста вам понадобится тонометр, часы с секундной стрелкой, пульсоксиметр и телефон. Тест рекомендуется проводить в утренние часы после легкого завтрака. На пациенте должна быть удобная одежда и подходящая для прогулки обувь. Запрещены интенсивные физические нагрузки менее чем за два часа до испытания. Лечение пациента проходит в обычном режиме. Если в повседневной жизни ребёнок использует для ходьбы трость, костыли или ходунки, следует оставить их и для теста.
Приложение А3.6 Основные мероприятия при оказании помощи пациентам с аллергической реакцией на препарат [25]

1 Основные мероприятия при оказании помощи пациентам с анафилактической реакцией см. приложение Г7
Приложение А3.7 Основные мероприятия при оказании помощи пациентам с анафилактической реакцией[26]
1 Прекратите внутривенное введение терапевтического лекарственного средства, который вызывает анафилаксию или, если пациент начал отмечать изменения в общем самочувствии 2 Оцените кровообращение пациента(пульс), проходимость дыхательных путей (частоту дыхания), психическое состояние, уровень сознания, артериальное давление, наличие кожных проявлений, уточните массу тела 3 Введите эпинефрин** внутримышечно, в переднебоковую поверхность бедра), максимум 0,5 мг (подростки) или детям 0,05мл/кг массы тела (максимально 0,3 мл), новорожденным –0,01 мл/кг. Запишите время, введенную дозу и, при необходимости, повторите через 5-15 мин. Большинству пациентов необходимо 1-2 дозы эпинефрина**.
Не рекомендуется введение в одно место 1 мл и более эпинефрина**, так как, обладая большим сосудосуживающим действием, он тормозит и собственное всасывание. Предпочтительнее вводить его дробно по 0,3-0,5 мл в разные участки тела каждые 10-15 мин до тех пор, пока не наступит терапевтический эффект или же не последует развитие выраженных побочных явлений.4 Положите пациента на спину если имеется респираторный дистресс и/или рвота; поднимите нижние конечности (пациент не должен стоять, сидеть или двигаться, поскольку это может привести к внезапной смерти в случаях тяжелой анафилактоидной реакции).Запрокиньте и повернуть в сторону голову, выведите вперед и вверх нижнюю челюсть, приоткройте рот, зафиксируйте язык, удалите слизь из верхних дыхательных путей, если в этом появилась необходимость. 5 При показаниях дайте дополнительно кислород (6-8 л/мин) через маску или орофарингеальную трубку (Воздуховод орофарингеальный) ВАЖНО Бета-адреноблокаторы уменьшают терапевтический эффект эпинефрина** Усиливают побочные эффекты эпинефрина** симпатомиметики, дигоксин Приложение А3.8 Забор биоматериала для диагностики в пятнах крови


- вымыть руки (гигиенический уровень), надеть перчатки;
- вымыть руки пациента (пятку ребенка, в случае, если кровь берется из пятки);
- протереть область прокалывания стерильной салфеткой, смоченной 70% спиртом, промокнуть сухой стерильной салфеткой; — проколоть стерильным одноразовым скарификатором;
- снять первую каплю крови стерильным сухим тампоном;
- мягко надавить для получения второй капли крови;
- приложить перпендикулярно тест-бланк к капле крови и пропитать его кровью насквозь;
- аналогичным образом нанести на тест-бланк 6-8 капель, вид пятен крови должен быть одинаковым с обеих сторон.
- высушить тест-бланк в горизонтальном положении на чистой обезжиренной поверхности не менее 4 ч без применения тепловой обработки и попадания прямых солнечных лучей;
- упаковать тест-бланки в чистый конверт таким образом, чтобы пятна крови не соприкасались.
Особенности при инфузионной терапии
Некоторые пациенты могут получать инфузионную терапию, переливание компонентов крови, что может оказать влияние на результаты тестов. Например, при переливании плазмы крови могут быть получены ложно-отрицательные результаты, так как определяемые ферменты находятся в плазме и в клетках крови. Рекомендуется осуществить забор крови для ферментной и ДНК-диагностики не ранее чем через 6-7 дней после переливания плазмы крови и через 7-10 дней после переливания компонентов крови
Не допускается забор крови
- сразу после проведения пациенту инфузионной терапии;
- сразу после заменного переливания крови.
Хранение и транспортировка биоматериала
Образцы высушенных пятен крови можно хранить в обычной камере холодильника при +40С до отправки. Срок хранения до момента отправки не должен превышать 7 дней. Если хранить дольше и при более высокой температуре, то активность фермента даже в норме может снижаться, что приведет к ложно-положительным результатам.
Приложение А3.9. Расшифровка примечаний
…** – препарат входит в перечень жизненно необходимых и важнейших лекарственных препаратов (Распоряжение Правительства РФ от 12.10.2019 № 2406-р) «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов на 2020 год, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи», Распоряжение Правительства РФ от 23 ноября 2020 г. № 3073-р)
# — применение off-label – вне зарегистрированных в инструкции лекарственного средства показаний осуществляется по решению врачебной комиссии, с разрешения Локального этического комитета медицинской организации (при наличии), с условием подписанного информированного согласия родителей (законного представителя) и пациента в возрасте старше 15 лет;
*** — медицинское изделие, имплантируемое в организм человека при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи.
Приложение Б. Алгоритмы действий врача

Приложение В. Информация для пациента
Синдром Гурлер, Шейе и Гурлер-Шейе
Синдром Гурлер или мукополисахаридоз I (МПС I) – одна из первых описанных форм мукополисахаридозов (МПС). Заболевание, изначально названное болезнь Пфаундлера — Гурлер, впервые описано двумя педиатрами: австрийским — Гертрудой Гурлер (1889—1965) и немецким — Пфаундлер Мейнард (1872—1947). Затем американским офтальмологом Шейе (1909—1990) описана вторая форма болезни с более поздним началом и более доброкачественным течением, названная синдром Шейе. Позже описана промежуточная форма болезни, названная синдром Гурлер- Шейе. МПС I –очень редкое заболевание. По оценкам специалистов, оно встречается всего лишь у одного из 100 000 новорожденных.
За прошедшие годы был создан специальный препарат, который позволяет замедлить прогрессирование болезни, смягчить некоторые из ее проявлений. Однако, наряду с применением этого препарата, необходимо не забывать, о симптоматической терапии, физиотерапии, реабилитации, а главное – позитивном отношении к жизни пациента и членов его семьи.
При всех мукополисахаридозах нарушается обмен (расщепление) гликозаминогликанов (ГАГ) – особых структурных компонентов соединительной ткани.
ГАГ – это длинные цепочки молекул сахара, которые соединяются с белками и служат важным строительным материалом для костей, хрящей, кожи, сухожилий, клапанов сердца и многих других тканей. ГАГ содержатся в вязкой синовиальной жидкости, которая увлажняет суставы, входят в состав клапанов сердца, суставов и сухожилий. В норме происходит постоянный процесс образования «новых» ГАГ и расщепление
«старых». Для процесса расщепления и переработки ГАГ необходима группа особых белков-ферментов. Для того, чтобы расщепить ГАГ, ферменты работают по очереди, друг за другом, и расщепляют длинную молекулу ГАГ на части.У всех пациентов с МПС отсутствует фермент (особый для каждого типа МПС), который необходим для расщепления определенного ГАГ (Рис.1). У пациентов с МПС I типа отсутствует фермент, называемый альфа-L-идуронидаза, который необходим для расщепления ГАГ –гепарансульфата и дерматансульфата. Нерасщепленные ГАГ накапливаются в клетках, нарушая их работу. Дерматансульфат находится, главным образом, в костях и соединительной ткани и его накопление, прежде всего, вызывает множество проблем, связанных со скелетом. Гепарансульфат находится преимущественно в клетках нервной системы, что приводит к поражению головного мозга
МПС I типа относится к лизосомным болезням накопления. В лизосомах (органеллы клетки) происходит расщепление крупных молекул (макромолекул), таких, как жиры, белки, гликозаминогликаны, гликоген. При разных формах болезни нарушаются разные стадия расщепления этих макромолекул.
Наследование синдрома Гурлер, Шейе и Гурлер-Шейе
Мукополисахаридоз I типа – относится к наследственным заболеваниям и наследуется по аутосомно-рецессивному типу. Это значит, что болезнь проявляется только в том случае, если оба родителя являются носителями болезни и, хотя сами они не болеют, передают ребенку два пораженных гена. Большинство семей, где есть ребенок с этим заболеванием, не сталкивались раньше с подобной проблемой. Риск повторного рождения ребенка с МПС I в семье, где уже есть больные дети, составляет 25% на каждую беременность.
Все семьи с МПС I должны обязательно пройти медико-генетическое консультирование и получить полную информацию от врача-генетика о риске повторного проявления данного заболевания в семье, обсудить со специалистом все вопросы, связанные с наследованием заболевания. В России медико-генетические консультации работают в каждом регионе.
Как устанавливают диагноз?
Врачи на основании клинических симптомов могут заподозрить болезнь. Затем проводятся лабораторные тесты и инструментальное исследование. Поскольку разные типы МПС очень похожи по своим клиническим проявлениям, необходимо подтвердить диагноз с помощью лабораторных методов. Подтверждающая диагностика МПС заключается в определении уровня экскреции ГАГ в моче и измерении активности ферментов в клетках крови, пятнах высушенной крови или культуре кожных фибробластов. Для МПС I проводят определение активности альфа- L-идуронидазы. В дальнейшем рекомендуется проведение ДНК диагностики (если активность фермента была снижена).
Клинические проявления мукополисахаридоза I типа
Синдром Гурлер (а также Шейе и Гурлер-Шейе)– прогрессирующее мультисистемное заболевание и у пациента бывают поражены не только скелет и суставы, страдают также нервная система, органы зрения, слуха, сердечно-сосудистая и бронхо-легочная системы
- синдром Гурлер (мукополисахаридоз I H — тяжелая форма),
- синдром Гурлер-Шейе (мукополисахаридоз I H/S- промежуточная форма).
- синдром Шейе (мукополисахаридоз I S — легкая форма)
Степень выраженности клинических проявлений при данном синдроме различна. Известны и крайне тяжелые формы заболевания — синдром Гурлер, которые проявляются уже в раннем детстве, и довольно легкие, мягкие формы болезни — синдром Шейе. И, соответственно, промежуточная форма — синдром Гурлер-Шейе. В некоторых случаях наличие синдрома не влияет на продолжительность жизни пациента, но качество жизни, безусловно, страдает при всех формах болезни.
Основная задача врачей, близких и самого пациента с мукополисахаридозом I типа – сделать жизнь максимально комфортной, снизить риск тяжелых осложнений, замедлить прогрессирование болезни, смягчить основные симптомы заболевания.
Далее мы опишем основные проблемы, с которыми сталкиваются пациенты с синдромомами Гурлер, Шейе и Гурлер-Шейе, но это не означает, что они обязательно будут у каждого пациента. Заболевание протекает очень по-разному, даже в одной семье.
Раннее развитие, рост
Поставить диагноз синдрома Гурлер-Шейе новорожденному практически невозможно, так как наши пациенты рождаются в срок, с нормальными росто-весовыми показателями. Но при синдроме Гурлер — более тяжелой форме — первые клинические признаки заболевания появляются на первом году жизни. В ряде случаев, уже с рождения наблюдаются незначительное увеличение печени, пупочные или пахово- мошоночные грыжи. Рост замедляется, когда малыши достигают возраста одного-двух лет. Пациенты с тяжелой формой заболевания обычно почти прекращают расти в возрасте восьми лет – их рост обычно не превышает 110 см. Другие пациенты продолжают расти до подросткового возраста и достигают 152 – 160 см. При легкой форме рост у пациентов, как правило, ниже чем у здоровых сверстников, но бывает и почти нормальным.
Внешний вид пациентов с тяжелой формой синдрома Гурлер необычен – они больше похожи друг на друга, чем на своих родителей и здоровых братьев и сестер. Изменения в строении их лиц обозначают специальным термином лицевой дизморфизм (огрубление черт): крупная голова, короткая шея, круглое лицо, широкий нос с широкой и плоской переносицей.
При легкой и промежуточной форме заболевания внешние особенности у пациента столь незначительны, что их видят только врачи, а близкие и знакомые не замечают ничего необычного.
У пациентов с МПС I из-за отложения мукополисахаридов кожа «толстая» и жесткая, что затрудняет забор крови
Скелет, опорно-двигательная и костно-суставная система
У пациентов с МПС I типа, как и при всех других формах мукополисахаридозов, существуют проблемы с формированием и ростом костей. Изменение костей с нарушением их формы называют множественным дизостозом. При тяжелой форме синдрома — синдроме Гурлер изменяется строение позвонков. Один или два позвонка в середине спины бывают сплющены больше, чем остальные, и слегка смещены. Такое смещение позвонков порой становится причиной развития искривления позвоночника (кифоз, сколиоз). Если искривление позвоночника или сколиоз прогрессируют, то требуется медицинская помощь. При синдроме Шейе искривление позвоночника довольно легкое и не нуждается в хирургическом лечении.
Самые серьезные, опасные и жизнеугрожающие проблемы связаны с деформацией и особенностями строения шейного отдела. Если спинной мозг будет сдавлен или поврежден (шейная миелопатия), нарушится иннервация всех частей тела, что приведет к слабости (вялый парез) мышц, нарушениям при ходьбе, иногда даже к затруднениям с дыханием. При тяжелой форме заболевания слабость в руках и ногах может разбавиться на первом году жизни, что приводит к задержке двигательного развития ребенка.
Тугоподвижность суставов характерна для всех форм мукополисахаридозов. С годами тугоподвижность суставов может прогрессировать и стать причиной боли.
Из-за ограничения подвижности суставов и особенностей строения мелких костей кисти, пальцы рук становятся жесткими и искривляются, формируя так называемую «когтистую кисть».
Из-за тугоподвижности крупных суставов и особенностей строения костей пациенты ходят с слегка согнутыми коленями и бедрами. У некоторых пациентов развивается Х- образное искривление нижних конечностей (вальгусная деформация). Большинство врачей считает, что данная деформация носит приспособительный характер, помогая пациенту распределять вес, поэтому оперативную коррекцию в раннем возрасте в большинстве случаев лучше не проводить. Кроме того, в связи со слабостью связочного аппарата и нарушениям структуры костей, операция не всегда приводит к ожидаемому результату – деформация возвращается спустя какое-то время.
Нарушение дыхательной системы у пациентов с МПС связано как с особенностями строения скелета, хрящей трахеи и ребер, так и с накоплением ГАГ в мягких тканях (увеличиваются аденоиды, слизистые, выстилающие дыхательные пути, становятся рыхлыми, гипертрофированными, в результате чего просвет дыхательных путей уменьшается).
Важно понимать, что недостаточное снабжение тканей кислородом (гипоксия) влияет на функцию всех органов, поэтому улучшение дыхательной функции – одна из первоочередных задач.
Проблемы с дыханием усугубляет измененное строение грудной клетки: грудная клетка «жесткая» и не может двигаться свободно, не позволяет легким набрать большой объем воздуха. Эти особенности приводят к тому, что пациенты хуже переносят инфекции верхних дыхательных путей и легких.
Первыми симптомами нарушения функции верхних дыхательных путей могут служить ночной храп, шумное дыхание, обструктивное ночное апное (кратковременные, до нескольких секунд, задержки дыхания во время ночного сна). Такие проявления должны настораживать, так как в дальнейшем они могут прогрессировать и привести к развитию осложнений со стороны других органов (сердце, головной мозг).
Пациенты с МПС склонны к развитию отитов, ринитов и воспалению легких, поэтому антибактериальную терапию следует начинать уже на ранних стадиях заболевания. Несомненно, нужно консультироваться со специалистами, а не заниматься самолечением.
Несмотря на редкость и тяжесть заболевания, следует помнить, что вакцинировать пациентов с МПС обязательно, так как прививки помогают предотвратить развитие заболеваний, поражающих легкие. В том числе важно не пропустить вакцинацию против пневмококковой инфекции.
Ротовая полость и зубы
У пациентов с МПС I зубы покрыты хрупкой эмалью, что приводит к быстрому развитию кариеса.
Практически у всех пациентов с МПС I наблюдается патология сердечно-сосудистой системы: утолщение стенок сердца, снижение сократительной способности сердечной мышцы, изменения со стороны клапанного аппарата (уплотнение створок и хорд клапанов).
При осмотре пациентов с МПС I врач может обратить внимание на наличие «шумов» в сердце. Как правило, это связано с поражением клапанов: поврежденный клапан закрывается неплотно, при сокращении сердца небольшое количество крови двигается в обратном направлении, что вызывает шум, который слышит врач. Чаще всего поражаются аортальный и митральный клапаны.
Поражение легких, о котором написано выше, также может стать причиной изменений со стороны сердца. «Прокачивание» крови через измененные легкие, приводит к перегрузке правых отделов сердца, и развивается правосторонняя сердечная недостаточность.
Патология сердечно-сосудистой системы (ССС) у пациентов с МПС проявляется в виде: утолщение стенок сердца, изменения со стороны клапанного аппарата (уплотнение створок и хорд клапанов), развития сердечной недостаточности, как с сохраненной, так и со сниженной сократительной способностью миокарда.
Характерными признаками поражения ССС при МПС являются дисфункции клапанов (в основном, митрального, аортального клапанов), гипертрофия миокарда, нарушение ритма и проводимости. Функция клапанов, несмотря на их утолщение в результате отложения мукополисахаридов, может некоторое время не нарушаться. В последующем появляется шумы, характерные для митральной (систолический) и аортальной (диастолический) недостаточности, развивающиеся в результате несостоятельности клапанов. В дальнейшем укорочение хорд и фиброз левого артриовентрикулярного кольца приводят к стенозированию митрального отверстия. Недостаточность трикуспидального и пульмонального клапана обычно клинически не диагностируются.
Самой частой причиной развития сердечной недостаточности с сохраненной фракцией выброса левого желудочка у этих пациентов является повышение жесткости миокарда в результате отложения мукополисахаридов (по типу рестриктивной кардиомиопатии). В редких случаях может наблюдаться снижение сократительной способности за счет дилатации полостей.
Кроме того, сердечная недостаточность может развиваться с поражением правых отделов сердца, по типу хронического легочного сердца, в результате деформации грудной клетки, поражения легких из-за отложения мукополисахаридов (жесткие легкие), нарушения дренирования бронхиального дерева из-за сужения бронхов и развивающейся трахеомаляции и развития хронической гипоксии.
При синдроме Гурлер печень и селезенка увеличены из-за накопления ГАГ (гепатоспленомегалия). Увеличение печени обычно не приводит к нарушению ее функции, но может влиять на переносимость той или иной пищи.
При мукополисахаридозах, как правило, живот увеличен в объеме за счет гепатоспленомегалии и слабости прямых мышц живота. Также часто возникают сочетанные или изолированные грыжи (пупочная, паховая, пахово-мошоночной и средней линии живота). Решение о необходимости оперативного лечения должно приниматься совместно с лечащим врачом: показанием к срочной операции служит ущемление грыжевого выпячивания.
У пациентов с МПС I нередко наблюдается неустойчивый стул (запоры или диарея). Причина этого до конца непонятна. Возможно, нарушается функция вегетативной нервной системы, поскольку ГАГ накапливаются в нервных клетках кишечника. Диарея может исчезать с возрастом, но во время приема антибиотиков появляться вновь. Если диарея возникла из-за приема антибиотиков, врачи могут назначить препараты, способствующие нормализации микрофлоры кишечника. Если пациент мало двигается, то могут развиться запоры. В этом случае эффективно увеличение в рационе количества грубой пищи (клетчатки).
При синдроме Гурлер дети развиваются с задержкой речи, у них страдает интеллект, нарушается поведение. По мере нарастания нарушений интеллекта к гиперактивности и агрессивности присоединяются аутистические черты. При мягких формах — синдроме Гурлер-Шейе и Шейе интеллект не страдает, развитие слегка замедленное.
При тяжелых формах так же могут возникать нарушения циркуляция спинномозговой жидкости. В этом случае пациенты жалуются на головные боли, у детей обращают на себя внимание беспокойство, рвота, задержка развития. Необходима консультация врача-нейрохирурга для решения вопроса о необходимости оперативного или медикаментозного лечения данного осложнения. Прогрессирующая сообщающаяся гидроцефалия является наиболее частым симптомом синдрома Гурлер и редко встречается при мягких формах МПС I типа (синдромах Гурлер-Шейе и Шейе).
Если возникают подозрения на гидроцефалию, то необходимо провести компьютерную томографию или МРТ. Осмотра глазного дна окулистом недостаточно для постановки диагноза, т.к. гидроцефалия у детей с МПС I может протекать и без застойных изменений на глазном дне.
Сдавление спинного мозга приводит к необратимым неврологическим нарушениям, поэтому декомпрессирующее оперативное лечение следует рассматривать даже у пациентов без неврологической симптоматики, зачастую хирургическое вмешательство должно выполняться раньше развития неврологических проявлений.
При появлении неврологического дефицита пациент может уже находится на грани курабельности, при появлении первых симптомов рассматривается вопрос о срочном хирургическом вмешательстве.
Проведение хирургической замены тазобедренного или коленного сустава, исправление оси конечности, устранение стеноза карпального канала показано при выраженном нарушении функции и при отсутствии эффекта от консервативной терапии.
Карпальный синдром (запястный синдром, туннельный синдром) – распространенная проблема у пациентов с МПС. Нервы проходят через запястье между запястными костями и связками. Утолщение связок за счет накопления ГАГ оказывает давление на нервы. Проявлением этого синдрома могут быть боль и онемение пальцев рук и трудности c захватом предметов.
Для диагностики измеряют скорость проведения нервного импульса в области кисти. Это простая процедура, позволяющая установить наличие или отсутствие повреждения нервов.
Некоторые нарушения нервной системы (двигательные расстройства) являются вторичными и в большей степени связаны с поражением скелета.
Накопление ГАГ происходит во многих тканях, в том числе, в роговице, поэтому может наблюдаться ее помутнение. Одним из признаков изменения роговицы является непереносимость яркого света, так как помутнение вызывает неправильное преломление света. В этом случае могут помочь солнечные очки. Если помутнение роговицы тяжелое, ухудшается зрение, особенно при тусклом свете.
Отложение ГАГ в сетчатке может привести к потере периферического зрения и никталопии («куриной слепоте»). Ребенок в этой ситуации пугается и отказываться ходить в темное время суток. Желательно оставлять ночник включенным в спальне и коридоре. Иногда могут возникать проблемы со зрением, вызванные изменениями в сетчатке глаза или глаукомой (повышенным внутриглазным давлением), поэтому регулярные осмотры врача-офтальмолога необходимы.
С помощью специальных исследований специалист определит, из-за чего ухудшается зрение.
При МПС тугоухость может быть нейросенсорная (связанная с нарушением чувствительных (волосковых) клеток в улитке), кондуктивная (связанная с нарушением звукопроводящих путей) или смешанная (комбинация двух типов). При синдроме Гурлер тугоухость чаще носит смешанный характер и прогрессирует с возрастом. Различают 3 степени тугоухости: легкую, умеренную и тяжелую. В зависимости от типа и тяжести поражения слуха применяют различные методы коррекции. Важно как можно раньше заметить признаки снижения слуха, так как без коррекции тугоухость помешает нормальному развитию и обучению пациентов. Фактором, усугубляющим нарушение слуха, являются частые инфекции среднего уха (отиты).
Лечение, наблюдение и плановые обследования
Врачами-экспертами из разных стран были созданы рекомендации по наблюдению, диагностике и лечению пациентов с МПС I типа. И мы вкратце расскажем о них.
Наблюдение, плановые обследования и тесты
Для того, чтобы оценивать состояние пациента, эффект проводимой ферментной терапии, физиотерапии, существуют различные тесты и шкалы. Очень важно не отказываться от проведения этих исследований, потому что они помогают врачам объективно оценить состояние пациента, обосновать лечение, ввести изменения в программы реабилитации и абилитации.
Самым известным является 6 минутный тест ходьбы. Суть его очень простая: оценить выносливость пациента. Пациенту предлагают ходить по длинному коридору в течение 6 минут. Оценивается количество сделанных шагов. Когда проводили первые клинические испытания препарата для лечения МПС разных типов, исследователи проводили такое тестирование до и после начала ферментной терапии, сравнивали результаты группы пациентов, получавших препарат, с результатами тех, кто получал плацебо. Именно тест доказал, что ферментная заместительная терапия улучшает выносливость пациентов и их двигательную активность.
Чтобы оценить степень ограничения дыхания, врач может провести легочные функциональные тесты. Легочные функциональные тесты определяют, какой максимальный объем воздуха может вдохнуть пациент, насколько быстро происходит газообмен. Эти тесты могут выявить заболевания легких, определить степень их поражения и оценить эффективность лечения. Тесты обычно выполняются с использованием специального оборудования. Во время исследования нужно по команде вдыхать, задерживать воздух, выдыхать. Исследование функции легких не представляет опасности для здоровья.
Для диагностики заболевания легких и бронхов необходимо провести функцию внешнего дыхания (ФВД). При помощи ФВД определяют, какой максимальный объем воздуха может вдохнуть пациент, насколько быстро происходит газообмен. Эти тесты могут выявить заболевания легких, определить степень их поражения и оценить эффективность лечения. Тесты обычно выполняются с использованием специального оборудования — спирометра. Во время исследования нужно по команде вдыхать, задерживать воздух, выдыхать. Исследование функции легких не представляет опасности для здоровья.
Выслушивание (аускультация) сердца должно быть обязательным и регулярным исследованием для пациентов с мукополисахаридозами. Важным методом изучения сердца является ультразвуковой – эхокардиография (Эхо-КГ), она безопасна, безболезненна и высокоинформативна. Современные приборы позволяют получить одно-, двух- и трехмерное изображение сердца, определить скорость кровотока и давление в различных отделах, определить направление и турбулентный характер кровотока. Эхо-КГ рекомендуют проводить по показаниям, но не реже 1 раза в год. Это исследование необходимо, чтобы обнаружить любые проблемы с сердцем (увеличение размеров, индекс массы левого желудочка, нарушение сократительной функции (фракция выброса), а также диастолической функции, оценка сердечных клапанов, движение межжелудочковой перегородки)
При необходимости, возможно проведение МРТ с контрастированием сердца: для более детального исследования структуры и функции желудочков, магистральных сосудов и коронарных артерий.
Кроме того, для выявления нарушения ритма и проводимости сердца необходимо проводить Холтеровское мониторирование ЭКГ, не реже 1 раза в год. А для выявления артериальной гипертонии Проведение суточного мониторирования АД.
Необходимо регулярно (два раза в год) проводить проверку слуха, для того чтобы сразу же начать лечение, если потребуется, и максимально сохранить возможность учиться и общаться.
Магнитная резонансная томография
МРТ позвоночника должна проводится ежегодно, с особенным фокусом на областях, в которых может развиваться компрессия спинного мозга: шейный, грудной, грудопоясничный отделы. Пациенты с мукополисахаридозом I типа должны наблюдаться у хирурга-ортопеда, чтобы он контролировал состояние шейного отдела позвоночника. Важно оценивать результаты исследований в динамике, поэтому все снимки следует хранить и предоставлять врачам при каждом следующем исследовании. Компьютерную томографию позвоночника проводят, как правило, перед планируемым оперативным лечением.
Рентген шейного и грудо-поясничного отделов позвоночника в двух проекциях следует проводить каждые 1-3 года. Это исследование провести технически проще, чем МРТ, кроме того рентгенография дает больше информации о строении позвонков.
Список рекомендуемых обследований приведен в таблице 1.
Основная цель симптоматического лечения – скорректировать вызванные заболеванием изменения.
Скелет и опорно-двигательная система костно- суставная система
Важно найти баланс между возможностью жить максимально полной жизнью и минимизацией осложнений, связанных с особенностями строения скелета пациентов. С одной стороны, не следует чрезмерно ограничивать и опекать детей, лечебная физкультура необходима, но некоторые виды физической активности, такие, как кувыркание, стойка на голове и ныряние должны быть полностью исключены из-за нестабильности шейного отдела. Разрешаются легкие подскоки, но пациент не должен самостоятельно прыгать на обе ноги, потому что система опоры и координации движений у него слабо развита. Родителям школьников нужно обязательно сообщить учителю физкультуры об особенностях ученика.
Пациенты с синдромом Гурлер-Шейе должны вести подвижный образ жизни для поддержания функционирования суставов и улучшения общего состояния здоровья. Врач-педиатр или врач-физиотерапевт может посоветовать различные комбинации ежедневных упражнений.
Интенсивная терапия для улучшения подвижности суставов и позвоночника, а также для укрепления спинной и брюшной мускулатуры рекомендована всем пациентам. Чтобы уменьшить последствия гиперлордоза, необходимо укреплять грудную мускулатуру, при этом проводить терапию, направленную на развитие пояснично- крестцового отдела. Важно следить, чтобы пациент не перенапрягался и не уставал чрезмерно, поэтому рекомендуется тщательно изучить его физическое состояние и выработать индивидуальные рекомендации.
- упражнения на выработку осанки и чувства равновесия;
- упражнения на растяжение;
- водные процедуры и занятия спортом в воде, особенно для пожилых пациентов. Расслабляющий массаж и подводный массаж оказывают весьма благоприятное действие.
Чтобы поддерживать подвижность ступней, необходимо выполнять специальные упражнения, лучше всего дома или во время игр. Для снятия чрезмерного мышечного напряжения необходима ортопедическая обувь, стельки и вкладыши, которые выполняют поддерживающую функцию, в некоторых случаях – ортезы. Ванночки, массаж ног также необходимы.
Важно выполнять упражнения на растяжку мышц задней поверхности бедра и голени.
Для улучшения мелкой моторики кистей рук рекомендована интенсивная гимнастика для пальцев и ладошек, ее родители и сами пациенты могут проводить дома.
После интенсивных занятий электротерапия, ручной массаж, водный массаж, терапия лечебной грязью, занятия на водных тренажерах снимают боль и приносят облегчение.
При проведении всех активных видов терапии следует обращать особое внимание на ритм дыхания и давать достаточное количество перерывов для отдыха и восстановления дыхания.
Существуют различные мнения о необходимости хирургического вмешательства. Но оперативное вмешательство – всегда риск, и прибегать к нему следует только в случае острой необходимости. Большая сложность при МПС – проведение анестезии. Нестабильность шейного отдела позвоночника, трудности при открывании рта, большой язык и миндалины у пациентов с МПС увеличивает риск травматического повреждения при ведении анестезии, так как многие анестезиологические пособия связаны с максимальным разгибанием шеи. В этом случае нужно принять специальные меры предосторожности. Интубировать людей с МПС должен опытный врач, имеющий определенные навыки. Если пациент попал в критическом состоянии в больницу, необходимо сообщить анестезиологу, что возможны проблемы с шеей и интубацией. Дыхательные пути, как правило, сужены, поэтому может потребоваться эндотрахеальная трубка меньшего диаметра. Сама установка такой трубки — очень трудный процесс, возможно, потребуется использование гибкого бронхоскопа.
Нестабильность шейного отдела позвоночника корректируется с помощью операции (шейный спондилодез). С помощью костных фрагментов или искусственных материалов формируется опора, объединяющая два верхних позвонка и основание черепа.
Нейросенсорная и кондуктивная тугоухость в большинстве случаев могут компенсироваться подбором слуховых аппаратов (Аппарат слуховой костной проводимости с костной фиксацией имплантируемый*** Аппарат слуховой костной проводимости с креплением на голове***, Система имплантации среднего уха полностью имплантируемая***, Аппарат слуховой костной проводимости с имплантируемым вибратором***, ). При частых отитах проводится шунтирование барабанных полостей для оттока жидкости.
Из-за развития клапанных дисфункций нередко рекомендована консультация кардиохирурга для решения вопроса о необходимости протезирования клапанов сердца. Из-за часто развивающихся нарушений ритма ставится вопрос об имплантации кардиовертера-дефибриллятора.
Важно, чтобы осуществлялся хороший уход за зубами, так как разрушенные зубы причиняют сильный дискомфорт и являются очагами инфекции. Необходимо регулярно чистить зубы, использовать растворы для полоскания. Но даже при самой тщательной заботе о зубах, могут развиваться воспалительные процессы. Раздражительность, плач и беспокойство иногда могут быть единственными симптомами проблем с зубами. Перед оперативным лечением зубов пациентам, у которых уже диагностировано поражение клапанов сердца, необходим профилактический прием антибиотиков до и после лечения. Это вызвано тем, что некоторые бактерии из ротовой полости могут проникнуть в кровоток и вызвать инфекционный процесс на пораженном клапане. Если необходимо удаление зуба под анестезией, это должно быть сделано в больнице, а не в стоматологической поликлинике, под наблюдением опытного анестезиолога и зубного врача.
Лечение банального ОРВИ у пациентов с МПС лучше также проводить под пристальным вниманием врача. Следует помнить об особенностях применения стандартных препаратов у этой группы пациентов. Например, такие лекарства, как антигистаминные препараты системного действия, могут сушить слизистую, делая ее толще, противоотечные или сосудосуживающие средства могут повысить кровяное давление и сузить кровеносные сосуды, что нежелательно при МПС.
Из-за особенностей строения позвоночника и грудной клетки, пациентам с мукополисахаридозом I типа сложнее справиться с инфекцией, если она затрагивает легкие, поэтому врачи даже при незначительной инфекции могут назначать антибиотики.
Чтобы нормализовать циркуляцию воздуха в легких, рекомендуется и профилактически, и во время болезни проводить игры с мыльными пузырями, ватой, соломинками для напитков, бумажными пакетами и другими предметами (воздушными шарами, мячами), требующими активной работы дыхательной системы. Для детей постарше, для подростков можно разработать упражнения для растяжения мышц грудной клетки, чтобы родители могли самостоятельно заниматься с детьми.
Пассивные упражнения для грудной клетки применяются для пациентов с острыми инфекциями дыхательных путей или для пациентов, которые не могут самостоятельно двигаться. Упражнения помогают более эффективному отделению слизи. К ним относятся потягивания, растяжения, потряхивания, массаж и вибрации.
Специальная диета не сможет предотвратить накопление ГАГ, так как они синтезируются в клетках, а не поступают с пищей. Поэтому ограничения в диете пациентам с МПС не нужны, дети должны питаться в соответствии с возрастными потребностями.
Для МПС тип I разработана специальная ферментная заместительная терапия, препарат – ларонидаза**. Пациенту еженедельно внутривенно вводят недостающий фермент в стандартной дозировке (100ЕД/кг). В самой процедуре внутривенного введения фермента нет ничего сложного, и при определенном навыке инфузию можно проводить в любой больнице.
Эффект от терапии во многом зависит от того, когда было начато лечение. Вместе с врачом необходимо перед началом ферментной заместительной терапии обсудить все возможные риски, побочные эффекты и главное – ожидания от лечения. Важно понимать, что введение фермента не позволит вылечить заболевание, цель терапии – замедлить прогрессию болезни. Те деформации, которые уже сформировались, терапия не исправит, инфузионная терапия не заменит необходимые хирургические вмешательства.
Таблица 1 — План обследования пациентов с МПС I


Трансплантация костного мозга/гемопоэтических стволовых клеток
Рекомендовано проведение трансплантации гемопоэтических стволовых клеток (ТГСК) пациентам с синдромом Гурлер до достижения возраста двух лет при нормальных или субнормальных показателях развития интеллекта (DQ>70). Одним из наиболее значимых эффектов трансплантации является сохранение интеллектуального развития детей, имеющих тяжелый генотип, ассоциированный с серьезными умственными расстройствами. У этих пациентов были отмечены существенные изменения черт лица (уменьшения проявлений “гаргоилизма”), улучшение или стабилизация сердечно-сосудистой системы. Однако изменения скелета сохранились, в некоторых случаях отмечалось даже ухудшение ситуации. У многих пациентов наблюдалось улучшение электроретинограммы (функция сетчатки) через 1-2 года после пересадки костного мозга, однако последующие наблюдения показали, что с течением времени происходит ухудшение. Не было получено однозначных данных о влиянии пересадки костного мозга на степень помутнения роговицы.
Нельзя не отметить, что сама процедура проведения трансплантации довольно рискованна для пациента, в связи с частыми осложнениями, вызванными
«отторжением» трансплантанта организмом пациента.
Половая зрелость и брак
Подростки с синдромом Гурлер-Шейе и Шейе проходят нормальные стадии полового созревания, однако начинается оно несколько позже. Заболевание не влияет на фертильность, но женщинам с тяжелой формой заболевания иногда сложно выносить ребенка в связи с тяжелыми нарушениями со стороны сердца и скелета. В мире и в России есть семьи, матери которых родили несколько здоровых детей. Поэтому все вопросы, связанные с беременностью и родами нужно решать индивидуально.
Все дети от родителей с синдромом Гурлер-Шейе и Шейе являются носителями заболевания, но не болеют, если второй родитель здоров и не является носителем гена МПС I.
Пациентам с мягкой формой заболевания необходимо научиться быть независимыми от своих семей. Не давайте ребенку, подростку замкнуться в себе. Ему нужны друзья, общение и навыки самостоятельной жизни.
Поскольку дети с мягкой формой синдрома имеют нормальный интеллект, необходимо приложить все усилия, чтобы они получили хорошее образование.
В каждом из регионов определены лечебные учреждения, в которых пациенты получают и патогенетическое лечение и проходят все необходимые исследования.
Узнать больше
В мире есть много организаций, которые могут помочь вам найти ответы на любые вопросы, связанных с мукополисахаридозами:
Международная организация по мукополисахаридозам: www. mpssociety.org
Международный портал по редким болезням www.orpha.net
Европейская организация, объединяющая пациентов с разными редкими заболеваниями EURORDIS www.eurordis.org
Помните, что активная позиция самих пациентов – залог успешной и счастливой жизни!
Общественные организации и фонды России
МПС I типа входит в перечень орфанных заболеваний, лечение которых проводится за счёт средств государства. Помочь пациентам получить лечение, повысить информированность общества о редких болезнях, а также добиваться продвижения законодательных инициатив в области орфанных заболеваний могут общественные организации. В сети интернет вы сможете найти информацию о нескольких общественных организациях, которые помогают семьям с мукополисахаридозами.
Мукополисахаридозы – путь к диагнозу
Мукополисахаридозы (МПС) – это группа редких наследственных заболеваний, которые обусловлены дефицитом определенных лизосомных ферментов, участвующих в разрушении гликозаминогликанов (ГАГ), и характеризуются накоплением последних в различных органах и тканях. У части больных наблюдается медленное прогрессирование МПС, а типичные фенотипические признаки появляются в подростковом или зрелом возрасте, что в значительной степени затрудняется диагностику. Одним из типичных симптомов МПС является нарастающая тугоподвижность суставах, поэтому такие больные могут обращаться за помощью к ревматологам. Особенность поражения опорно-двигательного аппарата при МПС – отсутствие локальных и системных признаков воспаления. Важное диагностическое значение имеют системные проявления, такие как пупочная и паховая грыжа, изменение черт лица, помутнение роговицы, низкий рост, увеличение печени и селезенки, рецидивирующие инфекции дыхательных путей и средний отит и др. Для подтверждения диагноза определяют экскрецию ГАГ с мочой и активность лизосомных ферментов, а также проводят молекулярно-генетическое исследование.
Мукополисахаридозы (МПС) – это группа редких лизосомных болезней накопления, характеризующихся нарушением обмена гликозаминогликанов (ГАГ). Причиной каждого МПС является генетически обусловленный дефицит определенного лизосомного фермента, участвующего в разрушении ГАГ. Практически все МПС (за исключением МПС II) наследуются по аутосомно-рецессивному типу и с равной частотой встречаются у мальчиков и девочек. МПС II – это Х-сцепленное рецессивное заболевание, которое развивается у мальчиков, хотя описаны отдельные случаи и у девочек [1].
Накопление ГАГ в лизосомах различных тканей сопровождается разнообразными системными проявлениями, в том числе поражением опорно-двигательного аппарата, сердца, нервной системы, органа зрения и др., и приводит к прогрессирующему ухудшению функции внутренних органов. МПС в целом характеризуются тяжелым течением и неблагоприятным прогнозом, поэтому многие пациенты умирают в детском или подростковом возрасте. Однако возможно и более легкое течение заболевания, в частности МПС I и МПС VI, когда симптомы появляются в подростковом или старшем возрасте и нарастают более постепенно, а пациенты доживают до зрелого возраста [2,3]. В таких случаях диагноз нередко устанавливают с опозданием, а МПС длительно протекает под маской других болезней, прежде всего ревматических. Выделение легкого варианта течения МПС весьма условно, так как при медленном прогрессировании заболевания в конечном итоге развивается тяжелое поражение отдельных органов, которое приводит к инвалидизации пациентов и может потребовать оперативного вмешательства (например, протезирование тазобедренного сустава, имплантация искусственного клапана сердца, декомпрессия спинного мозга) [4]. МПС – это неоднородная группа заболеваний, которые имеют как общие фенотипические признаки, так и существенные различия (табл. 1, 2)
ТАБЛИЦА 1. Спектр клиническихпроявлений МПС
• МПС I, II и VII – системные заболевания, поражающие различные органы и ткани, включая ЦНС; неврологические нарушения не бывают изолированными. • МПС III характеризуется поражением ЦНС при отсутствии соматических проявлений. • МПС IV поражает в основном опорно-двигательный аппарат и не сопровождается снижением интеллекта. • При МПС VI наблюдается поражение различных органов и систем, интеллект остается нормальным. ТАБЛИЦА 2. Классификация МПС
Тип Название Фермент Ген Тип наследования Лечение МПС I Синдромы Гурлера, Шейе или Гурлера-Шейе α-L-идуронидаза IDUA 4p16.3 Аутосомно-рецессивный Ларонидаза МПС II Синдром Хантера Идуронат-2-сульфатаза IDS Xq28 X-сцепленный рецессивный Идурсульфаза МПС IIIA Синдром Санфилиппо A Гепаран-N-сульфатаза SGSH 17q25.3 Аутосомно-рецессивный Разрабатывается МПС IIIB Синдром Санфилиппо В α-N-ацетилглюкозаминидаза NAGLU 17q21 Аутосомно-рецессивный МПС IIIC Синдром Санфилиппо С Ацетил-КоА α-глюкозамин-ацетил-трансфераза HGSNAT 8p11.1 Аутосомно-рецессивный МПС IIID Синдром Санфилиппо D N-ацетилглюкозамин-6-сульфатаза GNS 12q14 Аутосомно-рецессивный — MПС IVA Синдром Моркио А Галактозамин-6 сульфатсульфатаза GALNS 16q24.3 Аутосомно-рецессивный Элосульфаза MПС IVB Синдром Моркио В β-Галактозидаза GLB1 3p21.33 Аутосомно-рецессивный — MПС VI Синдром Марото-Лами Арилсульфатаза B ARSB 5q11.q13 Аутосомно-рецессивный Галсульфаза МПС VII Синдром Слая β-Глюкуронидаза GUSB 7q21.11 Аутосомно-рецессивный Разрабатыва МПС IX Синдром Натовича Гиалуронидаза I AH 3p21.3-p21.2 Аутосомно-рецессивный — Своевременная диагностика МПС сегодня приобрела особое значение, учитывая возможность заместительной терапии рекомбинантными ферментами, такими как идурсульфаза (МПС II), ларонидаза (МПС I), галсульфаза (МПС VI) и элосульфаза (МПС IVA), которые позволяют улучшить состояние больных или по крайней мере затормозить прогрессирование заболевания [5]. Ферментозаместительная терапия (ФЗТ) более эффективна, если ее начинают на более раннем этапе, когда еще отсутствуют необратимые проявления болезни.
Трудности диагностики МПС
МПС относятся к очень редким (орфанным) заболеваниям. В разных странах различные МПС регистрировали с частотой 1 на 16000-29000 живых новорожденных [6,7], а в 2007 году в Скандинавских странах распространенность МПС составила всего 4-7 случаев на 1 млн населения [8]. В связи с этим информированность врачей, особенно наблюдающих взрослых пациентов, о МПС низкая. Дополнительные сложности в диагностике возникают при более легком течении МПС, особенно при отсутствии типичных фенотипических проявлений, таких как низкий рост и характерные черты лица. Например, в зависимости от клинических проявлений и течения выделяют три формы МПС I – тяжелую (синдром Гурлера), промежуточную (синдром Гурлера-Шейе) и более легкую (синдром Шейе). Во всех случаях причиной заболевания является мутация гена, кодирующего α-L-идуронидазу. У пациентов с синдромом Гурлера симптомы появляются в раннем детском возрасте и часто наблюдается тяжелое поражение ЦНС, в то время как при синдроме Шейе симптомы менее выражены и возникают значительно позднее, а когнитивные расстройства обычно отсутствуют [9]. Два варианта течения заболевания – тяжелый и более легкий – возможны и при МПС VI (синдроме Марото–Лами), обусловленном мутациями гена, кодирующего арилсульфатазу В.
В клинике им. Е.М. Тареева за последние 3 года были обследованы 5 взрослых пациентов в возрасте от 20 до 33 лет с МПС VI. У трех из них диагноз был установлен в подростковом возрасте (от 7 до 16 лет), а у двух – в возрасте 23 и 30 лет, соответственно. Необ хо димо подчеркнуть, что хотя у двух последних пациенток наблюдалось замедленное прогрессирование заболевания, тем не менее, в обоих случаях на момент госпитализации в клинику имелось тяжелое поражение опорно-двигательного аппарата с резким ограничением подвижности в суставах, пороки клапанов сердца, стеноз шейного отдела позвоночника, нарушение проходимости дыхательных путей, поражение органа зрения и др. Обе пациентки были низкого роста (132 и 146 см) [4].
Замедленное прогрессирование течение иногда на блюдается и при МПС II (синдроме Хантера). Два года назад в нашу клинику был госпитализирован 42-летний пациент с МПС II, который был диагностирован в возрасте 13 лет на основании характерных изменений внешнего вида и наличия синдрома Хантера у старшего брата и подтвержден при энзимологическом (дефицит активности идуронат-2-сульфатазы) и молекулярногенетическом (мутация с.236С>А гена IDS в гемизиготном состоянии) исследованиях [10]. В течение длительного времени состояние пациента оставалось удовлетворительным. Успешно закончил школу, а затем институт. Работал инженером на заводе. С 30-летнего возраста прогрессирующее снижение чувствительности и боли в кистях и стопах, ухудшение зрения и выпадение центральных полей зрения, однако продолжал работать. Резкое ухудшение состояния, связанное с развитием сердечной недостаточности на фоне тяжелого порока аортального клапана, было отмечено только за год до госпитализации, т.е. в возрасте около 40 лет.
При обращении к ревматологу на МПС может указывать поражение суставов, не сопровождающееся признаками воспаления, такими как припухание, повышение СОЭ и/или уровня С-реактивного белка [12]. T. Rocha Siqueira и соавт. измеряли экскрецию ГАГ с мочой у 55 пациентов в возрасте от 3 до 21 года (в среднем 9 лет) с невоспалительной артропатией неясного генеза. У всех больных определялись дискомфорт или боль в суставах, а у 2/3 – скованность [12]. Экскре ция ГАГ была повышена у 1 из 55 больных. При дополнительном обследовании у 15-летней пациентки был установлен диагноз МПС II. Хотя очевидным ограничением этого исследования было небольшое число обследованных пациентов, тем не менее, полученные данные указывают на возможную роль скрининга в диагностике более легких форм МПС.
Как заподозрить МПС?
В настоящее время известно 11 лизосомных ферментов, дефицит которых приводит к развитию 7 типов МПС [13]. Замедленное прогрессирование заболевания и более поздняя диагностика чаще отмечаются у пациентов с МПС I, IV, VI и VII, в то время как другие типы МПС обычно характеризуются тяжелым течением и более короткой продолжительностью жизни. Следует отметить, что в задачи практического врача не входит дифференциальная диагностика различных МПС – вполне достаточно заподозрить этот диагноз и направить пациента на консультацию к генетику и/или провести скрининговое исследование (определение экскреции ГАГ с мочой).
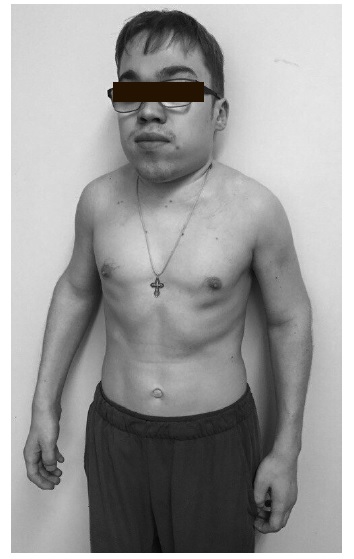
Рис. 1. Два брата с МПС II. Низкий рост, короткая шея, характерные черты лица, ограничение подвижности в плечевых суставах, пупочная грыжа
Хотя МПС представляют собой неоднородную группу болезней и отличаются по тяжести течения и частоте поражения центральной нервной системы, тем не менее, в целом клинические проявления некоторых из них достаточно однотипны и позволяют предположить наличие заболевания, особенно у пациентов старшего возраста при наличии типичного фенотипа. При осмотре пациентов с МПС прежде всего обращают на себя внимание низкий рост, непропорциональное строение скелета (короткие туловище и шея, длинные конечности), а также грубые черты лица, толстые губы, увеличение языка, запавшее переносье, увеличение расстояния между глазами (гипертелоризм) (рис. 1, 2). При тяжелом течении МПС рост пациентов не превышает 95-100 см, хотя при медленном развитии заболевания может достигать 140-150 см. Например, в нашей серии наблюдений рост 5 взрослых пациентов с МПС VI варьировался от 132 до 153 см, а рост 42-летнего пациента с МПС II составлял 158 см. В крупном исследовании среди 121 пациента с МПС VI доля взрослых составляла около 25% [14]. Средний рост больных в возрасте 19-24 и 25-56 лет равнялся 142,7±20,1 и 157,0±8,5 см, соответственно. Таким образом, по крайней мере у части больных МПС рост может быть фактически нормальным.
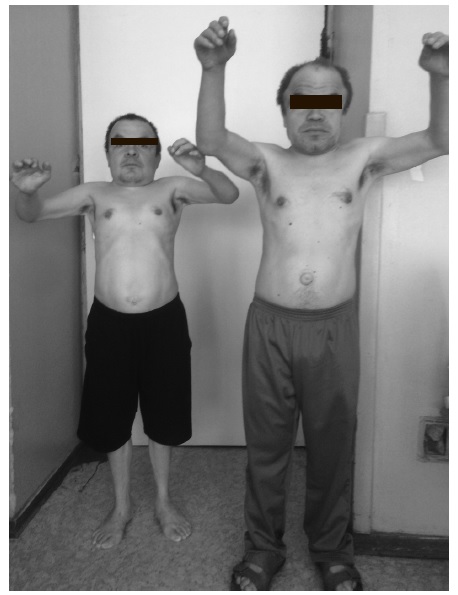
Рис. 2. ПациентсМПСVI
При всех МПС развивается тяжелое поражение опорно-двигательного аппарата (множественный дизостоз), которое проявляется тугоподвижностью и контрактурами суставов (в большей степени ухудшается разгибание), деформацией кистей (“когтистая лапа”) (рис. 3) и позвоночника (кифоз, сколиоз), воронкообразной грудной клеткой. Наблю даются недоразвитие таза, дисплазия головок бедренных костей и вальгусное положение шейки бедренной кости. Ограничение подвижности суставов отмечается уже в детском или подростковом возрасте, постепенно нарастает и в конечном итоге служит причиной инвалидизации больных.
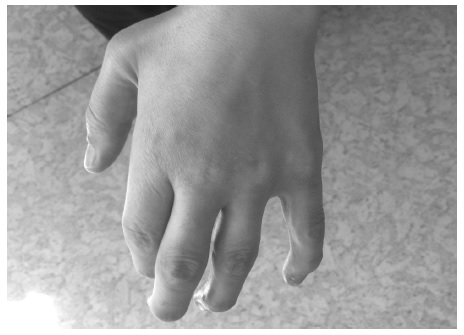
Рис. 3. Характерныеизменениякистиупациента с МПС III
Для МПС IV (синдрома Моркио), в отличие от других типов МПС, типично развитие гипермобильности суставов, обусловленной деформацией метафизов, гипоплазией костей и деградацией соединительной ткани, окружающей суставы [15].
У пациентов с МПС часто наблюдаются обструкция глотки, верхних и нижних дыхательных путей, связанная с увеличением языка и миндалин, сужением трахеи, утолщением надгортанника и голосовых связок, отложением ГАГ в слизистой оболочке бронхов. Обструкция дыхательных путей сопровождается затрудненным дыханием и громким храпом с эпизодами апноэ во время сна. Характерно развитие рецидивирующего среднего отита, вызывающего прогрессирующую тухоугость, которая обусловлена как кондуктивными, так и нейросенсорными механизмами. Причинами нарушения функции дыхания могут быть также небольшие размеры и малоподвижность грудной клетки, растя жение живота в сочетании с кифозом, сколиозом и значительным поясничным лордозом, а также рецидивирующие инфекции нижних дыхательных путей.
Еще одно типичное проявление МПС – поражение клапанов сердца, частота которого достигает 60-90%. С. Wippermann и соавт. обследовали 84 больных в возрасте от 1 до 47 лет с различными типами МПС [16]. Частота недостаточности митрального и/или аортального клапана составила 75,0%, однако тяжелая митральная или аортальная регургитация наблюдалась только в 4,8% и 8,3% случаев, соответственно. Частота пороков клапанов сердца достигала 89-100% у больных МПС I, II и VI, но была ниже у пациентов с МПС III и IV – 3366%. В другом исследовании у 28 больных МПС VI частота поражения митрального клапана составила 96%, трикуспидального – 71% и аортального – 43% [17]. Следует отметить, что, в отличие от некоторых других лизосомных болезней накопления, таких как болезнь Фабри, для МПС не характерно тяжелое поражение миокарда.
У большинства больных МПС I, VI и VII часто отмечается помутнение роговицы, в то время как при других типах МПС оно отсутствует [18].
У пациентов с тяжелыми формами МПС I и II наб лю дается поражение ЦНС (поведенческие расстрои ̆ства, задержка умственного развития, ухудшение интеллекта, тяжелая когнитивная дисфункция) [10]. Выраженные неврологические и когнитивные расстройства характерны также для МПС III. В то же время у большинства пациентов с МПС VI сохраняется нормальный интеллект.
МПС I, II и VI могут привести к развитию синдрома запястного канала, проявляющегося стойкой болью и онемением пальцев кисти в результате сдавления срединного нерва между костями и сухожилиями мышц запястья. Возможно также сдавление спинного мозга вследствие сужения спинно-мозгового канала и нестабильности атлантоаксиального канала. Компрессион ная миелопатия может осложниться слабостью в нижних конечностях и спастической параплегией или квадриплегией.
Диагноз и дифференциальный диагноз
Алгоритм диагностики и дифференциальной диагностики МПС у пациентов с поражением опорно-двигательного аппарата представлен на рис. 4 [19]. Если контрактуры суставов определяются у новорожденного ребенка, то наиболее вероятен диагноз артрогрипоза – заболевания, характеризующегося врожденными контрактурами двух и более суставов несмежных областей в сочетании с мышечной гипо- или атрофией. Различают артрогрипоз с поражением верхних и/или нижних конечностей, генерализованный и дистальный варианты. Артрогрипоз – это не самостоятельная нозологическая форма, а скорее физический симптом, который может быть обусловлен различными причинами, например, ограничением движений плода во время его развития (многоводие, маловодие, пороки развития и опухоли матки, многоплодная беременность), нарушением развития мышц (вирусные инфекции), генетическими факторами и др.
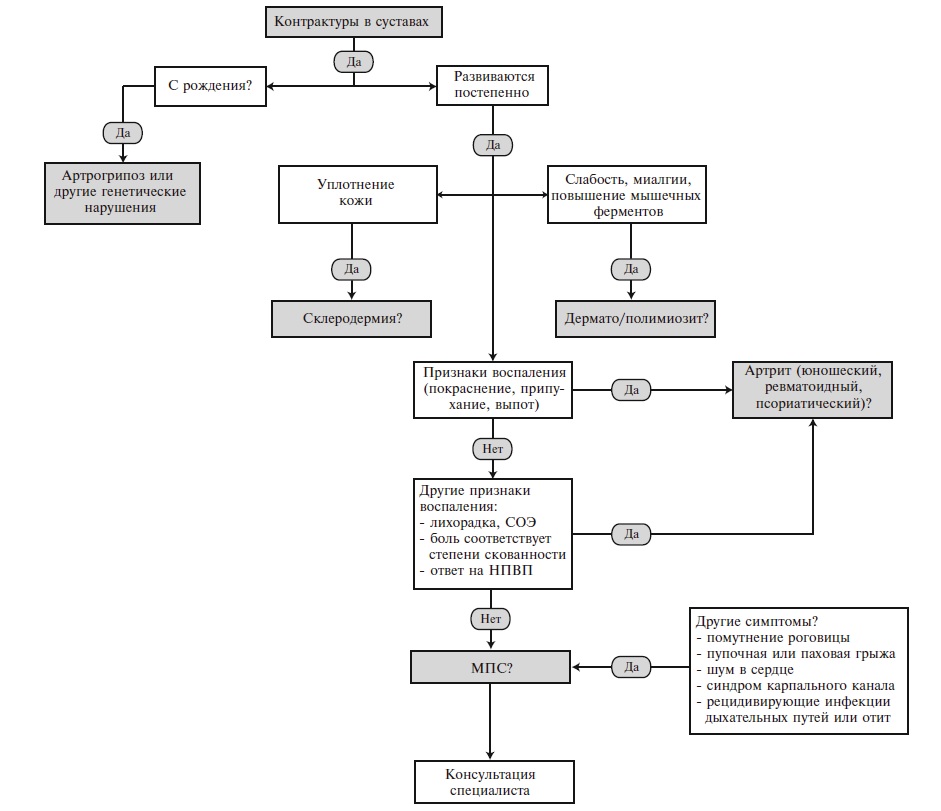
Рис. 4. Алгоритм дифференциальной диагностики у пациентов с тугоподвижностью/контрактурами суставов
Боли и тугоподвижность суставов, появляющиеся в детском или подростковом возрасте, могут имитировать ревматические заболевания, в частности юношеский идиопатический артрит, ревматоидный или псориатический артрит. Основное значение для дифференциальной диагностики с этими заболеваниями имеют отсутствие воспалительной боли (т.е. боли, возникающей по утрам и сопровождающейся скованностью, которая уменьшается на фоне физической активности), локальных (припухание и болезненность при пальпации суставов) и системных (повышение температуры тела и/или СОЭ и уровня С-реактивного белка) признаков воспаления (рис. 4) [19]. Глюкокортикостероиды неэффективны, хотя нестероидные противовоспалительные препараты могут несколько уменьшить имеющиеся симптомы.
Признаки поражения суставов, появляющиеся в более старшем возрасте, часто расценивают как первичный остеоартроз. Дифференцировать поражение опорно-двигательного аппарата при МПС с этим забо леванием позволяют развитие артропатии в подростковом или молодом возрасте при отсутствии факторов риска первичного остеоартроза и наличие других типичных проявлений генетического заболевания (карликовый рост, измененные черты лица, порок клапана сердца, помутнение роговицы и т.п.) (табл. 3).
ТАБЛИЦА 3. Симптомы, позволяющие заподозрить МПС [19]
Поражение опорно-двигательного аппарата Контрактуры суставов, развивающиеся в раннем возрасте и не сопровождающиеся признаками воспаления или эрозивными изменениями костей “Когтистая лапа” Деформация позвоночника (сколиоз, кифоз, лордоз) Рентгенологические признаки множественного дизостоза Другие клинические проявления Нарастающая “грубость” черт лица Помутнение роговицы Короткая ригидная шея Частые респираторные инфекции, рецидивирующий средний отит, заложенность носа, шумное дыхание/храп Шум в сердце Пупочные и/или паховые грыжи Низкий рост Нарушение походки Увеличение живота за счет печени и селезенки Скрининговым методом диагностики МПС является измерение экскреции ГАГ с мочой. Определение типа ГАГ в моче (дерматансульфат, гепарансульфат, хондороитинсульфат и кератансульфат) с помощью тонкослойной хроматографии или электрофореза имеет определенное значение для дифференциальной диагностики МПС, однако результаты этих исследований все же не позволяют установить окончательный диагноз. Экскреция ГАГ с мочой у детей, подростков и молодых людей с МПС обычно превышает таковую у здоровых людей сопоставимого возраста [13]. Однако у взрослых людей с МПС, особенно с более легкими и медленно прогрессирующими формами заболевания, она может оказаться близкой к норме. Соответственно, следует осторожно интерпретировать результаты этих тестов и продолжать обследование, если диагноз МПС представляется вероятным на основании клинических данных.
Следующий этап диагностики – определение активности лизосомных ферментов в высушенных пятнах крови, лейкоцитах или фибробластах. Анализ высушенных пятен крови обычно проводят в тех случаях, когда образец необходимо отправить в лабораторию, находящуюся в другом городе или стране. Более надежным считают исследование лейкоцитов, выделенных из цельной крови, или культивированных фибробластов.
Для подтверждения диагноза проводят молекулярногенетическое исследование, которое необходимо также для выявления носителей мутантных генов и пренатальной диагностики.
Лечение мукополисахаридозов
Для патогенетической терапии МПС применяют рекомбинантные формы ферментов, дефицит которых лежит в основе развития соответствующего заболевания, в том числе ларонидазу для лечения МПС I, идурсульфазу – МПС II, галсульфазу – МПС VI, элосульфазу альфа – МПС IVa (в Российской Федерации последний препарат не зарегистрирован). Все препараты предназначены для внутривенного введения. Их эффективность и безопасность установлены как в рандомизированных, двойных слепых, плацебо-контролируемых исследованиях, так и длительных наб людательных исследованиях, позволивших изучить отдаленные эффекы ФЗТ [20].
Эффективность и безопасность галсульфазы оценивали в рандомизированном, двойном слепом, плацебоконтролируемом, 24-недельном исследовании 3 фазы у 39 больных МПС VI [21]. Критериями эффективности были толерантность к физической нагрузке и экскреция ГАГ с мочой. Лечение галсульфазой в течение 24 недель по сравнению с плацебо привело к значительному увеличению пройденной за 12 минут дистанции (р=0,025) и скорости подъема по лестнице (р=0,053) и достоверному снижению экскреции ГАГ с мочой (p<0,001).
P. Harmatz и соавт. изучали эффективность длительной терапии галсульфазой (97-260 недель) у 56 пациентов (средний возраст 12 лет; от 5 до 29 лет) с МПС VI, которые принимали участие в трех клинических исследованиях [22]. Экскреция ГАГ с мочой достоверно снизилась после начала лечения галсульфазой, а дос тиг нутый эффект сохранялся в отдаленном периоде. К концу наблюдения средняя степень снижения экскреции ГАГ составила от 71% до 79%. У подавляющего большинства пациентов (84-89%) наблюдалось стойкое увеличение толерантности к физической нагрузке, которую оценивали на основании пройденной за 6 или 12 минут дистанции и скорости подъема по лестнице. Переносимость ФЗТ была хорошей. Доля завершенных инфузий галсульфазы составила 98%. Лечение было прекращено только у 3 пациентов (один из группы плацебо). Нежелательные явления отмечались у всех пациентов, однако чаще всего были легкими или умеренно выраженными и не связанными с исследуемым препаратом.
R. Giugliani и соавт. проанализировали результаты 10-летнего наблюдения 117 пациентов с МПС VI [23]. У 55 больных проводилась ФЗТ галсульфазой в среднем в течение 6,8±2,2 лет. Через 10 лет экскреция ГАГ с мочой снизилась в среднем на 87,9%. Средний рост увеличился на 20,4±12,4 и 16,8±6,3 см у пациентов, которые начали лечение в возрасте 4-7 лет и 8-12 лет, соответственно. У пациентов, которые завершили 6-минутную пробу, пройденная дистанция увеличилась на 65,7±100,6 м, а форсированная жизненная емкость легких (ФЖЕЛ) и объем форсированного выдоха за 1 с (ОФВ1) – на 29% и 18%, соответственно. С помощью метода Каплана-Мейера было показано, что лечение галсульфазой приводит к значительному увеличению выживаемости больных МПС VI. Сходные данные были получены с помощью модели пропорционального риска Кокса. Таким образом, результаты исследования показали, что длительная терапия галсульфазой не только улучшает рост, толерантность к физической нагрузке и показатели функции легких, но и увеличивает выживаемость больных МПС VI.
Эффективность и безопасность идурсульфазы были установлены в двойном слепом, рандомизированном, плацебо-контролируемом исследовании у 96 больных в возрасте от 5 до 31 года с МПС II [24]. Первичным критерием эффективности была комбинированная конечная точка, включавшая в себя пройденную за 6 минут дистанцию и ФЖЕЛ в процентах от должной. По этому показателю через 1 год идурсульфаза достоверно превосходила плацебо. Кроме того, ФЗТ привела к достоверному увеличению объема движений в локтевом суставе, пройденной за 6 минут дистанции и ФЖЕЛ, а также достоверному уменьшению размеров печени и селезенки. Экскреция ГАГ с мочой достоверно снизилась по сравнению с плацебо. При продолжении лечения открытым методом в течение еще 2 лет были отмечены дальнейшее увеличение ФЖЕЛ и нормализация экскреции ГАГ [25]. Значительное увеличение роста при лечении идурсульфазой было выявлено при ретроспективном анализе результатов терапии у больных, включенных в регистр Hunter Outcome Survey [26].
Эффективность и безопасность ларонидазы (0,58 мг/кг/нед) изучались в 26-недельном рандомизированном, двойном слепом, плацебо-контролируемом исследовании у 45 больных МПС I [27]. Лечение ларонидазой по сравнению с плацебо привело к достоверному увеличению медианы ФЖЕЛ (р=0,009) и пройденной за 6 минут дистанции (р=0,039), а также уменьшению размеров печени и экскреции ГАГ с мочой, а у пациентов с более тяжелой формой заболева ния – к уменьшению апноэ во время сна и увеличению объема движения в плечевых суставах. Эффективность препарата была также подтверждена при мета-анализе 4 исследований, которые показали, что препарат вызывает уменьшение экскреции ГАГ с мочой, гепатомегалии и индекса массы левого желудочка и улучшение объема движений в суставах у больных МПС I [28].
Заключение
МПС – это группа редких заболеваний, которые обычно диагностируют поздно вследствие низкой информированности врачей о лизосомных болезнях накопления. Наибольшие диагностические трудности возникают при более легких формах МПС, которые характеризуются медленным развитием соматических проявлений и стертостью типичных внешних признаков. Выделение легких, или ослабленных (attenuated), форм МПС весьма условно, так как в конечном итоге у таких больных развиваются инвалидизирующие осложения, часто требующие оперативного лечения. Одним из типичных симптомов МПС I, II и VI является нарастающая тугоподвижность в суставах, поэтому такие больные могут обращаться за помощью к ревматологам. Особенность поражения опорно-двигательного аппарата при МПС – отсутствие локальных (припухания суставов и болезненности при их пальпации) и системных (повышения температуры тела и/или СОЭ и уровня С-реактивного белка) признаков воспаления. Исключить остеоартроз позволяют молодой возраст пациента и отсутствие типичных факторов риска дегенеративных заболеваний суставов. Важное диагностическое значение имеют системные проявления, такие как пупочная и паховая грыжа, изменение черт лица, помутнение роговицы, низкий рост, увеличение печени и селезенки, рецидивирующие инфекции дыхательных путей и средний отит и др. Если заподозрен диагноз МПС, то необходимо определить экскрецию ГАГ с мочой, а также измерить активность лизосомных ферментов и провести молекулярно-генетическое исследование для подтверждения диагноза.
Мукополисахаридоз — симптомы и лечение
Что такое мукополисахаридоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Боровиковой Ольги Игоревны, генетика со стажем в 8 лет.
Над статьей доктора Боровиковой Ольги Игоревны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Мукополисахаридозы — это группа редких наследственных заболеваний соединительной ткани, связанных с нарушением обмена веществ. Они обусловлены нехваткой определённых ферментов, которые участвуют в переработке (расщеплении) гликозаминогликанов — сложных молекул сахара. В связи с чем эти молекулы скапливаются в организме человека в опасно большом количестве и приводят к различным изменениям [1] [14] .
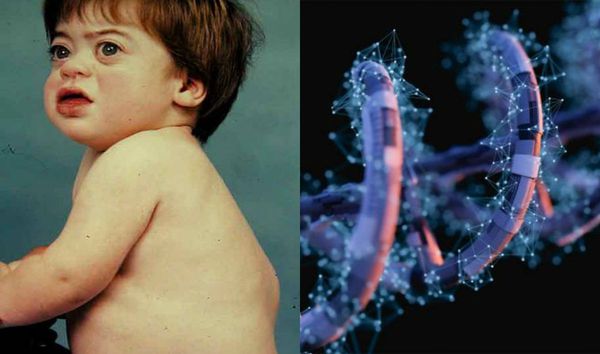
Самые явные проявления мукополисахаридозов — множественные деформации костей и суставов и нарушение физического развития (задержка и утеря ранее приобретённых навыков. При определённых типах заболевания (синдромах Шейе, Гурлер — Шейе, Хантера, Санфилиппо — I, II, III типах мукополисахаридозов) помимо прочего нарушается умственное развитие, начиная с лёгких когнитивных нарушений и заканчивая глубокой деменцией [13] .
Изменения при мукополисахаридозах возникают в результате дефекта ферментного расщепления углеводной части молекулы мукополисахаридов (гликозаминогликанов). При этом в фибробластах и мезенхимальных клетках, которые способны трансформироваться в хрящевые, костные либо жировые клетки, накапливается хондроитинсульфат — вещество, являющееся основой хрящей. Это ведёт к нарушению структуры соединительной, костной и хрящевой ткани [13] .
Мукополисахаридозы встречаются очень редко: примерно у одного ребёнка среди 56-325 тысяч новорождённых. Их причиной является мутация . Эти болезни довольно сложно диагностировать из-за малой осведомлённости врачей о них. Поэтому больным часто выставляют другие диагнозы и проводят неадекватное лечение.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы мукополисахаридоза
Мукополисахаридозы делятся на несколько типов. Они различаются первичным генным дефектом, патологическим ферментом, преимущественным поражением той или иной системы органов и тканей, возрастом начала заболевания и тяжестью его течения (см. классификацию ). В целом при этих генетических патологиях встречаются множественные нарушения: поражаются костная система, хрящи, печень, селезёнка, головной мозг, роговица глаза, органы лимфатической и дыхательной системы. Из-за особенностей строения дыхательных путей возникают частые инфекционные заболевания органов дыхания и слуха, что приводит к развитию тугоухости и респираторным расстройствам — бронхитам, пневмониям и др.
К самым частым проявлениям мукополисахаридозов относят низкорослость, волосатость и нарушения развития. Они дают о себе знать с раннего детства. Лицо ребёнка, как правило, приобретает грубые черты, становится «взрослым», а голова выглядит довольно большой из-за широкого лба и короткого носа. Губы и язык тоже становятся больше, чем у сверстников. Суставы пальцев плохо гнутся и двигаются. При отдельных типах заболевания нарушается слух и зрение, повреждаются сердечные клапаны и артерии [14] .
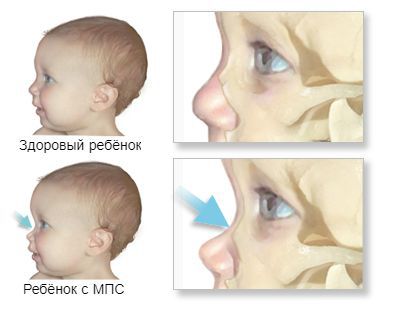
Патогенез мукополисахаридоза
Все формы мукополисахаридоза наследуются по аутосомно-рецессивному типу, т. е. мутировавший ген должен быть у обоих родителей. Исключением является мукополисахаридоз III типа: он наследуется по Х-сцепленному рецессивному типу.
Каждая форма мукополисахаридоза отличается нарушением выработки различных ферментов, что приводит к изменению функции фермента, его нехватке или отсутствию. В результате этого нарушается ферментозависимый распад гликозаминогликанов: из-за нехватки определённых ферментов организм не в состоянии преобразовывать и сохранять эти полисахариды в тканях. Нерасщеплённые гликозаминогликаны через кровь распространяются по всему организму, что приводит к их избыточному накоплению в различных органах и системах [14] . Чаще всего эти вещества скапливаются в соединительной ткани, сердце, печени, селезёнке, нервной ткани и оболочках мозга:
- Отложение гликозаминогликанов в оболочках мозга способствует сужению субарахноидальных пространств, которые находятся под паутинной оболочкой головного мозга, и формированию гидроцефалии .
- Поражение нервных клеток приводит к задержке умственного развития, прогрессирующей деменции.
- Деформация метафизов (отделов трубчатых костей), утолщение межсуставных хрящей и суставных связок становятся причинами нарушения подвижности в суставах.
- В результате отложения гликозаминогликанов в миндалинах, трахее и голосовых связках возникает отёчность верхних дыхательных путей, нарушается дыхание, что приводит к нарушению вентиляции, частым респираторным заболеваниям, отитам, обструктивным состояниям (непроходимости дыхательных путей).
- Отложение гликозаминогликанов в тканях сердца сопровождается кардиомиопатиями и формированием клапанных пороков сердца.
- Повреждение канальцев почек может приводить к прогрессирующей артериальной гипертензии.
Классификация и стадии развития мукополисахаридоза
В зависимости от первичного генетического дефекта выделяют несколько типов мукополисахаридоза:
- МПС I типа включает в себя несколько подтипов: синдром Гурлер (H), Шейе (S) и Гурлер — Шейе (H/S) [6][7] . Мутация при данных фенотипах обнаруживается в гене IDUA, вызывает дефицит фермента альфа-L-идуронидазы [4] .
- МПС II типа — синдром Хантера [8] . Мутация при данном заболевании обнаруживается в гене IDS, вызывает дефицит либо отсутствие идуронат-2-сульфатазы, либо дефицит или отсутствие сульфоидуронат сульфатазы [5] .
- МПС III типа — синдром Санфилиппо — и меет несколько подтипов:
- МПС III А обусловлен мутацией в гене SGSH, приводит к нехватке гепаран-N-сульфатазы [9] ;
- МПС III В обусловлен мутацией в гене NAGLU, вызывает дефицит N-ацетил-α-D-глюкозаминидазы [10] ;
- МПС III С обусловлен мутацией в гене HGSNAT, вызывает дефицит гепаран-α-глюкозаминид-N-ацетилтрансферазы [11] ;
- МПС III D обусловлен мутацией в гене GNS, вызывает дефицит N-ацетилглюкозамин-6-сульфатазы [2][12] .
- МПС IV типа — синдром Моркио — делится на два подтипа:
- МПС IV А связан с мутацией в гене GALNS, вызывает дефицит галактозамин-6-сульфатазы;
- МПС IV В связан с мутацией в гене GLB1, вызывает недостаточность β-галактозидазы.
- МПС VI типа — синдром Марото — Лами — связан с мутацией гена ARSB, вызывает дефицит N-ацетилгалактозамин-4-сульфатазы [3] .
- МПС VII типа — синдром Слая — возникает вследствие мутации гена GUSB, приводит к дефициту β-глюкуронидазы.
- МПС IX типа является проявлением мутации гена HYAL1, приводит к недостаточности гиалуронидазы.
Остановимся подробнее на каждом типе мукополисахаридоза.
Мукополисахаридоз I H (синдром Гурлер). Основными симптомами заболевания являются: задержка психического и физического развития, умственная отсталость, грубые черты лица, пороки клапанов сердца, помутнение роговицы, низкорослость, тугоподвижность суставов. Первые признаки такого мукополисахаридоза появляются в течение первых 12 месяцев жизни младенца.
Иногда уже с самого рождения отмечается увеличение печени и селезёнки (гепатомегалия), пупочные или пахово-мошоночные грыжи. Ближе к 6-12 месяцам лицо приобретает грубые черты, напоминающие гаргулью: голова становится больше, выступают лобные бугры, появляются широкие скулы, уплощается и втягивается переносица, укорачиваются носовые ходы, изменяется форма носа, ноздри выворачиваются, рот постоянно полуоткрыт, увеличивается язык, губы становятся пухлыми. Низкорослость становится заметной ближе к 2-5 годам, рост обычно ниже 100 см. Пропорции тела нарушены, шея укорочена [3] .
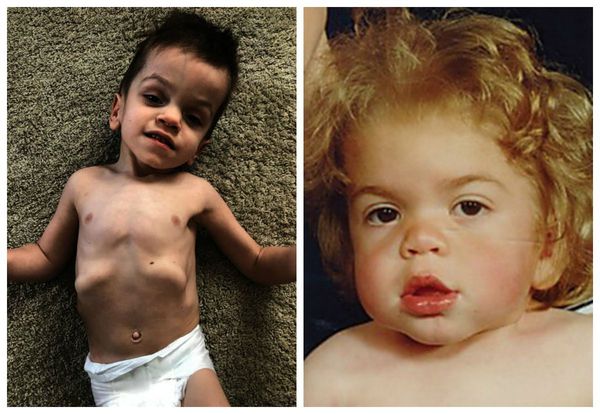
Очень часто у таких пациентов уменьшается подвижность крупных и мелких суставов, особенно пальцев, укорачиваются трубчатые кости, кисти рук деформируются и приобретают форму «лапы с когтями» [1] . Уменьшаются головки бедренных костей, из-за чего формируется дисплазия тазобедренных суставов. Подвздошные кости приобретают треугольную форму.
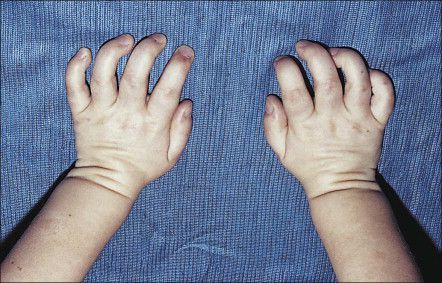
С развитием болезни к клинической картине присоединяются признаки поражения внутренних органов, сердца и сосудов, головного мозга, нервной системы.
Со стороны сердечно-сосудистой системы утолщаются клапаны, уменьшается диаметр артерий, нарушается сократимость сердечной мышцы, возникают кардиомиопатии, повышается артериальное давление. В итоге развивается сердечная недостаточность .
Основными проявлениями вовлечения нервной системы являются прогрессирующее снижение умственных способностей, задержка лингвистического (языкового) развития, гипотония мышц, снижение сухожильных рефлексов, патология черепно-мозговых нервов, снижение слуха [6] . Психическое и моторное развитие запаздывает, достигает максимального развития на уровне 2-4 лет, после чего останавливается и регрессирует, иногда переходя в полную деменцию. Ухудшает ситуацию прогрессирующая гидроцефалия [1] .
Поведение пациентов с синдромом Гурлер страдает из-за когнитивных нарушений, прогрессирующей тугоухости, бессонницы, связанной с ночной обструктивной задержкой дыхания . Со временем ребёнок становится всё активнее, развивается синдром дефицита внимания , агрессия, расстройства аутистического спектра.
При деформации позвоночника, утолщении оболочек спинного мозга изменяется походка, возникает мышечная гипотония, нарушается чувство равновесия, отмечается непроизвольное мочеиспускание и задержка мочи. При тяжёлом течении заболевания возможны судороги, требующие применения антиконвульсантов.
В возрасте 5-10 лет и старше часто развивается синдром запястного канала . Данное состояние требует обязательной коррекции, в противном случае развиваются контрактуры дистальных межфаланговых суставов, пальцы теряют чувствительность, наступает парез мышц большого пальца.
Скопление полисахаридов в глоточном лимфоидном кольце, надгортаннике и трахее является причиной сужения дыхательных путей, развития обструктивных состояний, рецидивирующих инфекций дыхательных путей и среднего уха.
Для больных мукополисахаридозом I типа также характерно поражение глаз в виде прогрессирующего помутнения роговицы, пигментной дегенерации и повышения внутриглазного давления [1] .
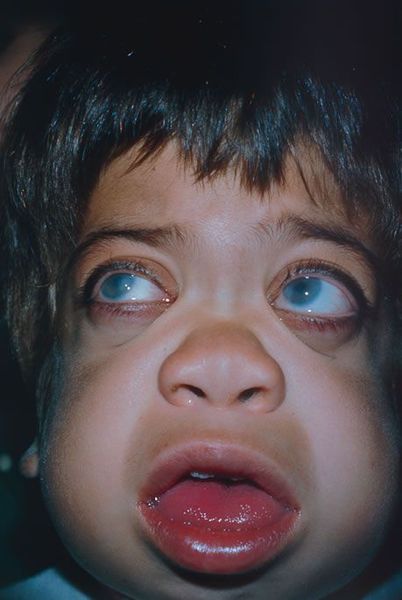
Средняя продолжительность жизни детей с синдромом Гурлер достигает 10 лет. Частой причиной смерти становятся обструктивные заболевания дыхательной системы, острые и хронические инфекционные процессы, патология сердечно-сосудистой системы.
Мукополисахаридоз I H/S (синдром Гурлер — Шейе) является среднетяжёлой формой заболевания. К самым частым симптомам относятся нарушение движения в суставах, снижение прозрачности роговицы и низкий рост [7] .
Первые признаки проявляются к 3-8 годам. Из-за преждевременного сращения черепных швов изменяется форма черепа и нарушается рост головного мозга. Переносица уплощается и западает, губы становятся пухлыми, верхняя челюсть становится меньше, повышается оволосение, кожа утолщается.
Как правило, в течение первых 12 месяцев жизни рост нормальный, но по мере взросления скорости роста снижается и развивается низкорослость. Пропорции тела нарушаются [1] . Суставы становятся тугоподвижными, нарушается форма костей, деформируется грудная клетка, возникает кифоз, сколиоз позвоночника.
С возрастом увеличиваются миндалины, рецидивируют респираторные заболевания, воспаления среднего уха, нарушается проходимость дыхательных путей. Со стороны глаз поражается роговица: происходит её помутнение из-за накопления гликозаминогликанов [7] . Нарушение мозга сопровождается задержкой психического, моторного, лингвистического развития, в исходе развивается деменция. Отмечается гидроцефалия, пахименингит в верхних отделах позвоночника, что приводит к компрессии спинного мозга, развитию патологии в нижележащих отделах [1] . Развивается синдром запястного канала, являющийся причиной контрактур суставов. Со стороны сердечно-сосудистой системы развиваются клапанные аномалии за счёт утолщения створок, нарушение сократимости сердечной мышцы. Увеличение печени и селезенки приводит к диспропорциональному увеличению живота. Патология передней брюшной стенки проявляется пахово-мошоночными грыжами, широким пупочным кольцом с образованием грыж [6] .
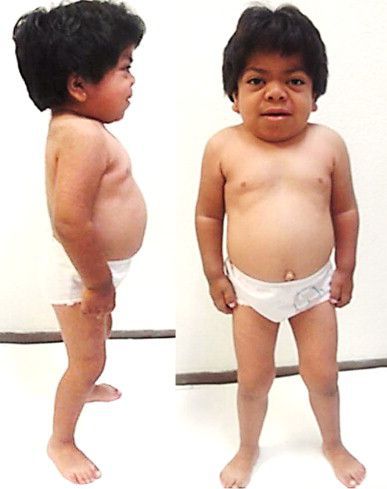
Мукополисахаридоз I S (синдром Шейе, или болезнь Гурлер с поздним началом) — лёгкая форма заболевания. Отличается стёртой клинической картиной. Грубые черты лица, напоминающие гаргулью, также присутствуют, но в более лёгкой степени, чем при синдроме Гурлер. Интеллект, психическое и моторное развитие, как правило, в пределах нормы. Иногда наблюдается незначительное запаздывание развития.
Основными клиническими проявлениями являются поражения суставов, сопровождающиеся нарушением их функции, и отставание в росте [1] . Поражение костей и суставов приводит к тугоподвижности конечностей, болевому синдрому, деформации кистей по типу «лапы с когтями», «пустой стопы», вальгусу в коленных суставах (Х-образным голеням), тоннельный синдром способствует развитию контрактур.
Характерны увеличение печени, селезёнки, образование пахово-мошоночных грыж, слабости пупочного кольца [1] , болезни органов слуха и рецидивирующие инфекционные заболевания органов дыхательной системы, которые приводят к приступам ночного апноэ. Зрение страдает из-за неравномерного помутнения роговицы, повышения внутриглазного давления, пигментной дегенерации сетчатки, что более характерно для больных старше 30 лет.
Часто формируется компрессия срединного нерва, что приводит к развитию карпального туннельного синдрома, связанного со сдавлением срединного нерва между костями, мышцами и связками запястья. Клапанные пороки сердца, расширения аорты могут быть причиной развития сердечной недостаточности.
Мукополисахаридоз II типа (синдром Хантера) бывает тяжёлой и умеренно тяжёлой формы. Такое разделение основано на степени поражения нервной системы и возрасте, в котором проявляются первые признаки болезни.
Синдром Хантера включает в себя множество различных признаков с поражением различных органов и систем [8] . Основу клинической картины составляют нарушения центральной нервной системы, проявляющиеся задержкой умственного развития, огрубление черт лица, низкорослость, нарушение подвижности суставов.
Большинство симптомов схожи с I типом болезни: грубые черты лица, напоминающие гаргулью, увеличенная мозговая часть черепа, выступающий лоб, уплощённая запавшая переносица, плоский нос с укороченными носовыми ходами, выворачивающиеся ноздри, приоткрытый рот, увеличенный язык, толстые губы, низкий рост, укороченная шея, тугоподвижность суставов, повышенное оволосение, пахово-мошоночные и пупочные грыжи. Отличается запоздалым прорезыванием зубов, длинными густыми ресницами, широкими густыми сросшимися бровями [8] . При прогрессировании заболевания волосы осветляются и выпрямляются, становятся сухими и жёсткими.
Для синдрома Хантера характерна сыпь в виде мелких узелков, группирующихся на спине, плечах и бёдрах. Её появление связано со скоплением мукополисахаридов в дерме.
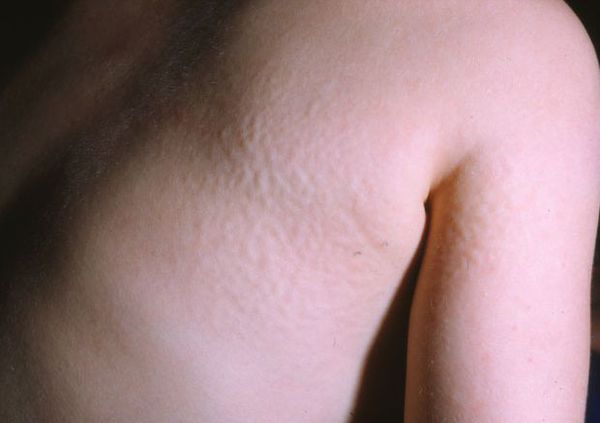
За счёт укорочения и расширения пястных костей, развития пястного тонельного синдрома кисть приобретает когтистую форму. По мере прогрессирования заболевания формируется кифосколиоз, деформируются тазобедренные суставы, возникают различные костные аномалии, увеличивается размер турецкого седла — углубления в клиновидной кости черепа.
Рецидивирующие инфекции органов дыхания и слуха, увеличение миндалин приводят к тугоухости, апноэ во сне. Поражение глаз проявляется помутнением роговицы (реже, чем при других типах болезни), пигментной дегенерацией сетчатки, а при тяжёлых формах происходит дистрофия сетчатки и отёк диска. При развитии внутричерепной гипертензии наблюдается отёк зрительного нерва.
Психическое развитие начинает отставать в возрасте 1,5-3 лет. При тяжёлых формах заболевания к 8-10 годам появляется тяжёлая умственная отсталость и эпилепсия, которая трудно поддаётся лечению. Иногда формируется сообщающаяся гидроцефалия, парезы, потеря чувствительности в конечностях. Известны случаи сдавления спинного мозга, связанные с увеличением толщины оболочек, нестабильностью атлантоаксиального сустава (между затылочной костью и первым шейным позвонком). Это приводит к мышечной слабости, недержанию мочи, задержке мочеиспускания и неуклюжести [6] . Из-за поражения ствола головного мозга нарушается глотание и подвижность нижней челюсти. Возможны псевдобульбарные и бульбарные параличи (связанные с поражением продолговатого мозга).
Большую трудность представляют поведенческие нарушения: гиперактивность, агрессия, упрямство. Часто ухудшают ситуацию проблемы со сном, нарушения слуха. Со временем присоединяются расстройства аутистического спектра. Эти состояния трудно поддаются коррекции. При тяжёлом течении заболевания развивается деменция.
Поражение сердечно-сосудистой системы проявляется клапанными пороками сердца, кардиомиопатией.
С раннего детского возраста отмечается увеличение печени и селезёнки, нарушение переваривания пищи и моторики кишечника. Увеличение языка и поражение височно-нижнечелюстного сустава приводят к нарушению глотания.
Мукополисахаридоз III типа (синдром Санфилиппо) отличается от других тем, что при нём гликозаминогликаны скапливаются по большей части в тканях мозга, а не в соединительной ткани. Самые яркие клинические признаки: задержка психического развития, маловыраженное поражение суставов, лёгкое огрубление черт лица [2] .
Первые проявления возникают на втором году жизни: низкорослость, умеренная тугоподвижность суставов, увеличение печени и селезёнки [9] . До 3 лет дети обычно развиваются в пределах нормы, а затем утрачиваются ранее приобретённые моторные и речевые навыки, нарушается психическое развитие. В дальнейшем возникает нарушение поведения, грубое нарушение психики, переходящее в деменцию. Речь, как правило, не формируется.
Характерны черепно-лицевые изменения: увеличенные лобные бугры, низкие надбровные дуги, широкая спинка носа, густые сросшиеся брови, густые ресницы, сухие и жёсткие волосы, повышенное оволосение [2] .
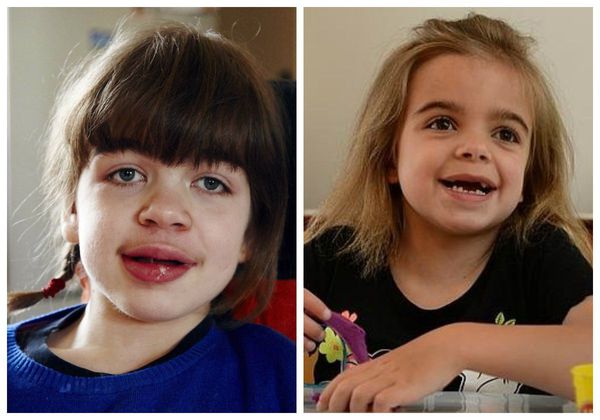
Мукополисахаридоз IV типа (синдром Моркио) сопровождается значительными деформациями костной системы, которые затрагивают в основном руки, ноги и грудную клетку.
В первые месяцы жизни ребёнка признаки заболевания отсутствуют, клиническая картина проявляется только в возрасте 1-3 лет. К 7-8 годам симптомы болезни становятся наиболее яркими. Характерна низкорослость, задержка физического развития. Кожа толстая, малоэластичная. Лицевые признаки: широкий рот, укороченный нос, редкие зубы, дисплазия эмали зубов.
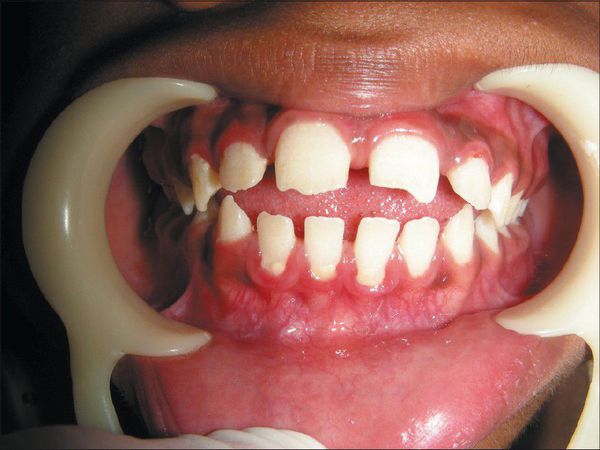
Мышцы гипотоничны, грудная клетка деформирована, отмечается кифосколиоз грудного и поясничного отделов позвоночника. Интеллект не страдает [3] . Суставы тугоподвижны, нередко развиваются контрактуры. Часто появляется шейная миелопатия — поражение волокон спинного мозга с нарушением проведения нервного импульса. Иногда развивается тугоухость. Отмечается слабость апоневроза передней брюшной стенки с образованием грыж [3] .
Мукополисахаридоз VI типа (синдром Марото — Лами) имеет разнообразные проявления, которые прогрессируют с разной скоростью. Характерна низкорослость, снижение зрения, грубые черты лица, тугоухость, снижение подвижности суставов, увеличение печени и селезёнки, поражение сердечно-сосудистой системы и органов дыхания. Интеллект, как правило, в пределах нормы.
Черты лица напоминают гаргулью. Нарушены пропорции тела, формируется карликовость. Суставы деформированы, множественные деформации костей приводят к инвалидизации. Отмечается нарушение развития тел грудных позвонков, их переломы при незначительной нагрузке. Часто возникает сдавление спинного мозга, связанное с нестабильностью шейного отдела позвоночника. Иногда развиваются клапанные пороки сердца, приводящие с сердечной недостаточности. Со стороны желудочно-кишечной системы наблюдается синдром раздражённого кишечника, увеличение печени и селезёнки.
Мукополисахаридоз VII типа (синдром Слая) проявляется увеличением печени и селезёнки, образованием пахово-мошоночных или пупочных грыж, низкорослостью, деформацией грудной клетки, кифосколиозом в поясничном и крестцовом отделах позвоночника, искривлением нижних конечностей, рецидивирующими респираторными заболеваниями, грубыми чертами лица с широко расставленными глазами, уплощённой переносицей и вывернутыми вперёд ноздрями. Иногда наблюдаются клапанные пороки сердца и кардиомиопатия.
Осложнения мукополисахаридоза
Основными осложнениями течения мукополисахаридозов различных типов являются тяжёлые рецидивирующие респираторные инфекции (риниты, синуситы, отиты, ОРЗ), приводящие к дыхательной недостаточности, патология сердечно-сосудистой системы и поражение головного мозга.
Сам мукополисахаридоз не приводит к смерти. Больные чаще всего умирают в результате сердечной и дыхательной недостаточности, которые развиваются на фоне заболевания [5] .
Диагностика мукополисахаридоза
Диагностика основана на определении характерных клинических (внешних) признаков и изучении активности гликозаминогликанов в крови. Последнее исследование проводится следующим образом: на специальные бланки с фильтровальной бумагой капается капиллярная кровь пациента, затем высушивается и отправляется в лабораторию, где проводится ферментный анализ. Возможно определение концентрации гликозаминогликанов в моче, но часто встречаются ложные результаты [4] [14] .
Также в рамках диагностики проводится генетическое исследование. Оно заключается в поиске мутаций в определённых генах, отвечающих за развитие мукополисахаридозов.
Дополнительная диагностика заключается в поиске поражений органов и систем с помощью различных исследований:
- УЗИ — выявляет увеличение печени и селезёнки, пороки развития сердца и увеличение его размеров;
- рентгенография — выявляет патологию костей и суставов;
- электрокардиография — выявляет кардиомиопатию, патологию сократимости и проводимости;
- электромиография — позволяет диагностировать нарушения в проведении возбуждения по нервным волокнам к мышцам;
- аудиометрия — помогает выявить проблемы со слухом [5][14] .
При проведении рентгенологических исследований в случае мукополисахаридоза I H типа выставляется диагноз «множественный дизостоз» — нарушения развития костей. Диафизы длинных трубчатых костей расширены, при рентгенологических исследованиях отмечается изменение структуры метафизов и эпифизов. Ключицы короткие и толстые, рёбра приобретают форму весла, части, расположенные ближе к позвоночнику, сужены, а передние — толстые и широкие [1] . Фаланговые кости рук и ног укорочены, имеют форму трапеции, диафизы широкие.
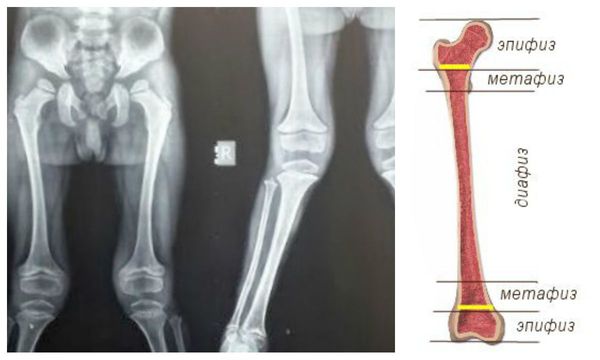
Формируются уплощение позвонков, сколиоз, кифосколиоз. Позвонки в поперечнике широкие, но они низкие. В деформированных участках отмечается недоразвитие поперечных отростков либо их «языкообразная» трансформация.
До рождения мукополисахаридоз и другие хромосомные нарушения можно обнаружить с помощью амниоцентеза (исследования околоплодной жидкости) или биопсии хориона (слоя плаценты). Также риск появления мукополисахаридоза у младенца можно определить ещё до зачатия. Для этого родителям нужно пройти генетический анализ [14] .
Лечение мукополисахаридоза
Симптоматическое лечение заключается в устранении грыжи, удалении миндалин и ортопедической хирургии. Проводится коррекция искривлений позвоночного столба при помощи транспедикулярной фиксации металлическими конструкциями, исправление деформаций костей и суставов, коррекция грудной клетки. Это позволяет облегчить болевой синдром, уменьшить риск сдавления спинного мозга. Также проводится шунтирование желудочков головного мозга при гидроцефалии.
Патогенетическое лечение, направленное на причину болезни, возможно при помощи трансплантации костного мозга и стволовых гемопоэтических клеток и заместительной ферментной терапии [5] . Трансплантация возможна от родственного донора либо из стволовых клеток пуповинной крови родственного донора после проведения химиотерапевтической или лучевой супрессии. Данный вид лечения не получил широкого распространения из-за высокого риска осложнений (инвалидизации или смерти). Заместительная ферментная терапия способна остановить прогрессирование заболевания, частично улучшить уже сформированные патологии. Применение такой терапии позволяет добиться регресса заболевания и существенно улучшить прогноз жизни.
В настоящее время ферментная терапия разработана только для некоторых типов мукополисахаридозов. При I типе используется альдуразим . Он представляет собой рекомбинантную человеческую альфа-L-идуронидазу. Препарат вводится внутривенно каждую неделю в течение 4-х часов [4] . Для мукополисахаридоха II типа показана элапраза [2] .
Мукополисахаридозы относятся к редким заболеваниям, поэтому препараты для их лечения выделяются на государственном уровне и предоставляются пациентам в рамках оказания бесплатной медицинской помощи [5] . В некоторых случаях заместительная терапия является пожизненной [14] .
Прогноз. Профилактика
При отсутствии должного лечения прогноз неблагоприятный, так как больные погибают от осложнений. Практически всегда заболевание приводит к инвалидизации. Однако всё зависит от типа заболевания. В некоторых случаях пациенты могут жить так же долго, как и здоровые люди [14] .
Профилактика заключается в генетическом консультировании пар, вступающих в брак, особенно при отягощённом семейном анамнезе.
Возможно проведение преимплантационной генетической диагностики в циклах ЭКО у пар с высоким риском рождения ребёнка с мукополисахаридозом либо генетическая диагностика на ранних сроках беременности с возможностью прерывания беременности при выявлении заболевания у плода.
Перспективным является создание генетических паспортов, выбор партнёра с отсутствием соответствующих мутаций.
Источник https://diseases.medelement.com/disease/%D0%BC%D1%83%D0%BA%D0%BE%D0%BF%D0%BE%D0%BB%D0%B8%D1%81%D0%B0%D1%85%D0%B0%D1%80%D0%B8%D0%B4%D0%BE%D0%B7-i-%D1%82%D0%B8%D0%BF%D0%B0-%D1%83-%D0%B4%D0%B5%D1%82%D0%B5%D0%B9-%D0%BA%D0%BF-%D1%80%D1%84-2021/16884
Источник https://clinpharm-journal.ru/articles/2018-3/mukopolisaharidozy-put-k-diagnozu/
Источник https://probolezny.ru/mukopolisaharidoz/




