В-крупноклеточные лимфомы у взрослых
Категории МКБ: B-клеточная лимфома неуточненная (C85.1), Диффузная неходжкинская лимфома неуточненная (C83.9), Злокачественные иммунопролиферативные болезни неуточненные (C88.9), Истинная гистиоцитарная лимфома (C96.3), Неходжкинская лимфома: крупноклеточная (диффузная) (C83.3), Неходжкинская лимфома: крупноклеточная, фолликулярная (C82.2), Неходжкинская лимфома: лимфобластная (диффузная) (C83.5), Опухоль Беркитта (C83.7)
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения и социального развития Республики Казахстан
от «23» сентября 2016 года
Протокол №17
По течению заболевания, прогнозу и 5-ти летней выживаемости все лимфомы можно разделить на индолентные и агрессивные. Это условное деление имеет значение в выборе терапевтической тактики. Агрессивными лимфомами принято считать: фолликулярную лимфому IIIтипа, диффузную В-крупноклеточную лимфому, первичную медиастенальную лимфому, лимфому Беркитта[2].
Агрессивные неходжкинские лимфомы — это наиболее распространенный подтип НХЛ, который характеризуется быстрым темпом роста опухоли в лимфатических узлах, селезенки, печени, костном мозге и/или других органах. Другие симптомы включают лихорадку, ночное потоотделение и потерю веса.
Последняя классификация лимфопролиферативных заболеваний была опубликована ВОЗ в 2016 году (смотреть Приложение 2, настоящего КП). Данная систематизация лимфом по группам основана как на морфологических особенностях, так и с учетом генетических и иммунофенотипических особенностей (более ранние классификации были основаны только с учетом морфологических характеристик)[3].
Фолликулярная лимфома, grade III (С82.2)[1]– это моноклональная опухоль из зрелыхВ-лимфоидных клеток, происходящих из фолликулярного центра лимфатических, имеющая иммунофенотип CD20+, CD10+/-, BCL-2+, BCL-6+, CD3-, CD5-, CD23+/-, CD43-, cyclin D1-[4].
Диффузная В-крупноклеточная лимфома (С83.3)[2] – это агрессивная В-крупноклеточная лимфома, морфологический субстрат представлен центробластами, иммунобластами, клетками с многодольчатыми ядрами, клетками с полиморфными/анаплазированными ядрами в различном количественном соотношении, что определяет морфологический вариант опухоли: центробластный, иммунобластный, анапластический.
Интраваскулярная (внутрисосудистая) диффузная В-крупноклеточная лимфома (С83.3)[3]— характеризуется избирательным ростом внутрь просвета капилляров, сосудов малого и среднего калибра, что приводит к их некротическим поражениям.Один из морфологических субвариантов В-крупноклеточной диффузной лимфомы [5].
Лимфобластная лимфома (С83.5)[4] – опухоль из Т- или В-клеточных предшественников, основную часть лимфобластных НХЛ составляют Т-клеточные опухоли, с пре- и интратимической стадиями Т-клеточной дифференцировки, т.е. из клеток-предшественниц [5].
Лимфома Беркитта (С83.7)[5]— высоко агрессивная лимфома из иммунологически зрелых В-клетокс преимущественно экстранодальной локализацией.
ДВККЛ, трансформированная (83.9) – данный вид лимфомы возникает как следствие трансформации зрелоклеточных индолентных НХЛ (в частности, лимфомы из малых лимфоцитов/хронического лимфолейкоза, фолликулярной лимфомы, лимфомы из клеток зоны мантии и некоторых других)[6].
Первичная медиастенальная лимфома (С85.1)[6] — представляет собой подтип диффузной В-клеточной лимфомы, локализующийся в переднем средостении и исходящий из вилочковой железы, а физиологические представители клеток лимфомы – В-клетки тимуса. Заболевание развивается на 3-5 декаде жизни преимущественно у женщин[5],[6].
ALK+ ДВККЛ (С88.9)[7](ранее известная как ALK+ плазмо-бластная лимфома) -это опухоль, образованная резко полиморфными атипичными клетками с фенотипом цитотоксических Т-лимфоцитов. ALK+ крупноклеточная лимфома является очень редкой формой злокачественного лимфопролиферативного процесса и составляет менее 1% всех ДВККЛ. Морфологически представлена тремя основными вариантами: обычным («классическим»), мелкоклеточным, лимфогистиоцитарным[6].
Т-клеточная богатая гистиоцитами крупно-клеточная лимфома (С96.3)[8]— вариант В-клеточной лимфомы со значительным количеством неопухолевых Т-клеток, в то время как неопластические В-лимфоциты составляют не более 10% клеток[5].
Соотношение кодов МКБ-10 и МКБ-9:
| МКБ-10 | МКБ-9 | ||
| Код | Название | Код | Название |
| C82.2 | Крупноклеточная лимфома, фолликулярная | 40.11 | Биопсия лимфатической структуры |
| 40.21 | Иссечение глубокого шейного лимфатического узла | ||
| С83.3 | Лимфома крупноклеточная диффузная | 40.23 | Иссечение подмышечного лимфатического узла |
| С83.5 | Лимфома лимфобластная диффузная | 40.24 | Иссечение пахового лимфатического узла |
| С83.7 | Опухоль Беркита | 40.29 | Простое иссечение другой лимфатической структуры |
| С83.9 | Диффузная неходжкинская лимфома неуточненная | 40.30 | Локальное иссечение лимфоузла |
| С85.1 | В-клеточная лимфома неуточненная | 41.50 | Полная спленэктомия |
| С88.9 | Злокачественные иммунопролиферативные болезни, неуточненные | 86.11 | Биопсия кожи и подкожных тканей |
| С96.3 | Истинная гистиоцитарная лимфома | ||
Дата разработки/пересмотра протокола: 2016 год
Пользователи протокола: ВОП,терапевты, онкологи, гематологи.
Категория пациентов: взрослые
Шкала уровня доказательности:
Таблица 1. Шкала уровней доказательности[1]
| УД | Характеристика исследований, которые легли в основу рекомендаций |
| А | Высококачественный мета-анализ, систематический обзор рандомизированных клинических исследований (РКИ) или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов |
[1] Является очень редким типом неходжкиснкой лимфомы, имеющей больше общих признаков с ДВККЛ, чем с другими фолликулярными лимфомами. Гистологический диагноз устанавливается в соответствии с критериями текущей классификации ВОЗ (смотреть Приложение 3, настоящего КП). Стадирование выполняется в соответствии с числомбластных клеток в поле зрения (1-2 цитологическая степень 1-2: 15 бластов). Фолликулярная лимфома IIIb цитологической степени (только бластные клетки) расценивается как агрессивная лимфома и лечение этой формы заболевания должно проводиться по алгоритму лечения диффузной В-крупноклеточной лимфомы.
[2]Это наиболее часто встречающийся вариант НХЛ высокой степени злокачественности у взрослых, разнообразный по морфологическим характеристикам, клиническим проявлениям и чувствительности к терапии. Это частично объясняется тем, что диффузная крупноклеточная лимфома может возникать (denovo) или быть следствием трансформации зрелоклеточных индолентных лимфом НХЛ ( в частности, фолликулярной, MALTом и др.). В 2008 году ВОЗ опираясь на профиль экспрессии генов признала молекулярные «подгруппы» диффузно-крупноклеточной лимфомы GCB(анг. germinal center B-cell-like) и ABC (англ. activated B-cell-like), как отдельные неклассифицируемые подтипы, вследствие их хромосомных особенностей. Лучшее понимание молекулярного механизма привело к исследованию различных терапевтических подходов для non-GCB и GCB подтипов. Благоприятным считается GCB, неблагоприятным АВС тип (non-GCB-тип). При возможности в диагностический алгоритм может включаться определение перестройки гена MYC (MYC-позитивная ДВККЛ встречается до 10% случаев). В ряде исследований при ДВККЛ, наряду с перестройкой гена MYC, одновременно могут обнаруживаться транслокация t(14;18)(q32;q21) и перестройка гена BCL6. Эти варианты заболевания обозначаются терминами DH (double-hit) или TH (triple-hit) лимфома. В классификации ВОЗ 2016 года (смотреть Приложение 3, настоящего КП) также отдельно выделена группа неспецифицированных В-клеточных лимфом, которые по морфологической, иммуногистохимической и молекулярно-генетической характеристикам занимают промежуточное положение (borderline cases) – им присуще черты сразу нескольких лимфом и поэтому их трудно классифицировать.Эти лимфомы описывались в литературе с использованием различных терминов, таких как пограничные лимфомы, В-клеточные лимфомы неклассифицированные, атипичная лимфрмаБеркитта, Беркито-подобныелимфомы или лимфомы серой зоны. Термин «лимфма серой зоны» был впервые использован в 1998 году на семинаре по болезни Ходжкина и связанных с ним заболеваниями для обозначения лифом на границе кЛХ и других видов. В 2008 году ВОЗ в обновленной классификации опухолей кроветоворной и лимфоидной тканей предложил выделить условные промежуточные категории, так называемые В-клеточные лимфомынеклассифицируемые с чертами сразу нескольких лимфом ДББКЛ икЛХ, а также В-клеточные неклассифицируемые с чертами ДВККЛ и ЛБ.Все эти случаи, а также DH или TH лимфомы, наряду с MYC+ ДВККЛ, имеют крайне неблагоприятное течение – медиана выживаемости больных составляет от 2 до 18 месяцев [2].
[3]Встречается крайне редко. Характеризуется агрессивным течением. Все случаи интраваскулярной В-крупноклеточной лимфомы должны рассматриваться как диссеминированный процесс. Опухоль экспрессирует CD5. Чаще всего поражаются почки, надпочечники, легкие, кожа, кости и ЦНС. Поражение периферических лимфатических узлов не является обязательным. В целом заболевание отличается обильной симптоматикой вследствие сосудистого поражения многих органов. Клиническое течение очень агрессивное, часто опухоль диагностируют только на аутопсии. Встречаются прогностически более благоприятные случаи, когда болезнь ограничена только поражением кожи.
[4]Наличие НХЛ из В-клеточных клеток-предшественниц встречаются значительно реже (20%). Это отличает лимфобластную лимфому от ОЛЛ, при котором в 75% случаев выявляются В-клеточные предшественники значительно реже Т-предшественники (15%) или миелоидные маркеры (10%).
[5]Опухоль имеет ряд четких специфических характеристик: отчетливую связь с инфицированием Эпштейна-Барр (ВЭБ), транслокацию (8;14), реаранжировку гена C-MYC, экспрессию CD19, CD20, CD22, CD10 – общего антигена ОЛЛ, большую фракцию роста, очень короткое время удвоения опухолевого клеточного клона и своеобразную клинику: большая частота поражения эктранодальных зон или развития острого лейкемического поражения костного мозга[5].
[6] Клинические проявления обусловлены большими опухолевыми массами в переднем средостении, часто с развитием синдрома сдавления верхней полой вены. При диссеминации возникает вовлечение в процесс таких экстранодальных областей, как почки, надпочечники, печень, кода и головной мозг. В опухолевой ткани диффузная инфильтрация сочетается с фиброзом. Опухолевые клетки очень разнообразны по размерам и форме ядра. Присутствует большое число неопухолевых лимфоцитов и эозинофилов, что создает впечатление о наличии лимфомы Ходжкина. Экспрессия CD45 отличает медиастенальную лимфому от лимфомы Ходжкина
[7]В большинстве случаев отмечают синусоидальное распределение опухолевых клеток и образование больших опухолевых скоплений, которые по макро- и микроскопическим характеристикам напоминают карциному или меланому. Лимфома состоит из мономорфныхиммунобластоподобных клеток с округлым светлым ядром, в котором определяется центрально расположенное ядрышко, и обильной базофильной цитоплазмой. В некоторых случаях присутствуют признаки плазмобластной дифференциации. Часто выявляют клетки, напоминающие клетки Березовского-Штернберга.ALK+ ДВККЛ не имеет В- и Т- клеточных маркеров, не отмечают экспрессии СD30 (в отличие от ALK+ анапластической Т-клеточной лимфомы) и CD45. Опухолевые клетки экспрессируют цитоплазматическую ALK гранулярного типа и антигены плазматических клеток CD138, MUM1/IRF4, кроме того, выявлена экспрессия ЕМА. Злокачественные клетки могут экспрессировать цитоплазматический IgA (реже IgG), CD4, CD43 и CD57.В отличие от транслокации t(2;5)/ALK-NPM1, которая определяется при ALK+ анапластической Т-клеточнойи лимфоме, 60% случаев ALK+ ДВККЛ имеют транслокацию t(2;17)(p23;q23), в результате которой образуется слитный белок (клатрин и ALK). Редкая встречаемость данной нозологической формы не дает возможности более детального определения генетических нарушений, связанных с развитием данной патологии.
[8] Т/Г-ДВККЛ — редкий вариант, составляющий 1–3% всех ДВККЛ. Опухоль имеет агрессивное течение и часто диагностируется в развернутой стадии с вовлечением в опухолевый процесс костного мозга. Гистологически Т/Г-ДКВЛ может иметь сходство с кЛХ или периферической Т-клеточной лимфомой. И хотя клинические проявления Т/Г-ДВККЛ и ЛХ разнятся, некоторые случаи заболевания имеют общие для этих лимфом особенности, предполагающие тесную биологическую связь. В некоторых случаях показано, что обе лимфомы могут присутствовать одновременно или появляться постепенно у одного и того же больного, что также поддерживает гипотезу об их взаимосвязи. Кроме того, и Т/Г-ДВККЛ, и ЛХ могут прогрессировать в типичную ДВККЛ в результате пролиферации злокачественных клеток, тогда строма перестает быть преобладающим компонентом опухоли.

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Фолликулярная лимфома[ 4 ]:
Стадия устанавливается в соответствии с классификацией Ann Arbor с указанием локализации массивного (“bulky”) поражения. (Классификация по Ann Arbor смотреть Приложение 3, настоящего КП).Для оценки индивидуального риска раннего прогрессирования используются международный прогностический индекс IPI (см.п.8 Классификация ДВККЛ)
Диффузная В-крупноклеточная лимфома[7]:
Стадирование ДВККЛ проводится в соответствии с классификацией Ann Arbor.
Для оценки индивидуального риска раннего прогрессирования используются международный прогностический индекс IPI (для всей популяции больных), который не потерял своего значения в условиях современных программ лечения. Прогностические модели типа aaIPI (скорректированный по возрасту), R-IPI (пересмотренный в эру ритуксимаба) или Е-IPI (шкала для пожилых) тестированы на меньшем числе больных и могут рассматриваться в качестве дополнительных прогностических конструкций.
Международный прогностический индекс (IPI):
| · Возраст старше 60 лет · ECOG ≥ 2 · Повышение ЛДГ · Стадия III-IV по AnnArbor · > 1 экстранодальной зоны поражения | 0-1 фактор – низкий риск 2 фактора – низкий/промежуточный риск 3 фактора – высокий/промежуточный риск 4-5 факторов – высокий риск |
| · Повышение ЛДГ · Стадия III-IV по AnnArbor · ECOG ≥2 | 0 факторов – низкий риск 1 фактор – низкий/промежуточный риск 2 фактора – высокий/промежуточный риск 3 фактора – высокий риск |
| · >60 Years · ECOG 3 or 4 · Повышение ЛДГ · 1 экстранодальной зоны поражения · Стадия III-IV по Ann Arbor | 0 факторов – очень низкий риск (очень хороший прогноз) 1, 2 фактора – низкий риск (прогноз благоприятный) 3,4,5 факторов – высокий риск (неблагоприятный прогноз) |
Интраваскулярная (внутрисосудистая) диффузная В-крупноклеточная лимфома[6]:
Стадирование по системе Ann Arbor не используется, так как, по определению, все случаи с первичной лимфомой серозных полостей изначально имеют IV стадию Для оценки индивидуального риска раннего прогрессирования используются международный прогностический индекс IPI (см.п.8 Классификация ДВККЛ)
Лимфобластная лимфома[8]:смотреть клинический протокол диагностики и лечения «Острый лимфобластный лейкоз у взрослых».
Лимфома Беркитта[9]:выделяют 3 варианта ЛБ: эндемический, спорадический и ВИЧ-ассоциированный:
· эндемический вариант ЛБ характерен для темнокожих детей-аборигенов
экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
· спорадический вариант ЛБ – типичная ЛБ по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
· иммунодефицит-ассоциированный вариант ЛБ – ЛБ, возникающая на фоне иммунодефицитных состояний (у больных ВИЧ-инфекцией, после трансплантации органов, у больных первичными иммунодефицитами). Чаще всего встречается у ВИЧ-инфицированных больных, причем на ранних этапах развития (до снижения CD4+ клеток). Болеют преимущественно мужчины. Частыми проявлениями заболевания являются лимфаденопатия, спленомегалия, вовлечение в опухолевый процесс костного мозга.
Лимфома/лейкоз Беркитта (В-клеточный острый лимфобластный лейкоз по типу L3): в костном мозге более 25% опухолевых клеток.
Клиническая классификация лимфомы Беркитта (Jude/Murphy,1980)[8].
| Проявления | |
| I стадия | Одиночная опухоль (экстранодальная) или одна анатомическая зона (нодальная), за исключением средостения и абдоминальной области |
| II стадия | Одиночная опухоль (экстранодальная) с региональными лимфатическими узлами |
| Две экстранодальные опухоли в сочетании или без вовлечения регионарных лимфатических узлов по одну сторону диафрагмы | |
| Первичная опухоль желудочно-кишечного тракта в сочетании или без вовлечения мезентериальных лимфатических узлов | |
| Два или более нодальных очага по одну сторону диафрагмы | |
| IIR стадия | Полностью резецированные абдоминальные опухоли |
| III стадия | Поражение по обе стороны диафрагмы: а) две экстранодальные опухоли; б) два и более нодальных очага |
| Все первичные внутригрудные опухоли | |
| Все первичные интраабдоминальные опухоли (медиастинальные, плевральные, тимуса) | |
| Все первичные интраабдоминальные очаги больших размеров | |
| Все первичные параспинальные или эпидуральные опухоли независимо от наличия других опухолей | |
| IIIA стадия | Ограниченные брюшной полостью, но нерезектабельные опухоли |
| IIIB стадия | Распространенные мультиорганные абдоминальные опухоли |
| IV стадия | Любое вышеуказанное проявление болезни с поражением ЦНС или костного мозга |
Диффузная В-крупноклеточная лимфома, трансформированная и Первичная медиастенальная лимфома[4]:
Стадия устанавливается в соответствии с классификацией Ann Arbor с указанием локализации массивного (“bulky”) поражения (Классификация по Ann Arbor смотреть Приложение 3, настоящего КП). Для оценки индивидуального риска раннего прогрессирования используются международный прогностический индекс IPI (смотреть пункт 8,«Классификация ДВККЛ»).
ALK+ крупноклеточная лимфома[4]:
Стадия устанавливается в соответствии с классификацией Ann Arbor с указанием локализации массивного (“bulky”) поражения. (Классификация по Ann Arbor смотреть Приложение 3, настоящего КП).Для оценки индивидуального риска раннего прогрессирования используются международный прогностический индекс IPI (смотреть пункт 8, «Классификация ДВККЛ»).
Т-клеточная богатая гистиоцитами крупно-клеточная лимфома[7]:
Стадия устанавливается в соответствии с классификацией Ann Arbor с указанием локализации массивного (“bulky”) поражения. (Классификация по Ann Arbor смотреть Приложение 3, настоящего КП).Для оценки индивидуального риска раннего прогрессирования используются международный прогностический индекс IPI (см.пункт 8 «Классификация ДВККЛ»).
Диагностика (амбулатория)
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ
Диагностические критерии: Жалобы, анамнез, данные физикального исследования играют важную роль в диагностике и в дифференциальной диагностике лимфом, но неспецифичны в связи с чем не относятся к диагностическими критериями.
Жалобы:
· Увеличение лимфоузлов (чаще безолезненное).
· Кашель без выделения мокроты – возникает за счет сдавления дыхательных путей увеличенными лимфоузлами средостения.
· Отеки лица, шеи, рук – возникают за счет сдавления верхней полой вены.
· Тяжесть в левом подреберье – за счет увеличения селезенки.
· Кожный зуд, преимущественно в области увеличившихся лимфоузлов, реже – по всему телу.
· Повышение температуры тела, преимущественно в вечернее и ночное время.
· Снижение массы тела (более 10-15 кг в течение 2-3 месяцев).
· Общая слабость, повышенная утомляемость.
· Усиленное потоотделение, особенно в ночное время.
Физикальное обследование:
· Определяется цвет кожных покровов (возможна бледность).
· При кожном зуде на коже могут быть следы расчесов.
· При пальпации определяется увеличение лимфоузлов.
· При перкуссии: возможно увеличение селезенки
· Пульс может быть учащенным, а артериальное давление — сниженным.
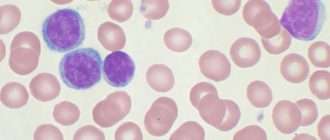
Лабораторныеисследования:
· общий анализ крови – подсчет лейкоформулы, тромбоцитов в мазке: может определяться снижение количества эритроцитов, снижение уровня гемоглобина Цветной показатель обычно остается в пределах нормы. Количество лейкоцитов чаще остается в пределах нормы. Уровень тромоцитов может быть в пределах нормы, но чаще течение агрессивных лимфом сопровождается умеренным тромоцитозом
· биохимический анализ крови – лактатдегидрогеназа, общий белок, альбумин, креатинин, мочевина, электролиты, мочевая кислота — для выявления синдрома лизиса опухоли, а также сопутствующего поражения органов.
· коагулограмма: чаще повышение уровня Д-димеров
Инструментальныеисследования:
· УЗИ периферичесих и внутрибрюшных лимфоузлов – увеличение размеров и изменение структуры лимфоузлов;
· цитологическое исследование биопсийного материала – с целью верификации морфологической формы ЛПЗ;
· гистологическое исследование – с целью верификации морфологической формы ЛПЗ;
· иммуногистохимическое исследование – с целью верификации морфологической формы ЛПЗ.
Диагностические критерии ФЛ grade III:
| Методы | Характерно | |
| Основные | Гистология | Псевдофолликулярная, нодулярная либо нодулярно-диффузная пролиферация лимфоидных клеток, экспрессирующих маркеры центра фолликулов |
| ИГХ | В редких случаях фолликулярная лимфома может быть BCL-2-негативная. При этом необходимо использование клонов антител к BCL-2 (например, E17) и цитогенетическое исследование для выявления или реаранжировки BCL-2. При преобладании диффузного роста фолликулярной лимфомы 1-2 цитологического типа, а также при фолликулярной лимфоме 3 цитологического типа экспрессия CD10 часто отсутствует. В этих случаях можно дополнять диагностическую панель антител новыми маркерами герминальной (фолликулярной) дифференцировки HGAL (GCET2). Пролиферативный индекс обычно не превышает 20%, Ki-67 > 30% ассоциируется с неблагоприятным прогнозом | |
| Характерный иммунофенотип | CD20+, CD10+/-, BCL-2+, BCL-6+, CD3-, CD5-, CD23+/-, CD43-, cyclin D1-. | |
| Дополнительно | Цитогенетика/FISH | t(14;18), реже – t(2;18), t(18;22). |
| Методы | Характерно | |
| Основные | Гистология | Морфологический субстрат представлен центробластами, иммунобластами, клетками с многодольчатыми ядрами, клетками с полиморфными/анаплазированными ядрами в различных количественных соотношениях, что определяет морфологический вариант опухоли: центробластный, иммунобластный, анапластический |
| ИГХ | Характеризуется экспрессией пан-В-клеточных антигенов CD20, CD79a, PAX 5 (мономорфная интенсивная ядерная экспрессия), CD45 и не экспрессируют CD3. CD30 может экспрессироваться частью клеток с полиморфной/анапластической морфологией. CD10 определяется в 30-60% случаев, BCL-6 – в 60-90% случаев, BCL-2 – в 30-50% случаев, MUM.1 – в 35-65% случаев. CD5-позитивная диффузная крупноклеточная В-клеточная лимфома встречается примерно в 10% наблюдений. В этих случаях необходимо иммуногистохимическое исследование с антителами к cyclin D1 для исключения полиморфноклеточного бластоидного варианта лимфомы из клеток мантии. Вместе с тем, до 20% ДВКЛ могут экспрессировать cyclin D1 (часть опухолевых клеток, слабая по интенсивности ядерная реакция). | |
| Дополнительно | Цитогенетика/FISH | Необходимо определение перестройки гена MYC (MYC-позитивная ДВККЛ встречается до 10% случаев). В ряде исследований при ДВККЛ, наряду с перестройкой гена MYC, одновременно могут обнаруживаться транслокация t(14;18)(q32;q21) и перестройка гена BCL6. |
| Методы | Характерно | |
| Основные | Гистологическое и ИГХ-исследование | Опухолевые клетки имеют разнообразную морфологию центробластоподобных атипичных лимфоцитов с проявлениями от иммуноили плазмобластных до анапластических с экспрессией CD45, CD30, CD38, CD138, но при этом отсутствуют СD20, CD19, CD79a. Также могут быть выявлены антигены вирусов HHV-8 (LANA) и Эпштейна-Барр (EBER). |
| Дополнительно | Цитогенетика/FISH | нет реаранжировки с-myc или bcl-6 |
Диагностические критерии лимфобластной лимфомы:
Смотреть протокол диагностики и лечения «Острый лимфобластный лейкоз у взрослых.
Диагностические критерии ЛБ:
| Методы | Характерно | |
| Основные | Гистология | Морфологически представляет В-клеточную лимфому с диффузным ростом мономорфных клеток среднего размера с округлыми ядрами, с узким ободком базофильной цитоплазмы. Типична картина «звездного неба» (макрофаги с обломками ядер в цитоплазме) |
| Характерный иммунофенотип (при проведении ИФТ и ИГХ) | CD20+, CD10+, CD38+, BCL-6+, BCL-2-, CD44-, TdT-, CD3-. Индекс пролиферативной активности опухолевых клеток Ki-67 приближается к 100% | |
| Дополнительно | Цитогенетика/FISH | Выявление транслокации c-myc/IgH |
Диагностические критерии ДВККЛ, трансформированной:
(см. Диагностические критерии ДВККЛ)
Диагностические критерии ПМВККЛ:
| Методы | Характерно | |
| Основные | Гистология | Цитологически напоминает другие ДВККЛ и состоит из трансформированных клеток с признаками центробластов или иммунобластов. Морфологическая картина характеризуется диффузной пролиферацией злокачественных клеток на фоне выраженного фиброза стромы. |
| ИГХ | Клетки экспрессируют общий лейкоцитарный антиген CD45. Для ПМВККЛ характерна экспрессия СВ23 антигена, который редко выявляется при других вариантах ДВККЛ . В части случаев определяется экспрессия BCL-6 и/или MUM1/IRF4. Пролиферативная активность вариабельная, в отдельных случаях очень высокая. | |
| Характерный иммунофенотип | sIg–; CD3–; CD5–; CD10–; CD19+; CD20+; CD22+; CD23+; CD30+ (слабое окрашивание); CD45+; CD79a+, РАХ-5/ BSAP+; BOB.1+; Oct-2+; PU.1+, BCL-6+/–;MUM1/IRF4+/–. | |
| Дополнительно | Цитогенетика/FISH | В опухолевах клетках при ПМВККЛ отмечают соматические мутации генов тяжелых цепей Ig, а также мутации генов PAX-5, c-Myc. Во многих случаях происходят мутации p53, гиперэкспрессия генов BСL-6 и активация фактора NF-kB. При ПМВККЛ в 42% случаев определяются делеции 1p, 3p, 4q, 6q, 7p и 17p, что играет важную роль в патогенезе данной нозологической формы. Кроме того, характерными генетическими аномалиями являются амплификации в локусах 9p и 2p, что ассоциировано с тирозинкиназой JAK2 (9p24) и транскрипционным факторомcемейства NF-kB REL (2p16). |
| Методы | Характерно | |
| Основные | Гистология | В большинстве случаев отмечают синусоидальное распределение опухолевых клеток и образование больших опухолевых скоплений, которые по макро- и микроскопическим характеристикам напоминают карциному или меланом. Лимфома состоит из мономорфных иммунобластоподобных клеток с округлым светлым ядром, в котором определяется центрально расположенное ядрышко, и обильной базофильной цитоплазмой. В некоторых случаях присутствуют признаки плазмобластной дифференциации. Часто выявляют клетки, напоминающие клетки Березовского — Штернберга. |
| ИГХ | не имеет В- и Т- клеточных маркеров, не отмечают экспрессии СD30 (в отличие от ALK+ анапластической Т-клеточной лимфомы) и CD45. Опухолевые клетки экспрессируют цитоплазматическую ALK гранулярного типа и антигены плазматических клеток CD138, MUM1/IRF4, кроме того, выявлена экспрессия ЕМА. Злокачественные клетки могут экспрессировать цитоплазматический IgA (реже IgG), CD4, CD43 и CD57 | |
| Характерный иммунофенотип | CD20–; CD30–; CD79а–; CD45–; ALK+; CD138+; MUM1/IRF4+; ЕМА+. | |
| Дополнительно | Цитогенетика/FISH | 60% случаев ALK+ ДКВЛ имеют транслокацию t(2;17)(p23;q23), в результате которой образуется слитный белок (клатрин и ALK).[1] |
Диагностические критерии Т-клеточной богатой гистиоцитами крупно-клеточной лимфомы:
| Методы | Характерно | |
| Основные | Гистология | Характеризуется пролиферацией крупных атипичных В-клеток, дискретно расположенных на фоне реактивного инфильтрата из зрелых Т-лимфоцитов и гистиоцитов. Опухолевые В-лимфоциты имеют вид центробластов, иммунобластов, а в отдельных случаях напоминают клетки Березовского — Штернберга. В селезенке отмечают мультифокальный микронодулярный тип поражения белой пульпы вышеописанной клеточной инфильтрацией. В печени инфильтрат располагается вдоль портальных трактов. Гетерогенность клеточного состава, преобладание клеток с гиперхромными округлыми или овальны- ми ядрами, присутствие эпителиоидных гистиоцитов и Т-лимфоцитов, что подтверждено ИГХ исследованиями, а также наличие В-лимфоцитов, которые являются моноклональными, дают возможность диагностировать Т/Г-ДВККЛ |
| ИГХ | Опухолевые клетки экспрессируют CD45 и В-клеточные дифференцировочные маркеры CD20, CD79а и РАХ-5. В большинстве клеток экспрессируется BСL-6, однако отмечается отсутствие экспрессии CD10, и в большей части случаев отсутствует экспрессия BCL-2, а также не выявляют транслокации t(14,18) (q32; q21). В некоторых случаях определяется антиген мембран эпителиальных клеток (ЕМА). Опухолевые клетки не экспрессируют CD15 и CD30. Малые лимфоциты реактивного фона, количество которых намного превышает количествоОпухолевые клетки, экспрессируют маркеры зрелых Т-лимфоцитов — CD2, CD3, CD5 и CD7; большинство из них являются CD8+. Выявляют разное количество CD68+-реактивных гистиоцитов. Пролиферативный индекс опухоли высокий, однако его оценка затруднена присутствием множества реактивных клеток. Моноклональная природа крупных патологических клеток подтверждается также экспрессией только одного типа легких цепей Ig | |
| Характерный иммунофенотип | CD20+; CD79а+; РАХ-5+; CD45+; Bcl-6+; EMA+; Bcl-2–; CD10–; CD15–; CD30–. | |
| Дополнительно | Цитогенетика/FISH | Часто отмечают генетические аномалии; это относится как к амплификациям 4q, Xq, Xp и 18q хромосом, так и делеции 17p. |
Диагностический алгоритм: Диагностический алгоритм включат в себя выявление образования с помощью методов лучевой диагностики, проведение биопсии иили удаление выявленного образования с последующим гистологическим и иммуногистохимическим исследованиями. По индивидуальным показаниям перечень диагностических мероприятий может быть расширен.

[1] Редкая встречаемость данной нозологической формы не дает возможности более детального определения генетических нарушений, связанных с развитием данной патологии
Диагностика (стационар)
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ
Диагностические критерии на стационарном уровне[4]:
Решающее значение для верификации диагноза лимфомы имеют гистологическое и иммуногистохимическое исследования. Дополнительные методы необходимы для определения распространенности опухолевого процесса и стратификации пациентов по группам риска. Такие критерии как анамнез, жалобы и объективный статус не специфичны и диагностически не значимы.
Лабораторные исследования:
NB! Основные принципы:
· Диагноз должен быть установлен на основании исследования хирургически удаленного (резекция) лимфоузла или участка экстранодального поражения, при этом количество материала должно быть достаточным для фиксации в формалине и приготовления парафиновых блоков. Обязательно выполнение иммуногистохимического исследования с использованием минимальной панели антител (CD20, CD45, CD3);
· Пункционная биопсия или трепанобиопсия опухоли с диагностической целью могут быть выполнены только в исключительных случаях, при необходимости немедленного лечения;
· Возможна также заморозка части свежего биопсийного материала для молекулярных исследований, однако определение профиля экспрессии генов остается исследовательским подходом;
· Морфологическое исследование должно быть максимально достоверным, выполненным патологом экспертом и соответствовать критериям текущей классификации ВОЗ.
Диагностический алгоритм: Диагностический алгоритм включат в себя выявление образования с помощью методов лучевой диагностики, проведение биопсии иили удаление выявленного образования с последующим гистологическим и иммуногистохимическим исследованиями. По индивидуальным показаниям перечень диагностических мероприятий может быть расширен. Схема (смотреть амбулаторный уровень).
Перечень основных диагностических мероприятий:
· общий анализ крови – подсчет лейкоформулы, тромбоцитов в мазке: может определяться снижение количества эритроцитов, снижение уровня гемоглобина Цветной показатель обычно остается в пределах нормы. Количество лейкоцитов чаще остается в пределах нормы. Уровень тромоцитов может быть в пределах нормы, но чаще течение агрессивных лимфом сопровождается умеренным тромоцитозом
· УЗИ периферичесих и внутрибрюшных лимфоузлов – увеличение размеров и изменение структуры лимфоузлов;
· цитологическое исследование биопсийного материала – с целью верификации морфологической формы ЛПЗ;
· гистологическое исследование – основной метод диагностики заболевания. Позволяет установить диагноз и оценить степень злокачественности лимфомы в зависимости от состава клеток, что определяет выбор дальнейшего лечения.
· иммуногистохимическое исследование – с целью верификации морфологической формы ЛПЗ.
Перечень дополнительных диагностических мероприятий:
· миелограмма – определение цитологиского состава костного мозга. Проводится с целью выявления поражения костного мозга опухолевыми клетками;
· цитогенетическое исследование костного мозга — метод выявления нарушений в хромосомах.;
· иммунофенотипирование на проточном цитофлюориметре — проводится с целью дифференциации клеток в образцах крови, костного мозга, лимфатических узлах
· гистологическое исследование костного мозга — наиболее точно характеризует состояние костного мозга. Выявляет распространение опухоли на костный мозг;
· исследование костного мозга методом FISH — метод выявления нарушений в хромосомах;
· FISH-исследование отпечатков биопсийного материала — метод выявления нарушений в хромосомах;
· КТ грудного сегмента, брюшного сегмента, головы, малого таза;
· ПЭТ/КТ всего тела;
· ультразвуковое исследование органов брюшной полости — печень, селезенка, поджелудочной железа, желчный пузырь, лимфатические узлы, почки, щитовидная железа, у мужчин — предстательной железы, у женщин — малого таза;
· группа крови и резус фактор – по показаниям (при неоходимости в переливании компонентов крови);
· биохимический анализ крови (общий белок, альбумин, СРБ, креатинин, мочевина,мочевая кислота, щелочная фосфатаза) – по показаниям;
· ИФА на маркеры вирусных гепатитов, ИФА на маркеры ВИЧ – по показаниям;
· ЭКГ, ЭХО–кардиография, ФГДС, УЗДГ сосудов, бронхоскопия, колоноскопия, спирография – по показаниям;
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований[9]:
Таблица. Алгоритм иммуногистохимической дифференциальной диагностики классической лимфомы Ходжкина и крупноклеточных лимфом
| Маркеры | Лимфомы | ||||
| ЛХ | АККЛ | ДBККЛ | Плазмобластная лимфома | ПМВККЛ | |
| PAX 5 | + (большинст во опухолевых клеток — слабая ядерная экспрессия; около 5% PAX 5негатив ных случаев) | — | + (интенсивно) | –/+ (часто слабая ядерная экспрессия) | + (интенсив но) |
| BOB.1 | – (отдельные слабопози тивные клетки) | — | + (интенсив но) | –/+ | + (интенсив но) |
| CD15 | +/- | – (редко позитив но) | — | — | — |
| CD20 | –/+ (гетерогенная позитивная реакция) | — | + | — | + |
| CD23 | — | — | — | — | + |
| CD30 | + | + | –/+ (мономорфно при анапла стическом ва рианте) | — | –/+ |
| CD45 | — | –/+ | + | –/+ | + |
| CD79a* | –/+ | — | + | –/+ | + |
| IgG | — | — | — | +/- | — |
| IgM | — | — | + | — | — |
| MUM.1 | + | + | +/- | + | + |
| EBER | –/+ | — | -** | + | — |
| (+/–) — более 50% позитивных случаев; (–/+) — менее 50% позитивных случаев. АККЛ — анапластическая крупноклеточная лимфома; ДВККЛ — диффузная В_крупноклеточная лимфома; ЛХ — классическая лимфома Ходжкина; ПМБКЛ — первичная медиастинальная В-крупно-клеточная лимфома. * СD79a_позитивны до 25% случаев лимфомы Ходжкина (обычно реакция позитивна в части опухолевых клеток). ** ВЭБ-позитивная диффузная В-крупноклеточная лимфома. | |||||
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Губка гемостатическая |
| Азитромицин (Azithromycin) |
| Альбумин человека (Albumin human) |
| Амброксол (Ambroxol) |
| Амикацин (Amikacin) |
| Аминокапроновая кислота (Aminocaproic acid) |
| Аминокислоты для парентерального питания + Прочие препараты (Жировые эмульсии для парентерального питания + Декстроза + Минералы) (Aminoacids for parenteral nutrition+Other medicines (Fat emulsions + Dextrose + Multimineral)) |
| Аминофиллин (Aminophylline) |
| Амиодарон (Amiodarone) |
| Амлодипин (Amlodipine) |
| Амоксициллин (Amoxicillin) |
| Амфотерицин B (Amphotericin B) |
| Анидулафунгин (Anidulafungin) |
| Антиингибиторный коагулянтный комплекс (Antiingibitorny coagulant complex) |
| Атенолол (Atenolol) |
| Атракурия бесилат (Atracurium besylate) |
| Атропин (Atropine) |
| Ацетилцистеин (Acetylcysteine) |
| Ацикловир (Acyclovir) |
| Бендамустин (Bendamustine) |
| Брентуксимаб ведотин (Brentuximab Vedotin) |
| Бупивакаин (Bupivacaine) |
| Валацикловир (Valacyclovir) |
| Валганцикловир (Valganciclovir) |
| Ванкомицин (Vancomycin) |
| Винбластин (Vinblastine) |
| Виндезин (Vindesine) |
| Винкристин (Vincristine) |
| Винорелбин (Vinorelbine) |
| Вода для инъекций (Water for Injection) |
| Вориконазол (Voriconazole) |
| Ганцикловир (Ganciclovir) |
| Гемцитабин (Gemcitabine) |
| Гентамицин (Gentamicin) |
| Гепарин натрия (Heparin sodium) |
| Гидроксиэтилкрахмал (Hydroxyethyl starch) |
| Даунорубицин (Daunorubicin) |
| Дексаметазон (Dexamethasone) |
| Декстроза (Dextrose) |
| Диазепам (Diazepam) |
| Дифенгидрамин (Diphenhydramine) |
| Добутамин (Dobutamine) |
| Доксорубицин (Doxorubicin) |
| Допамин (Dopamine) |
| Дротаверин (Drotaverinum) |
| Имипенем (Imipenem) |
| Иммуноглобулин человека нормальный (IgG+IgA+IgM) (Immunoglobulin human normal (IgG+IgA+IgM)) |
| Иммуноглобулин человеческий нормальный (Human normal immunoglobulin) |
| Инсулин человеческий (Insulin human) |
| Итраконазол (Itraconazole) |
| Ифосфамид (Ifosfamide) |
| Калия хлорид (Potassium chloride) |
| Кальция глюконат (Calcium gluconate) |
| Кальция фолинат (Calcium folinate) |
| Кальция хлорид (Calcium chloride) |
| Каптоприл (Captopril) |
| Карбоплатин (Carboplatin) |
| Каспофунгин (Caspofungin) |
| Кетамин (Ketamine) |
| Кетопрофен (Ketoprofen) |
| Клавулановая кислота (Clavulanic acid) |
| Клотримазол (Clotrimazole) |
| Колистиметат натрия (Colistimethate sodium) |
| Комплекс аминокислот для парентерального питания (Complex of amino acids for parenteral nutrition) |
| Лактулоза (Lactulose) |
| Левофлоксацин (Levofloxacin) |
| Леналидомид (Lenalidomide) |
| Лидокаин (Lidocaine) |
| Лизиноприл (Lisinopril) |
| Линезолид (Linezolid) |
| Магния сульфат (Magnesium sulfate) |
| Маннитол (Mannitol) |
| Меропенем (Meropenem) |
| Месна (Mesna) |
| Метилпреднизолон (Methylprednisolone) |
| Метилурацил (Диоксометилтетрагидропиримидин) (Methyluracil (Dioxomethyltetrahydropyrimidine)) |
| Метотрексат (Methotrexate) |
| Метронидазол (Metronidazole) |
| Микафунгин (Micafungin) |
| Митоксантрон (Mitoxantrone) |
| Моксифлоксацин (Moxifloxacin) |
| Морфин (Morphine) |
| Надропарин кальция (Nadroparin calcium) |
| Натрия ацетат (Sodium acetate) |
| Натрия гидрокарбонат (Sodium hydrocarbonate) |
| Натрия хлорид (Sodium chloride) |
| Натрия хлорид (Sodium chloride) |
| Нафазолин (Naphazoline) |
| Ницерголин (Nicergoline) |
| Норэпинефрин (Norepinephrine) |
| Оксалиплатин (Oxaliplatin) |
| Омепразол (Omeprazole) |
| Ондансетрон (Ondansetron) |
| Офлоксацин (Ofloxacin) |
| Памидроновая кислота (Pamidronic acid) |
| Пипекурония бромид (Pipekuroniyu bromide) |
| Пиперациллин (Piperacillin) |
| Повидон — йод (Povidone — iodine) |
| Преднизолон (Prednisolone) |
| Преднизон (Prednisone) |
| Прокаин (Procaine) |
| Прокарбазин (Procarbazine) |
| Пропофол (Propofol) |
| Ритуксимаб (Rituximab) |
| Рокурония бромид (Rocuronium) |
| Сальбутамол (Salbutamol) |
| Смектит диоктаэдрический (Dioctahedral smectite) |
| Спиронолактон (Spironolactone) |
| Сульфаметоксазол (Sulphamethoxazole) |
| Тазобактам (Tazobactam) |
| Талидомид (Thalidomide) |
| Тигециклин (Tigecycline) |
| Тикарциллин (Ticarcillin) |
| Тиопентал-натрий (Thiopental sodium) |
| Тобрамицин (Tobramycin) |
| Торасемид (Torasemide) |
| Трамадол (Tramadol) |
| Триметоприм (Trimethoprim) |
| Фамотидин (Famotidine) |
| Фамцикловир (Famciclovir) |
| Фенилэфрин (Phenylephrine) |
| Фенобарбитал (Phenobarbital) |
| Фентанил (Fentanyl) |
| Филграстим (Filgrastim) |
| Флуконазол (Fluconazole) |
| Фолиевая кислота (Folic acid) |
| Фуросемид (Furosemide) |
| Хлорамфеникол (Chloramphenicol) |
| Хлоргексидин (Chlorhexidine) |
| Хлоропирамин (Chloropyramine) |
| Цефепим (Cefepime) |
| Цефоперазон (Cefoperazone) |
| Циклофосфамид (Cyclophosphamide) |
| Циластатин (Cilastatin) |
| Ципрофлоксацин (Ciprofloxacin) |
| Цисплатин (Cisplatin) |
| Цитарабин (Cytarabine) |
| Эноксапарин натрия (Enoxaparin sodium) |
| Эпинефрин (Epinephrine) |
| Эритромицин (Erythromycin) |
| Эртапенем (Ertapenem) |
| Этопозид (Etoposide) |
Группы препаратов согласно АТХ, применяющиеся при лечении
| (A10AB) Инсулины и их аналоги короткого действия |
Лечение (амбулатория)
ЛЕЧЕНИЕ НА АМБУЛАТОРНОМ УРОВНЕ
Тактика лечения:
Тактика лечения на амбулаторном уровне для первичных паицентов сводится к выявлению лимфопролиферативного заболевания и верификации диагноза (если позволяет соматический статутс пациента). Для пациентов с установленным диагнозом амулаторное лечение сводится к низкотоксичным курсам и химиотерапии и лучевой терапии.
Немедикаментозное лечение:
Режим: общеохранительный.
Диета: нейтропеническим пациентам не рекомендуется соблюдать определенную диету (УД В)[10]:
Медикаментозное лечение: На этапе дообследования, по индивидуальным показаниям возможно проведение симптоматической терапии.
После верификации: применение низкотоксичных курсов ХТ и лучевой терапии.
Перечень основныхлекарственных средств:
Антинеопластические, иммуносупрессивные и антибактериальные лекарственные средства
· бендамустин, порошок для приготовления раствора для инъекций 25мг, 100 мг;
· брентуксимаб ведотин, порошок для приготовления раствора для инъекций 50 мг;
· винбластин, лиофилизат для приготовления раствора для внутривенного введения 5 мг;
· винкристин, 1 мг, для инъекций;
· даунорубицин, порошок лиофилизированный для приготовления раствора для инъекций или раствор для внутривенного введения 20мг;
· дексаметазон, раствор для инъекций 4мг/мл 1 мл;
· доксорубицин, для инфузий, 10мг и 50 мг;
· леналидомид, капсулы 5 мг, 10 мг, 15 мг и 25 мг;
· метотрексат, таблетки 2,5 мг;
· преднизолон*, раствор для инъекций 30мг/мл, таблетки 5 мг;
· преднизон, таблетки 1 мг, 5 мг, 20 мг, 50мг.
· прокарбазин*, капсулы 50 мг;
· ритуксимаб, концентрат для приготовления раствора для внутривенных инфузий 10мг/50мл, 10мг/10мл;
· талидомид*, таблетки 25 мг, 50 мг, 100 мг;
· циклофосфамид, лиофилизат/порошок для приготовления раствора для инъекций 200 мг, 500 мг, 1000 мг;
· цисплатин*, концентрат для приготовления раствора для инфузий 0.5 мг/мл, 50 мг/100 мл;
· цитарабин, порошок лиофилизированный для приготовления раствора для инъекций 100 мг, 1000 мг;
· этопозид, концентрат для приготовления раствора для внутривенных инфузий 100 мг/5 мл.
Перечень дополнительных лекарственных средств:
Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов:
· филграстим, раствор для инъекций 0,3мг/мл,1 мл;
· трамадол 50мг, капсулы (после регистрации);
· ондансетрон, раствор для инъекций 8 мг/4мл;
· омепразол, капсула 20 мг;
Антибактериальные средства:
· амоксициллин/клавулановая кислота, таблетка, покрытая пленочной оболочкой, 1000мг;
· моксифлоксацин, таблетка, 400 мг;
· офлоксацин, таблетка, 400 мг;
· ципрофлоксацин таблетка, 500 мг;
· эритромицин, таблетка 250мг;
Противогрибковые лекарственные средства:
· анидулафунгин, лиофилизированный порошок для приготовления раствора для инъекций, 100 мг/флакон;
· вориконазол, таблетка, 50 мг;
· итраконазол, раствор для приема внутрь10мг/мл 150,0;
· каспофунгин, лиофилизат для приготовления раствора для инфузий 50 мг;
· клотримазол, раствор для наружного применения 1% 15мл;
· метронидазол, таблетка, 250 мг;
· микафунгин, порошок лиофилизированный для приготовления раствора для инъекций 50 мг,100 мг;
· флуконазол, капсула/таблетка 150 мг;
Противовирусные лекарственные средства:
· ацикловир, таблетка, 400 мг;
· валацикловир, таблетка, 500мг;
· вальганцикловир, таблетка, 450мг;
· вориконазол, таблетка, 50 мг;
· ганцикловир*, лиофилизат для приготовления раствора для инфузий 500мг;
· фамцикловир, таблетки, 500мг №14.
Лекарственные средства, применяемые при пневмоцистозе:
· сульфаметоксазол/триметоприм, таблетка 480 мг;
Дополнительные иммуносупрессивные лекарственные средства:
· дексаметазон, раствор для инъекций 4мг/мл 1 мл; (для люмбальных пункций)
· метилпреднизолон, таблетка, 16 мг;
· преднизолон, раствор для инъекций 30 мг/мл 1мл,таблетка, 5 мг.
Растворы, применяемые для коррекции нарушений водного, электролитного и кислотно-основного баланса:
· вода для инъекций, раствор для инъекций 5мл;
· декстроза, раствор для инфузий 5% 250мл;
· натрия хлорид, раствор для инфузий 0,9% 500мл.
Лекарственные средства, влияющие на свертывающую систему крови:
· аминокапроновая кислота, раствор для инфузий 5%, 100 мл;
· гепарин, раствор для инъекций 5000 МЕ/мл, 5 мл; (для промывания катетера)
· надропарин, раствор для инъекций в предварительно наполненных шприцах, 2850 МЕ анти-Ха/0,3 мл, 5700 МЕ анти-Ха/0,6 мл;
· эноксапарин, раствор для инъекций в шприцах 4000 анти-Ха МЕ/0,4 мл,8000 анти-Ха МЕ/0,8 мл.
Другие лекарственные средства:
· амброксол, раствор для приема внутрь и ингаляций, 15мг/2мл, 100мл;
· амлодипин, таблетка/капсула 5 мг;
· атенолол, таблетка 25мг;
· ацетилцистеин, порошок для приготовления раствора для приема внутрь, 3 г;
· ацикловир, крем для наружного применения, 5% — 5,0;
· гепарин, гель в тубе 100000ЕД 50г;
· дексаметазон, капли глазные 0,1% 8 мл;
· дифенгидрамин, раствор для инъекций 1% 1 мл;
· дротаверин, раствор для инъекций 2%, 2 мл;
· инсулин человеческий 100ЕД;
· каптоприл, таблетка 50мг;
· кетопрофен, раствор для инъекций 100 мг/2мл;
· клотримазол, крем для наружного применения 1% 30г;
· лактулоза, сироп 667г/л по 500 мл;
· левофлоксацин, таблетка, 500 мг;
· лидокаин, раствор для инъекций, 2% по 2 мл;
· лизиноприл, таблетка 5мг;
· метилурацил, мазь для местного применения в тубе 10% 25г;
· метронидазол, гель стоматологический 20г;
· нафазолин, капли в нос 0,1% 10мл;
· омепразол, капсула 20 мг;
· повидон – йод, раствор для наружного применения 1 л;
· прокаин, раствор для инъекций 0,5% по 10 мл;
· сальбутамол, раствор для небулайзера 5мг/мл-20мл;
· смектит диоктаэдрический, порошок для приготовления суспензии для приема внутрь 3,0 г;
· спиронолактон, капсула 100 мг;
· тобрамицин, капли глазные 0,3% 5мл
· торасемид, таблетка 10мг;
· фентанил, система терапевтическая трансдермальная 75 мкг/ч; (для лечения хронических болей у онкологических больных)
· хлорамфеникол, сульфадиметоксин, метилурацил, тримекаин мазь для наружного применения 40г;
· хлоргексидин, раствор 0,05% 100мл;
· хлоропирамин, раствор для инъекций 20 мг/мл 1мл.
Другие виды лечения: нет.
Показания для консультации специалистов:
· консультация онколога – при подозрении на лимфопролиферативные заболевания;
· консультации других узких специалистов – по показаниям.
Профилактические мероприятия:
· Профилактика послеоперационных, цитотоксических, постлучевых осложнений – сопроводительная терапия (антибактериальная, антиэметогенная, колониестимулирующая, дезинтоксикационная, дегидратационная, гормонотерапия, и т.д.).
Мониторинг состояния пациента:
· оказание консультативной и диагностической помощи больным со ЗНО и с подозрением на них и, при необходимости, направление больного в онкологический диспансер;
· лечение в соответствии со стандартами оказания медицинской помощи больным со ЗНО;
· диспансерное наблюдение за больными со ЗНО и некоторыми формами предопухолевых заболеваний;
· консультации и патронаж на дому больных со ЗНО (по показаниям);
· контроль за своевременной госпитализацией больных для специального, паллиативного и симптоматического лечения, анализ причин отказов от госпитализации;
· анализ и разбор диагностических ошибок с врачами амбулаторно-поликлинических учреждений;
· методическая помощь врачам общей сети по организации профилактических осмотров, диспансеризации больных с предопухолевыми и хроническими заболеваниями, санитарно-просветительной работы среди населения;
· в день установления диагноза направляется учетная форма “Извещение о больном впервые в жизни установленным диагнозом злокачественного новообразования”в онкологическое учреждение регионального уровня (областное, республиканское, краевое) по месту постоянного жительства больного в 3-дневный срок с момента заполнения.
Индикаторы эффективности лечения:
Для первичных пациентов:
· своевременное направление пациента в специализированное учреждение.
Для пациентов получающих химиотерапию:
· эффективность лечения оценивается по критериям Lugano (смотреть Приложение 4, настоящего КП)
Лечение (скорая помощь)
ДИАГНОСТИКА И ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ
Диагностические мероприятия:сбор жалоб и анамнеза.
Медикаментозное лечение:симптоматическая терапия.
Лечение (стационар)
ЛЕЧЕНИЕ НА СТАЦИОНАРНОМ УРОВНЕ
Тактика лечения[4],[8],[10]:
Лечебная тактика определяется распространенностью (стадией) заболевания, морфологическим вариантом/пролиферативной фракцией опухоли, возрастом и соматическим статусом пациента. Определяющим в стратификации паицентов является возможность проведения высокодозной индукционной ПХТ/консолидации аутологичнойТСКК.
Фолликулярная лимфома:
ФЛ grade III является областью споров. На сегодняшний день, клинически значимых различий между ФЛ класса IIIa и IIIb не доказано. В связи с чем, независимо от подтипа, ФЛ gradeIII в плане диагностики и лечения необходимо рассматривать как ДВККЛ (смотреть пункт 12 подпункт 5 «Основные принципы и лечебная тактика при диффузной В-крупноклеточной лимфоме»).
Диффузная В-крупноклеточная лимфома, основные принципы:
· лечебная стратегия строиться в соответствии с возрастом больного, показателями IPI, aaIPI, а также возможностью проведения дозо-интенсифицированных программ;
· при наличии большой опухолевой массы должны быть приняты меры для профилактики тумор-лизис синдрома;
· следует избегать редукции доз препаратов для профилактики гематологической токсичности;
· назначения колоние-стимулирующих факторов при фебрильной нейтропении является полностью оправданным у пациентов, получающих терапию с целью излечения;
Интраваскулярная (внутрисосудистая) диффузная В-крупноклеточная лимфома:
Консенсуса по единой тактике не достигнуто. Оправдано использование тех же схем химиотерапии, что и при других вариантах В-крупноклеточных лимфом (смотреть пункт 12, подпункт 5 «Основные принципы и лечебная тактика при диффузной В-крупноклеточной лимфоме»).
Лимфобластная лимфома, основные принципы:
· различия между острыми лимфобластными лейкозами и лимфобластными лимфомами заключаются только в процентном содержании опухолевых клеток в костном мозге, поэтому тактика лечения одинаково — смотреть протокол диагностики и лечения «Острый лимфобластный лейкоз у взрослых;
· лечение взрослых больных проводится по схемам, разработанным для детских острых лимфобластных лейкозов (с профилактикой нейролейкоза), пятилетняя выживаемость составляет около 40%;
· при лимфобластной лимфомецентральная нервная система это основная мешень развития рецидивов, в связи с чем облучение головы и интратекальное введение цитостатиков обязательно;
· начало индукционной терапии не следует откладывать для получения результатов ПЭТ/КТ-сканирования.
Лимфома Беркитта:
Являясь самой быстро растущей из всех злокачественных новообразований, ЛБ отличается высокой химиочувствительностью. У 80-90% больных удается получить длительные полныеклинико-гематологические и цитогенетические ремиссии при проведении программинтенсивной высокодозной полихимиотерапии (ПХТ).
Основные принципы:
· основной метод лечения лимфомы Беркитта – химиотерапия;
· показанием к началу специфической терапии является установленный диагноз ЛБ. Лечение должно быть начато в кратчайшие сроки и проводиться в режиме оказаниянеотложной медицинской помощи. Необходимо экстренное купирование имеющихсяхирургических осложнений (кишечная непроходимость, кровотечения, перфорация),коррекция электролитных нарушений, купирование инфекционных осложнений, болевогосиндрома. При наличии ОПН химиотерапия должна быть начата на фоне ежедневных сеансовгемодиализа;
· в связи с неблагоприятным прогнозом и склонностью к ранней диссеминации, при лечении лимфомы Беркитта используется многокомпонентная химиотерапия с соблюдением принципов лечения острого лимфобластного лейкоза и использования высоких доз метотрексата.В настоящее время основным методом лечения ЛБ является короткая импульснаявысокоинтенсивная химиотерапия +/- ритуксимаб. При редко встречающихся локальныхстадиях заболевания количество курсов химиотерапии редуцировано в соответствии спротоколами. К факторам плохого прогноза, требующим интенсификации терапии, относят:
— поражение костного мозга и ЦНС;
— повышение ЛДГ> 2 верхнихграниц нормальных значений;
— поражение почек, костей (мультифокальные очаги);
— размеропухоли более 10 см.
Большинство больных ЛБ на момент начала лечения имеютгенерализованные стадии заболевания и факторы плохого прогноза;
· основным правилом в терапии ЛБ является соблюдение принципа “интервал-дозы”, т.е. проведение курса в полных дозах с соблюдением межкурсового интервала. За исключениемситуаций развития жизнеугрожающих осложнений не рекомендуется прерывать начатый курс химиотерапии. В исключительных случаях при наличии тяжелых инфекционных осложнений, скоторыми не удалось справиться к окончанию межкурсового перерыва, возможно увеличениеинтервала между курсами;
· к обязательным компонентам лечения относится профилактика поражения ЦНС, исключение – больные I стадии, а также случаи после радикального удаления интраабдоминальных опухолей
Диффузная В-крупноклеточная лимфома, трансформированная: лечебная тактика– (смотреть стационарный уровень «Основные принципы и лечебная тактика при диффузной В-крупноклеточной лимфоме»).
Первичная медиастенальная В-крупноклеточнаялимфома:
Опухоль чувствительна к интенсивной химиотерапии с консолидирующей лучевой терапией, однако длительность ремиссии строго коррелирует с исходной стадией. Прогноз отчетливо ухудшается при распространении опухоли за пределы средостения в грудную и брюшную полости.
Основные принципы и лечебная тактика – смотреть стационарный уровень «Основные принципы и лечебная тактика при диффузной В-крупноклеточной лимфоме»).
ALK+ крупноклеточная лимфома:
Лечебная тактика – (смотреть стационарный уровень «Основные принципы и лечебная тактика при диффузной В-крупноклеточной лимфоме»).
Вопрос о проведении высокодозной химиотерапии с трансплантацией аутологичных стволовых клеток и лучевой терапии решается индивидуально.
Т-клеточная богатая гистиоцитами крупно-клеточная лимфома:
Лечебная тактика – (смотреть стационарный уровень «Основные принципы и лечебная тактика при диффузной В-крупноклеточной лимфоме»).
Немедикаментозное лечение:
· Режим: общеохранительный.
· Диета: Стол №15. Нейтропеническим пациентам не рекомендуется соблюдать определенную диету (УДВ).
При почечной недостаточности используется диета №7[11],[12],[13],[14],[15].
Медикаментозное лечение:
Перечень основных лекарственных средств:
Антинеопластические и иммуносупрессивные лекарственные средства:
· бендамустин, порошок для приготовления раствора для инъекций 25мг, 100 мг;
· брентуксимаб ведотин, порошок для приготовления раствора для инъекций 50 мг;
· винбластин, лиофилизат для приготовления раствора для внутривенного введения 5 мг;
· виндезин* — лиофилизированный порошок для инъекционных растворов во флаконах по 1 мг и 5 мг;
· винкристин, 1 мг, для инъекций;
· винорельбин, концентрат для приготовления раствора для внутривенных инфузий 10 мг/1 мл, 50 мг/5 мл; капсулы мягкие 20 мг, 30 мг;
· гемцитабин, лиофилизат для приготовления раствора для инфузий 1500мг, 1000 мг, 200 мг;
· даунорубицин, порошок лиофилизированный для приготовления раствора для инъекций или раствор для внутривенного введения 20мг;
· дексаметазон, раствор для инъекций 4мг/мл 1 мл;
· доксорубицин, для инфузий, 10мг и 50 мг;
· ифосфамид*, порошок для приготовления раствора для инъекций 1000мг;
· карбоплатин, раствор для инъекций 150мг/15мл, 450мг/45мл; концентрат для приготовления раствора для инфузий 10 мг/мл, 150 мг/15 мл;
· леналидомид, капсулы 5 мг, 10 мг, 15 мг и 25 мг;
· метилпреднизолон, порошок для приготовления раствора для внутривенных инфузий, 250 мг;
· метотрексат, раствор для инъекций10 мг/ 0,5мл, 15 мг/0,75 мл, 50 мг/мл, таблетки 2.5 мг
· митоксантрон, концентрат для приготовления раствора для внутривенных инфузий 10 мг/5 мл, 20 мг/10 мл, 25 мг/12,5 мл, 30 мг/15 мл;
· оксалиплатин,лиофилизат/порошок для приготовления раствора для инъекций 50 мг и 100 мг
· пегилированный липосомальный доксорубицин*, концентрат для приготовления раствора для внутривенного введения 20 мг/10 мл, 50мг/25мл;
· преднизолон*, раствор для инъекций 30мг/мл, таблетки 5 мг;
· преднизон*, таблетки 1 мг, 5 мг, 20 мг, 50мг.
· прокарбазин *, капсулы 50 мг;
· ритуксимаб, концентрат для приготовления раствора для внутривенных инфузий 10мг/50мл, 10мг/10мл;
· талидомид*, таблетки 25 мг, 50 мг, 100 мг;
· циклофосфамид, лиофилизат/порошок для приготовления раствора для инъекций 200 мг, 500 мг, 1000 мг;
· цисплатин*, концентрат для приготовления раствора для инфузий 0.5 мг/мл, 50 мг/100 мл;
· цитарабин, порошок лиофилизированный для приготовления раствора для инъекций 100 мг, 1000 мг;
· этопозид, концентрат для приготовления раствора для внутривенных инфузий 100 мг/5 мл.
Перечень дополнительных лекарственных средств:
Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов:
· кальция фолинат ИЛИ натрия фолинат, раствор
· омепразол, порошок лиофилизированный для приготовления раствора для инъекций 40 мг;
· ондансетрон, раствор для инъекций 8 мг/4мл;
· памидроновая кислота* 90мг/10мл, концентрат для приготовления раствора для инфузий;
· трамадол 100мг/2 мл, раствор для инъекций (после регистрации);
· урометиксан;
· фамотидин, порошок лиофилизированный для приготовления раствора для инъекций 20 мг;
· филграстим, раствор для инъекций 0,3мг/мл,1 мл.
Антибактериальные средства:
· азитромицин, таблетка/капсула, 500 мг; порошок лиофилизированный для приготовления раствора для внутривенных инфузий, 500 мг;
· амикацин, порошок для инъекций, 500 мг/2 мл или порошок для приготовления раствора для инъекций, 0,5 г;
· амоксициллин/клавулановая кислота, таблетка, покрытая пленочной оболочкой, 1000мг;порошок для приготовления раствора для внутривенного и внутримышечного введения 1000 мг+500 мг;
· ванкомицин, порошок/лиофилизат для приготовления раствора для инфузий 1000 мг;
· гентамицин, раствор для инъекций 80мг/2мл 2мл;
· имипинем, циластатин порошок для приготовления раствора для инфузий, 500 мг/500 мг;
· левофлоксацин, раствор для инфузий 500 мг/100 мл;таблетка, 500 мг;
· линезолид,раствор для инфузий2 мг/мл;
· меропенем, лиофилизат/порошок для приготовления раствора для инъекций 1,0 г;
· моксифлоксацин, таблетка, 400 мг;раствор для инфузий 400 мг/250 мл
· офлоксацин, таблетка, 400 мг;раствор для инфузий 200 мг/100 мл;
· пиперациллин, тазобактам порошок для приготовления раствора для инъекций 4,5г;
· тигециклин*,лиофилизированный порошок для приготовления раствора для инъекций 50 мг/флакон;
· тикарциллин/клавулановая кислота, порошок лиофилизированный для приготовления раствора для инфузий 3000мг/200мг;
· цефепим, порошок для приготовления раствора для инъекций 500 мг;1000 мг;
· цефоперазон, сульбактам порошок для приготовления раствора для инъекций 2 г;
· ципрофлоксацин, раствор для инфузий 200 мг/100 мл, 100 мл; таблетка, 500 мг;
· эритромицин, таблетка 250мг;
· эртапенем лиофилизат, для приготовления раствора для внутривенных и внутримышечных инъекций 1 г.
Противогрибковые лекарственные средства:
· амфотерицин В*,лиофилизированный порошок для приготовления раствора для инъекци, 50 мг/флакон;
· анидулофунгин, лиофилизированный порошок для приготовления раствора для инъекций, 100 мг/флакон;
· вориконазол, порошок для приготовления раствора для инфузий 200 мг/флакон;таблетка, 50 мг;
· итраконазол, раствор для приема внутрь10мг/мл 150,0;
· каспофунгин, лиофилизат для приготовления раствора для инфузий 50 мг;
· колистиметат натрия*, лиофилизат для приготовления раствора для инфузий 1 млн. ЕД/флакон;
· метронидазол, таблетка, 250 мг; раствор для инфузий 0,5% 100мл;
· микафунгин, порошок лиофилизированный для приготовления раствора для инъекций 50 мг, 100 мг;
· флуконазол, капсула/таблетка 150 мг;раствор для инфузий 200 мг/100 мл, 100 мл.
Противовирусные лекарственные средства:
· ацикловир, крем для наружного применения, 5% — 5,0;таблетка, 400 мг; порошок для приготовления раствора для инфузий, 250 мг;
· валацикловир, таблетка, 500мг;
· вальганцикловир, таблетка, 450мг;
· ганцикловир*, лиофилизат для приготовления раствора для инфузий 500мг;
· фамцикловир, таблетки,500мг №14.
Лекарственные средства, применяемые при пневмоцистозе:
· сульфаметоксазол/триметоприм, концентрат для приготовления раствора для инфузий (80мг+16мг)/мл, 5 мл; таблетка 480 мг.
Дополнительные иммуносупрессивные лекарственные средства:
· дексаметазон, раствор для инъекций 4мг/мл 1 мл;
· метилпреднизолон, таблетка, 16 мг;
· преднизолон, раствор для инъекций 30 мг/мл 1мл; таблетка, 5 мг.
Растворы, применяемые для коррекции нарушений водного, электролитного и кислотно-основного баланса, парентерального питания:
· альбумин, раствор для инфузий 10 % — 100мл, 20 % — 100 мл;
· вода для инъекций, раствор для инъекций 5мл;
· декстроза, раствор для инфузий 5% — 250мл, 500мл;
· декстроза, раствор для инъекций 40% — 10 мл, 20 мл;
· калия хлорид, раствор для внутривенного введения 40мг/мл, 10мл;
· кальция глюконат, раствор для инъекций 10%, 5 мл;
· кальция хлорид,раствор для инъекций 10% 5мл;
· магния сульфат, раствор для инъекций 25% 5 мл;
· маннитол, раствор для инъекций 15%-200,0;
· натрия хлорид, раствор для инфузий 0,9% — 250мл, 500мл;
· натрия хлорид, калия хлорид, натрий уксуснокислый раствор для инфузий во флаконе 200мл, 400мл;
· натрия хлорид, калия хлорид, натрия ацетат раствор для инфузий 200мл, 400мл;
· натрия хлорид, калия хлорид, натрия гидрокарбонат раствор для инфузий 400мл;
· L-аланин, L-аргинин, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизина гидрохлорид, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин, L-валин, натрия ацетат тригидрат, натрия глицерофосфата пентигидрат, калия хлорид, магния хлорид гексагидрат, глюкоза, кальция хлорид дигидрат, оливкового и бобов соевых масел смесь эмульсия д/инф.: контейнеры трехкамерные 2 л;
· гидроксиэтилкрахмал (пентакрахмал), раствор для инфузий 6 % 500 мл;
· комплекс аминокислот, эмульсия для инфузий, содержащая смесь оливкового и соевого масел в соотношении 80:20, раствор аминокислот с электролитами, раствор декстрозы, с общей калорийностью 1800 ккал 1 500 мл трехсекционный контейнер;
· нутрикомп* 500 мл в контейнерах.
Лекарственные средства, применяемые для проведения интенсивной тепрапии (кардиотонические средства для лечения септического шока, миорелаксанты, вазопрессоры и средства для наркоза):
· аминофиллин, раствор для инъекций 2,4%, 5 мл;
· амиодарон, раствор для инъекций, 150 мг/3 мл;
· атракурийбезилат, раствор для инъекций, 25мг/2,5мл;
· атропин, раствор для инъекций, 1 мг/ мл;
· диазепам, раствор для внутримышечного и внутривенного применения 5мг/мл 2мл;
· добутамин*,раствор для инъекций 250 мг/50,0 мл;
· допамин, раствор/концентрат для приготовления раствора для инъекций 4% , 5 мл;
· инсулин простой;
· кетамин, раствор для инъекций 500 мг/10 мл;
· морфин, раствор для инъекций 1% 1мл;
· норэпинефрин*,раствор для инъекций 20мг/мл 4,0;
· пипекурониябромид, порошок лиофилизированный для инъекций 4 мг;
· пропофол,эмульсия для внутривенного введения 10 мг/мл — 20 мл, 50 мл;
· рокурониябромид, раствор для внутривенного введения 10мг/мл, 5 мл;
· тиопенталнатрий, порошок для приготовления раствора для внутривенного введения 500мг;
· фенилэфрин, раствоp для инъекций 1% 1мл;
· человеческий нормальный иммуноглобулин, раствор для инфузий;
· эпинефрин, раствор для инъекций 0,18 % 1 мл.
Лекарственные средства, влияющие на свертывающую систему крови:
· аминокапроновая кислота, раствор 5%-100 мл;
· антиингибиторныйкоагулянтный комплекс, лиофилизированный порошок для приготовления инъекционного раствора, 500 МЕ;
· гепарин, раствор для инъекций 5000 МЕ/мл — 5 мл, гель в тубе 100000ЕД 50г;
· губка гемостатическая, размер 7*5*1;
· губка гемостатическая рассасывающаяся, размер 8*3;
· надропарин, раствор для инъекций в предварительно наполненных шприцах, 2850 МЕ анти-Ха/0,3 мл, 5700 МЕ анти-Ха/0,6 мл;
· эноксапарин, раствор для инъекций в шприцах 4000 анти-Ха МЕ/0,4 мл, 8000 анти-Ха МЕ/0,8 мл.
Другие лекарственные средства:
· амброксол, раствор для инъекций, 15 мг/2 мл,раствор для приема внутрь и ингаляций, 15мг/2мл — 100мл;
· амброксол, раствор для приема внутрь и ингаляций, 15мг/2мл, 100мл;
· амлодипин, таблетка/капсула 5 мг;
· атенолол, таблетка 25мг;
· ацетилцистеин,порошок для приготовления раствора для приема внутрь, 3 г;
· бупивакаин, раствор для инъекций 5 мг/мл, 4 мл;
· гепарин, гель в тубе 100000ЕД 50г;
· дексаметазон, капли глазные 0,1% 8 мл;
· дифенгидрамин, раствор для инъекций 1% 1 мл;
· дротаверин, раствор для инъекций 2%, 2 мл;
· иммуноглобулин человека нормальный [IgG+IgA+IgM]раствор для внутривенного введения 50 мг/мл- 50 мл;
· каптоприл,таблетка 50мг;
· кетопрофен, раствор для инъекций 100 мг/2мл;
· клотримазол, крем для наружного применения 1% 30г,раствор для наружного применения 1% 15мл;
· клотримазол, крем для наружного применения 1% 30г;
· клотримазол, раствор для наружного применения 1% 15мл;
· лактулоза, сироп 667г/л по 500 мл;
· левомицетин, сульфадиметоксин, метилурацил, тримекаин мазь для наружного применения 40г;
· лидокаин, раствор для инъекций, 2% по 2 мл;
· лизиноприл, таблетка 5мг;
· метилурацил, мазь для местного применения в тубе 10% 25г;
· метронидазол, гель стоматологический 20г;
· нафазолин, капли в нос 0,1% 10мл;
· ницерголин, лиофилизат для приготовления раствора инъекций 4 мг;
· омепразол, капсула 20 мг,порошок лиофилизированный для приготовления раствора для инъекций 40 мг;
· омепразол, порошок лиофилизированный для приготовления раствора для инъекций 40 мг;
· повидон– йод, раствор для наружного применения 1 л;
· прокаин, раствор для инъекций 0,5% по 10 мл;
· сальбутамол, раствор для небулайзера 5мг/мл-20мл;
· смектит диоктаэдрический, порошок для приготовления суспензии для приема внутрь 3,0 г;
· спиронолактон,капсула 100 мг;
· тобрамицин, капли глазные 0,3% 5мл
· торасемид,таблетка 10мг;
· трамадол, раствор для инъекций 100 мг/2мл,раствор для приема внутрь (капли) 100 мг/1 мл 10 мл(после регистрации);
· трамадол, таблетки 50 мг(после регистрации);
· фамотидин, порошок лиофилизированный для приготовления раствора для инъекций 20 мг;
· фенобарбитал, таблетка 100мг;
· фентанил, система терапевтическая трансдермальная 75 мкг/ч (для лечения хронических болей у онкологических больных) ;
· фолиевая кислота, таблетка, 5 мг;
· фуросемид, раствор для инъекций 1% 2 мл;
· хлорамфеникол, сульфадиметоксин, метилурацил, тримекаин мазь для наружного применения 40г;
· хлоргексидин, раствор 0,05% 100мл
· хлоропирамин, раствор для инъекций 20 мг/мл 1мл.
Лечебная тактика при диффузной В-крупноклеточной лимфоме [8]
Основные режимы ХТ при ДВККЛ
| Первая линия терапии | • RCHOP[16],[18], [19], (УДB); • Dose-adjusted EPOCH[20], [21], [22], (УДС); • Dose-adjustedEPOCH+ Леналидомид (илиТалидомид) +- Ритуксимаб(для non-GCB типа)[60], [61], [62], (УДС). |
| Первая линия терапии для пациентов с признаками СН | • RCEPP[23],(УД С); • DA-EPOCH[20], [21], [22],(УД С); • RCEOP[24],(УД С). |
| Первая линия терапии для пациентов старше 60 лет | • R-mini-CHOP[25], (УДС); • RGCVP[26], (УД С). |
| Вторая линия терапии (для кандидатов на ВДХТ) | • DHAP[27], [28],(УД С); • ESHAP[29], [30],(УД С); • GDP[31], [32],(УД С); • GemOx[33],(УД С); • ICE[34], [35], [36],(УД С); • MINE[37],(УДD). |
| Вторая линия терапии (дляпациентов НЕ являющихся кандидатами на ВДХТ) | • Бендамустин+/-ритуксимаб [38], [39], [40], (УДB); • Брентуксимаб ведотин для CD30-положительных нозологий[41], (УДB); • CEPP[23], (УД С); • CEOP[24], (УД С); • DA-EPOCH +/- Ритуксимаб[20], [21], [22],(УД С); • GDP +/- Ритуксимаб[31], [32] (УД С); • Леналидомид +/- Ритуксимаб (для non-GCB типа) [42], [43], [44], (УДB); • Ритуксимаб[24], [25], [26], [33], (УД С). |
При ДВККЛ лечебная стратегия определяется в зависимости от распространенности опухолевого процесса (в соответствии с классификацией AnnArbor- смотреть Алгоритм 1.Инициальная терапия ДВККЛ).
Экстранодальные формы ДВККЛ требующие специального терапевтического подхода[4]:
Терапия первичной лимфомы ЦНС должна содержать высокие дозы метотрексата. Добавление высоких доз цитарабина повышает процент полных ремиссий и результаты лечения в целом. Лечение проводится с применением лучевой терапии — смотреть клинический протокол диагностики и лечения «Первичные лимфомы центральной нервной системы».
Первичная лимфома с поражением яичек характеризуется высоким риском рецидивов с преимущественным вовлечением экстранодальных зон.
Профилактика поражения ЦНС у данной категории пациентов является обязательной. При локализованной форме желательно облучение контрлатерального яичка с профилактической целью.

Алгоритм 1. Инициальная терапия ДВККЛ[63]:
По завершению инициальной терапии, показано проведение рестадирования. Оценку эффективности проведенной терапии необходимо проводить согласно критериям Lugano (смотреть Приложение 4, настоящего КП). Дальнейшая тактика определяется результатами рестадирования (см. Алгоритмы 2 и 3).

Алгоритм 2. Лечебная тактика для ДВККЛ StageI и II после завершения инициальной терапии[63].

Алгоритм 3. Лечебная тактика для ДВККЛ StageIII и IV после завершения инициальной терапии[63].

Алгоритм 4. Тактика лечения рефрактерных и рецидивирующих форм ДВККЛ[63]
Рецидивные или рефрактерные диффузные В-крупноклеточныелимфомы[4]:
В общей сложности у >30% больных развиваются рецидивы ДВККЛ. Частота встречаемости в Европейском союзесоставляет 1/100 тыс. чел. в год.
Диагностика: Рецидив должен быть в любом случае подтвержден гистологически, особеннопри возникновении ≥12 месяцев после установления первоначального диагноза.
Стадирование и оценка риска: Пациентам, которым планируется проведение терапии с целью излечения,следует проводить стадирование рецидива, идентичное таковому для первичной опухоли.
Лечение: Соматически сохранным пациентам, без выраженных функциональных нарушений в возрасте Выбор режима высокодозной терапии зависит от имеющегося у конкретного учреждения опыта по проведению подобного лечения. Наиболее часто используется программа BEAM (кармустин, этопозид, цитозин-арабинозин и мелфалан). Дополнительноможет быть использована лучевая терапия (на зоны исходного поражения), особеннопри ограниченном характере опухолевого процесса. Эффективность метода, однако,не рассматривалась в контролируемых исследованиях.
Пациенты, не подходящие для высокодозной химиотерапии могут быть лечены по альтернативным схемам второй линии, также комбинированным с лучевой терапией на области поражения.
Особенности ведения отдельных подтипов ДВККЛ:
Первичная медиастенальнаяВ-крупноклеточная лимфома[8]:
Предпочтительные схемы лечения (в порядке значимости):
— DA-EPOCH-R х 6 курсов (с целью уменьшения возникновения локального рецидива может быть добавлена лучевая терапия);
— RCHOPх 6 курсов + ЛТ;
— RCHOPх 4 курса, с последующей консолидацией по схеме ICE х 3 курса +/- ЛТ.
Если при завершении инициальной химиотерапии имеется негативная ПЭТ/КТ-картина, а в дебюте заболевания отсутствуют Bulky, то в качестве дальнейшей тактики может быть рассмотрена «watchandwait».
ПЭТ/КТ –исследование это базовый метод оценки эффективности проведенной терапии при ПМВККЛ.
Довольно часто после окончания лечения имеют место резидуальные медиастенальные массы. Биопсия таких ПЭТ/КТ-позитивных образований оправдана, если предполагается дополнительное системное лечение.
Лимфома серой зоны (промежуточная между ДВККЛ и кЛХ) [8]:
Прогноз при данном подтипе ДВККЛ хуже, чем при кЛХ или ПМВККЛ. Единой стратегии лечения в данном случае не разработано. Предпочтительными являются схемы лечения агрессивных ДВККЛ. Если опухолевые клетки экспрессируют CD20+, то следует рассмотреть включение ритуксимаба в схему лечения.
Double—HitЛимфома[8]:
Прогноз крайне неблагоприятный. Пока стандарта лечения не разработано, согласно рекомендациям NCCN`3.2016 оправдано использование следующих химиотерапевтических режимов:
· DA-EPOCH-R;
· R-HyperCVAD;
· R-CODOX-M/R-IVAC.
Использование R-CHOP при DHдает неутешительные результаты.
В качестве консолидирующей терапии возможно рассмотреть ВДХТ+аутоТКМ.
Лимфома Беркитта[5]:
Первая линия терапии:
В первой линии лечения рекомендовано применение интенсивных протоколов ПХТ. Вразных странах предложены программы риск-адаптированной терапии ЛБ приблизительноодинаковой эффективности, основой которых являются протоколы, разработанные впедиатрической практике в 80-90 гг. XX века.
В настоящее время для лечения ЛБ могут быть рекомендованы следующие протоколы ПХТ:
· R-Hyper-CVAD[45],[46];
· ЛБ-М-04+/-R[47];
· LMB 95[48];
· CODOX-M/IVAC+/-R [48],[49],[50],[51],[52];
· CALGB10002 [53].
Пациентам старшей возрастной группы без поражения ЦНС (не кандидатам дляинтенсивной ПХТ) может быть проведено лечение по протоколу R-DA-EPOCH[54].
Терапия ЛБ у пациентов, инфицированных ВИЧ, проводится по аналогичным протоколамна фоне постоянного приема ВААРТ. Также могут использоваться программы R-DA-EPOCH, RCDE,SC-EPOCH-RR, особенно у пациентов с тяжелой сопутствующей патологией. В связи с увеличением риска инфекционных осложнений и высоким риском смерти от них ритуксимаб не рекомендуется вводить ВИЧ-инфицированным пациентам при количестве CD4клеток менее 100/мкл [55] [56][57].
Обязательна профилактика нейролейкемии путем интратекального введения 3препаратов (цитозар 30 мг, метотрексат 15 мг, дексаметазон 4 мг) 1 раз за курс в течение всегопериода терапии. Лечение нейролейкемии проводят в соответствие со стандартнымиправилами: люмбальные пункции с введением цитостатиков выполняют 3 раза в неделю дополучения 3 нормальных анализов ликвора. На последующих блоках химиотерапии (послесанации ликвора) люмбальные пункции с интратекальным введением цитостатиков проводятдважды за курс.
Всем пациентам с ЛБ показано установление центрального венозного катетера.
При проведении первого курса терапии обязательны профилактика и лечение синдромамассивного цитолиза опухоли: аллопуринол 10 мг/кг/сут. перорально и инфузионная терапия 3л/м2/сут. с защелачиванием р-ром соды 40-80 ммоль/л под контролем диуреза и плановымназначением фуросемида, лабораторным контролем кислотно-основного состояния.
При применении высоких доз метотрексата рекомендован контроль его элиминации(NB! определение концентрации в сыворотке) и коррекция дозы лейковорина.
Лучевая терапия и поддерживающая терапия пациентам с ЛБ не проводится.
Вторая линия:
При наличии первично-резистентной ЛБ (прогрессирование заболевания, ранний
рецидив) эффективность терапии второй и последующих линий минимальна. Рецидивы ЛБ, какправило, развиваются в первые 6-9 мес. после завершения лечения, поздние рецидивы крайнередки. В качестве терапии второй линии возможно использование режима R-ICE (приэффективности показано проведение трех курсов), либо других курсов интенсивнойиммунохимиотерапии, содержащей препараты, ранее не использовавшиеся у больного[58],(УД D).
В настоящее время описаны единичные случаи достижения второй ремиссии с
последующей эффективной ауто/аллогенной трансплантацией костного мозга. Большинстворецидивов ЛБ инкурабельны. Высокодозная химиотерапия и трансплантация костного мозгамогут быть рекомендованы при достижении 2-й ремиссии. В первой ремиссии трансплантациякостного мозга не показана.
При лечении рецидивов необходима профилактика нейролейкемии по той жепрограмме, что и при лечении первичных больных.
Лучевая терапия[6][11]:
Рекомендуемая суммарная доза облучения для ДВВКЛ:
· в консолидации после химиотерапии: 30-36Гр;
· лучевая терапия в качестве первой линии терапии для рефрактерных форм и для пациентов, не являющихся кандидатами для проведения химиотерапии: 40-55Гр;
· в комбинации с ВДХТ+аутоТКМ: 20-36Гр.
Клинические и технические требования к проведению ЛТ (смотреть Приложение 6, настоящего КП).
Трансплантация [11]
Высокодозная химиотерапия и последующая аутотрансплантация гемопоэтическихстволовых клеток (аутоТГСК) является эффективным методом лечения пациентов с множественной миеломой, рецидивами и первично-резистентными формами лимфом.[1]
Показания к ТГСК:
Европейской группой по трансплантации костного мозга и крови (EBMT) определены следующие показания для ТГСК при неходжкинских лимфомах (2014год).
| Диагноз | Статус | Совместимая родственная алло ТГСК | Совместимая неродственная алло ТГСК | Несовместимая по1 антигену неродственная илинесовместимая родственная аллоТГСК | аутоТГСК |
| ХЛЛ | Плохой пргоноз | Стандарт | Стандарт | Метод разрабатывается | Терапевтическая опция |
| ДВККЛ | Первая ремиссия | Обычно не рекомендуется | Обычно не рекомендуется | Обычно не рекомендуется | Терапевтическая опция |
| Вторая или более полная/частичная ремиссия | Терапевтическая опция | Терапевтическая опция | Обычно не рекомендуется | Стандарт | |
| Химиочувствительный рецидив после ауто ТГСК | Стандарт | Стандарт | Терапевтическая опция | Обычно не рекомендуется | |
| Рефрактерность | Терапевтическая опция | Терапевтическая опция | Метод разрабатывается | Обычно не рекомендуется | |
| ЛЗМ | ПР1 | Терапевтическая опция | Метод разрабатывается | Обычно не рекомендуется | Стандарт |
| Химиочувствительный рецидив, ≥ПР2 | Терапевтическая опция | Метод разрабатывается | Обычно не рекомендуется | Обычно не рекомендуется | |
| Рефрактерность | Метод разрабатывается | Метод разрабатывается | Обычно не рекомендуется | Обычно не рекомендуется | |
| ФЛ | ПР1 | Обычно не рекомендуется | Обычно не рекомендуется | Обычно не рекомендуется | Терапевтическая опция |
| Химиочувствительный рецидив, ≥ПР2 | Терапевтическая опция | Терапевтическая опция | Метод разрабатывается | Стандарт | |
| Рефрактерность | Терапевтическая опция | Терапевтическая опция | Метод разрабатывается | Обычно не рекомендуется |
Противопоказания к ТГСК[59]:
Основное противопоказание к аутоТГСК – это доказанная химиорезистентность ко второй линии терапии. АллоТГСК противопоказана при активной лимфоме с большой опухолевой массой. Кроме того, противопоказаниями для проведения как ауто, так и аллоТГСК являются активные инфекции, в том числе грибковые и вирусные, несанированные скрытые очаги инфекций, различные некомпенсированные сопутствующие заболевания сердечно-сосудистой системы, почек, печени, психические заболевания или расстройства, статус Карновского менее80 или ECOG статус выше 2. Следует оценить возможность переносимости высокодозной химиотерапии пациентами старше 60 лет. Рекомендовано ориентироваться не на фактический, а на биологический возраст пациента.
Особенности диагностики и лечения агрессивных ЛПЗ при беременности[5]:
Диагностика лимфом во время беременности
Беременность препятствует полноценному обследованию, т.е. полноценному топографическому описанию болезни привпервые диагностированной лимфоме, так как некоторые дополнительные исследования инвазивны или потенциальнотератогенны. Пункция с последующей биопсией лимфатического узла, цитологическим, гистологическим исследованием и иммунофенотипированием необходимы и обязательны вовсех случаях. Всем женщинам необходимо ультразвуковое исследование всех групппериферических, внутрибрюшных и забрюшинных лимфатических узлов, печени и селезёнки,щитовидной железы при больших лимфатических узлах шеи, а также рентгенография лёгких —обязательно в прямой и боковой проекциях с использованием специального свинцовогофартука для защиты плода. При лимфомах отсутствие изменений в грудной клетке настандартных рентгенограммах, а также очень большие размеры лимфатических узловсредостения у небеременных женщин требуют обязательного выполнения компьютернойтомографии (КТ) грудной клетки. Доза радиации, получаемая плодом во времярадиологических исследований, включающих рентгенографию и КТ грудной клетки, намногониже, чем пороговая доза для повреждающего воздействия на плод. В связи, с чем в сложныхслучаях целесообразно выполнение КТ грудной клетки с соблюдением всех необходимыхусловий для защиты плода. Исследование же с помощью КТ органов брюшной полости ималого таза сопровождаются более высоким уровнем облучения плода и противопоказана вовремя беременности. В таких случаях предпочтение необходимо отдавать более безопаснымметодам исследования: МРТ, УЗИ. Для исключения поражения костного мозга показанатрепанобиопсия подвздошной кости, при некоторых вариантах лимфом — и стернальнаяпункция. Диагностические методы, использующие радиоактивные изотопы (сканирование,ПЭТ) у беременных женщин противопоказаны. Для диагностики рецидива заболеванияиспользуются те же самые исследования.
Тактика ведения беременности у женщин с лимфопролиферативными заболеваниями:
Тактика ведения беременности у женщин с активным течением лимфомы зависит от трёхслагающих: агрессивности лимфомы, времени возникновения беременности (I, II, III триместр) и желания женщины сохранить ребенка. При любых формах, степени агрессивности и стадияхлимфомы возможно три варианта тактики ведения: прерывание беременности, выжидательная тактика или начало противоопухолевой терапии.
Основные принципы:
· сочетание беременности с лимфомой в ремиссии не служит показанием к прерываниюбеременности;
· при выявлении лимфомы во II или III триместрах возможно, если это необходимо, проведение ПХТ во время беременности. Желательно, если это возможно, избегать схемПХТ, содержащих алкилирующие препараты. При проведении ПХТ необходимоназначение низкомолекулярного гепарина с целью профилактики венозныхтромбоэмболических осложнений;
· при выявлении ЛХ в I триместре беременности у женщин с благоприятным и
промежуточным прогнозом (больные с IА и IIА стадиями без факторов риска —
массивного поражения средостения и поражения >4 областей лимфатических
коллекторов) возможна выжидательная тактика и начало лечения во II или III триместребеременности;
· при рецидивирующем течении ЛХ и НХЛ, а также всем женщинам с впервые
диагностированной лимфомой с неблагоприятным прогнозом заболевания, выявленнойв I триместре, показано прерывание беременности;
· во всех случаях возможность сохранения беременности при активном течении ЛХ и НХЛ,сроки начала лечения, а также вопросы выбора схем лечения во время беременности решает только онколог или гематолог[2]. В такой ситуации всегда необходимо стремиться организовать родоразрешение в перинатальных центрах или роддомах с наличием детской реанимации;
· время родоразрешения должно быть определено совместно акушерами и онкологами.Когда это необходимо, плод должен быть извлечён в срок наибольшей безопасности для его здоровья (после 33-34 недель беременности) и здоровья матери. В связи с возможной миелосупрессией как у матери, так и плода полихимиотерапия должна быть отменена за 3 недели до предполагаемого срока родоразрешения. Наиболее благоприятным и безопасным методом родоразрешения на фоне проведения ПХТ являются роды через естественные родовые пути. Оперативное родоразрешение должно проводиться по акушерским показаниям.
| Проблема | Рекомендации |
| Тошнота и рвота | Все препараты из группы 5-НТ3 антагонистов первого поколения обладают схожей эффективностью. Вопрос о возможно большей эффективности препаратов второго поколения изучается. Дексаметазон усиливает эффекты 5-НТ3 антагонистов и в большей степени уменьшает отсроченную тошноту и ровту. При использовании с препаратами второго поколения 5-НТ3 антагонистов доза дексаметазона может быть снижена до 8 мг. Пациентам, которые получают высоко- и средне- эметогенные химиопрепараты рекомендуется назначать NK1 антагонисты. Рекомендуемая схема профилактики тошноты: ондансетрон 8 мг 2 раза в сутки, апрепитант 125 мг 1 р/сутки, 80 мг во 2 и 3 сутки, дексаметазон 12 мг 1 р/сутки. Оланзапин – атипичный нейролептик, который эффективнее,чем апрепитант профилактирует отсроченные тошноту и рвоту. |
| Гранулоцитарный, гранулоцитарно-моноцитарный колониестимулирующие факторы | Не оказывают влияния на общую выживаемость и летальность пациентов с фебрильной нейтропенией. Могут применяться для достижения более полного выполнения протоколов лечения. Филграстим в дозе 5 мкг/кг назначается на следующий или через 3-4 дня после завершения химиотерапии и вводится до повышения уровня нейтрофилов выше надира. Основным показанием для назначения Г(ГМ)-КСФ является мобилизация ГСК для ауто- или аллогенной трансплантации костного мозга. |
| Ассоциированные с лимфомой тромботические и тромбоэмболические осложнения | Смотреть Приложение 7, настоящего КП. |
| Синдром лизиса опухоли | Смотреть Приложение 8, настоящего КП |
| Коррекция водно-электролитных нарушений | Смотреть Приложение 9, настоящего КП |
Основные схемы химиотерапии:
Бендамустин+Ритуксимаб (BR):
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Бендамустин | 90 мг/м2/сут | 1-2 | в/в, в течение 1-2х часов. |
| Ритуксимаб | 375 мг/м2/сут | 1 | в/в, капельно |
| Курс повторяется каждый 21 день (максимально до 8 циклов) | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Брентуксимаб ведотин | 1,8мг/кг/сут | 1 | в/в, капельно, в течение 30 минут. Вводить обязательно сразу после разведения |
| Курсы повторяют каждые 21 сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м2/сут | 1 | в/в, капельно, вводится 1 раз в неделю в течение 4 недель (всего 4 введения) |
| Курс повторяют через 8 недель (при необходимости). | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м2/сут | 1 | в/в, капельно |
| Курс повторяют через 8 недель в течение 2 лет. | |||
R-CHOP:
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м2/сут | 0 или 1 | в/в, капельно |
| Доксорубицин | 50 мг/м2/сут | 1 | в/в, капельно |
| Циклофосфамид | 750 мг/м2/сут | 1 | в/в, капельно |
| Винкристин | 1,4 мг/м2/сут | 1 | в/в (суммарно не более 2 мг) |
| Преднизолон | 100 мг | 1-5 | внутрь |
| Курс повторяют каждые 21 день. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м2/сут | 1 | в/в, капельно |
| Доксорубицин | 25 мг/м2/сут | 1 | в/в, капельно |
| Циклофосфамид | 400 мг/м2/сут | 1 | в/в, капельно |
| Винкристин | 1 мг/сут | 1 | в/в |
| Преднизолон | 40 мг/м2/сут | 1-5 | внутрь |
| Курс повторяют каждые 21 день. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м2/сут | 0 | в/в, капельно |
| Этопозид | 50 мг/м2/сут | 1-4 | непрерывная 96-часовая инфузия |
| Доксорубицин | 10 мг/м2/сут | ||
| Винкристин | 0,4 мг/м2/сут | ||
| Циклофосфамид | 750 мг/м2/сут | 5 | в/в, в течение 1 часа |
| Преднизолон | 60 мг/м2 | 5 | Внутрь, 2 раза в день |
| G-КСФ | 300 мкг | 6-15 | П/к 1р /сут |
| Курс повторяют каждые 21 день. В данной дозировке проводится 1 курс. Далее дозы этопозида, доксорубицина и циклофосфана корректируются относительно предыдущего в зависимости от низшего уровня показателей крови, определенных во время и после проведения курса, по следующей схеме: · нейтрофилы выше 0,5 х 109/л, тромбоциты выше 25 х 109/л – увеличение доз на 25%; · Нейтрофилы менее 0,5 х 109/л при 1-2 измерениях, тромбоциты выше 25 х 109/л – сохранение доз предыдущего курса; · Нейтрофилы менее 0,5 х 109 при 3 и более измерениях, тромбоциты ниже 25 х 109/л – редукция доз на 25%. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м2/сут | 1 | в/в, капельно |
| Циклофосфамид | 750 мг/м2/сут | 1 | в/в, капельно |
| Этопозид | 75 мг/м2/сут | 1 | в/в |
| Винкристин | 1,4 мг/м2/сут | 1 | в/в (суммарно не более 2 мг) |
| Преднизолон | 40 мг/м2/сут | 1-5 | внутрь |
| Курс повторяют каждые 21 день. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м2/сут | 1 | в/в, капельно |
| Циклофосфамид | 600 мг/м2/сут | 1,8 | в/в, капельно |
| Этопозид | 70 мг/м2/сут | 1-3 | в/в |
| Прокарбазин | 60 мг/м2/сут | 1-10 | внутрь |
| Преднизолон | 40 мг/м2/сут | 1-5 | внутрь |
| Курс повторяют каждые 21 день. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ритуксимаб | 375 мг/м2/сут | 0 или 1 | в/в, капельно |
| Гемцитабин | 1 цикл: 750 мг/м2/сут 2 цикл: 850 мг/м2/сут 3 цикл и вск последующие: 1000 мг/м2/сут | 1,8 | в/в 30-минутная инфузия |
| Циклофосфамид | 750 мг/м2/сут | 1 | в/в, капельно |
| Винкристин | 1,4 мг/м2/сут | 1 | в/в (суммарно не более 2 мг) |
| Преднизолон | 100 мг | 1-5 | внутрь |
| G-КСФ | 300 мкг/сут | С 9 го дня цикла до восстановления гранулоцитов | п/к 1 рс/ут |
| Курс повторяют каждые 21 день. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Леналидомид | 25 мг/сут | 1-21 | внутрь |
| Ритуксимаб | 375 мг/м2/сут | 1 | в/в, капельно |
| Курс повторяют каждые 28 дней. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Дексаметазон | 40 мг | 1-4 | в/в или внутрь |
| Цисплатин | 100 мг/м2/сут | 1 | в/в капельно, 24-часовая инфузия |
| Цитарабин | 2000 мг/м2 | 2 | в/в, капельно, в течение 3 часов; 2 раза в день |
| Курсы повторяют каждые 21-28сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Этопозид | 100 мг/м2/сут | 1-3 | в/в, капельно |
| Ифосфамид | 5000 мг/м2 | 2 | в/в, 24-часовая инфузия + урометиксан в аналогичной дозе |
| Карбоплатин | 400 мг/м2/сут | 2 | в/в капельно |
| Курсы повторяют каждые 14 сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Гемцитабин | 1000 мг/м2/сут | 1 и 8 | в/в |
| Винорельбин | 20 мг/м2/сут | 1 и 8 | в/в |
| Пегилированный липосомальный доксорубицин | 15 мг/м2/сут | 1 и 8 | в/в |
| Курсы повторяют каждые 21 сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Гемцитабин | 800 мг/м2/сут | 1 и 8 | в/в |
| Винорельбин | 15 мг/м2/сут | 1 и 8 | в/в |
| Пегилированный липосомальный доксорубицин | 10 мг/м2/сут | 1 и 8 | в/в |
| Курсы повторяют каждые 21 сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Цисплатин | 100 мг/м2/сут | 1 | в/в, капельно |
| Гемцитабин | 1000 мг/м2/сут | 1,8 | в/в, капельно |
| Дексаметазон | 40 мг | 1-4 | внутрь |
| Лечение возобновляется на 22й день | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Этопозид | 40 мг/м2/сут | 1-4 | в/в, капельно, в течение часа |
| Метилпреднизолон | 500 мг/сут | 1-5 | в/в, капельно, в течение 15 минут |
| Цисплатин | 25 мг/м2/сут | 1-4 | в/в, непрерывная 24-часовая инфузия |
| Цитарабин | 2000 мг/м2/сут | 5 | в/в, капельно, в течение 2 часов |
| Курсы повторяют каждые 21-28 сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Ифосфамид | 1330 мг/м2/сут | 1-3 | в/в, капельно |
| Урометиксан | 1330мг/м2/сут | 1-3 | в/в, капельно, в течение часа параллельно с ифосфамидом |
| Урометиксан | 500 мг/сут | 1-3 | Перорально, через 4 часа после оканчания инфузии ифосфамида |
| Этопозид | 65 мг/м2/сут | 1-3 | в/в, капельно, в течение часа |
| Митоксантрон | 8 мг/м2/сут | 1 | в/в, капельно |
| Курсы повторяют каждые 21 сут. | |||
| Название препарата | Расчетная доза | Дни введения | Примечания |
| Гемцитабин | 1000 мг/м2/сут | 1 | в/в, капельно |
| Оксалиплатин | 100 мг/м2/сут | 1 | в/в, капельно |
| Лечение возобновляется на 22й день | |||
Блоковые режимы лечения:
CODOX—M/IVAC:
CODOX-M (циклы 1, 3):
· циклофосфамид 800 мг/м2 в/в, день 1;
· винкристин 1,5 мг/м2 (не более 2 мг) в/в, дни 1, 8;
· доксорубицин 40 мг/м2 в/в, день 1;
· циклофосфамид 200 мг/м2/сут. в/в, дни 2-5;
· цитарабин 70 мг интратекально, дни 1, 3;
· метотрексат 300 мг/м2 в/в в течение 1 часа, далее – 2700 мг/м2 в/в в течение последующих 23 часов (у больных старше 65 лет – 100 мг/м2 в/в в течение 1 часа, далее – 900 мг/м2 в/в в течение последующих 23 часов), день 10;
— метотрексат 12 мг интратекально, день 15;
— лейковорин 15 мг внутрь через 24 часа после интратекального введения метотрексата;
— Г-КСФ 5 мкг/кг подкожно до повышения уровня гранулоцитов > 1× 109/л.
IVAC (циклы 2, 4):
· этопозид 60 мг/м2 (на 500 мл физ. раствора или изотонического раствора глюкозы) в/в, дни 1-5;
· ифосфамид 1,5 г/м2 (у больных старше 65 лет – 1 г/м2) в/в, дни 1-5;
· цитарабин 2 г/м2 (у больных старше 65 лет – 1 г/м2) в/в каждые 12 часов, дни 1-2 (всего 4 введения);
— метотрексат 12 мг интратекально, день 5;
— Г-КСФ подкожно до повышения уровня гранулоцитов > 1× 109/л;
Начало следующего блока – после стабилизации уровня гранулоцитов > 1× 109/л и уровнятромбоцитов > 75× 109/л без поддержки Г-КСФ.
R-HyperCVAD/R-HMA:
Циклы 1, 3, 5, 7 (HyperCVAD):
· циклофосфамид 300 мг/м2, в/в, каждые 12 часов, дни 1-3 (всего 6 введений);
· дексаметазон 40 мг, в/в или внутрь, дни 1-4, 11-14;
· доксорубицин 50 мг/м2, в/в непрерывной 24-часовой инфузией в центральныйкатетер, день 4;
· винкристин 2 мг в/в, дни 4, 11.
Циклы 2, 4, 6, 8 (HMA):
· метотрексат 1000 мг в/в непрерывной 24-часовой инфузией, день 1;
· цитарабин 3 г/м2 (у больных старше 60 лет – 1 г/м2) в/в каждые 12 часов, дни 2-3 (всего 4 введения);
· метилпреднизолон 50 мг в/в каждые 12 часов, дни 1-3 (всего 6 введений);
· ритуксимаб 375 мг/м2 в/в или ритуксимаб 1400 мг п/к (кроме первого введения), дни 1,11 (циклы 1, 3) и дни 2, 8 (циклы 2, 4) – всего 8 введений;
· Профилактика поражения ЦНС проводится на каждом курсе, суммарно 16интратекальных введений:
— метотрексат 12 мг интратекально, день 2;
— цитарабин 100 мг интратекально, день 7.
R-MaxiCHOP/R-HD-AraC:
Циклы 1, 3, 5, (MaxiCHOP):
· циклофосфамид 1200 мг/м2, в/в, день;
· доксорубицин 75 мг/м2 в/в, день;
· винкристин 2 мг в/в, день;
· преднизолон 100 мг в/в или внутрь, дни 1-5.
Циклы 2, 4, 6 (HD-Ara-C):
· цитарабин 3 г/м2 (у больных старше 60 лет – 2 г/м2) в/в каждые 12 часов, дни 1-2 (всего 4 введения);
· ритуксимаб 375 мг/м2 в/в или ритуксимаб 1400 мг п/к (кроме первого введения), день 1каждого цикла.
Лечение возобновляется на 22 день или после восстановления показателей периферическойкрови.
LMB:
Схема лечения:
Группа низкого риска:
· COPAD – COPAD
Группа промежуточного риска:
· COP – COPADM #1 – COPADM #2 – CYM #1 – CYM #2 – m1
Группа высокого риска:
· COP – COPADM #1 – COPADM #2 – CYVE #1– CYVE #2– m1 – (ЛТ 24 Гр припоражении ЦНС) – m2 – m3 – m4
COP:
· циклофосфамид 300 мг/м2 в/в, день 1;
· винкристин 1 мг/м2 (не более 2 мг) в/в, день 1;
· преднизолон 60 мг/м2 внутрь или в/в, дни 1-7;
· метотрексат 15 мг + гидрокортизон 15 мг интратекально, день 1 (в группевысокого риска – в сочетании с цитарабином 30 мг в дни 1, 3, 5).
COPADM:
· винкристин 1,4 мг/м2 (не более 2 мг) в/в, день 1 (+ день 6 в COPADM #2);
· метотрексат 3 г/м2 в/в в течение 3 часов, в группе высоко риска 8 г/м2 в течение4 часов, день 1;
· лейковорин 15 мг/м2 в/в 4 раза в сутки, дни 2-4;
· доксорубицин 60 мг/м2 в/в, день 2;
· циклофосфамид 500 мг/м2 (1000 мг/м2 в COPADM #2) в/в каждые 12 часов, дни;
· 2-4 (всего 6 введений);
· преднизолон 60 мг/м2 в/в или внутрь, дни 1-6;
· метотрексат 15 мг + гидрокортизон 15 мг интратекально, дни 2, 6 (в группевысокого риска в сочетании с цитарабином 30 мг в дни 2, 4, 6).
COPAD:
· винкристин 1,4 мг/м2 (не более 2 мг) в/в, дни 1, 6;
· доксорубицин 60 мг/м2 в/в, день 2;
· циклофосфамид 500 мг/м2 в/в каждые 12 часов, дни 2-4 (всего 6 введений);
· преднизолон 60 мг/м2 в/в или внутрь, дни 1-6.
CYM:
· метотрексат 3 г/м2 в/в в течение 3 часов, день 1;
· лейковорин 15 мг/м2 в/в 4 раза в сутки, дни 2-4;
· цитарабин 100 мг/м2/сут. непрерывная инфузия, дни 2-6;
· метотрексат 15 мг + гидрокортизон 15 мг интратекально, день 2;
· цитарабин 30 мг + гидрокортизон 15 мг интратекально, день 6.
CYVE:
· цитарабин 50 мг/м2 непрерывная 12-часовая инфузия (до высоких дозцитарабина, 20 00 -8 00 ), дни 1-5;
· цитарабин 3 г/м2 в/в (в течение 3 часов, 8 00 -11 00 ), дни 2-5;
· этопозид 200 мг/м2 в/в, дни 2-5 (14 00 -16 00 ).
m1:
· винкристин 1,4 мг/м2 (не более 2 мг) в/в, день 1;
· метотрексат 3 г/м2 в/в, в течение 3 часов (в группе высокого риска 8 г/м2 втечение 4 часов), день 1;
· лейковорин 15 мг/м2 в/в 4 раза в сутки, дни 2-4;
· циклофосфамид 500 мг/м2 в/в, дни 1, 2;
· доксорубицин 60 мг/м2 в/в, день 2;
· преднизолон 60 мг/м2 внутрь, дни 1-5;
· метотрексат 15 мг + гидрокортизон 15 мг интратекально (в группе высокогориска в сочетании с цитарабином 30 мг), день 2.
m3:
m3 — аналогичен m1, но без высоких доз метотрексата и интратекального введенияхимиопрепаратов;
m2, m4:
· этопозид 150 мг/м2 в/в, дни 1-3;
· цитарабин 100 мг/м2/сут. непрерывная 24-часовая инфузия, дни 1-5.
Начало следующего блока – после стабилизации уровня гранулоцитов > 1,5 × 109/л и уровнятромбоцитов > 100 × 109/л без поддержки Г-КСФ.
Интервал между курсами поддерживающий терапии (m1-m4) – 28 дней.
ЛБ-М-04:
Схема лечения: предфаза – А – С – А – С:
Предфаза:
· циклофосфамид 200 мг/м2 в/в, дни 1-5;
· дексаметазон 10 мг/м2 в/в, дни 1-.5
Блок А:
· ифосфамид 800 мг/м2 в/в, дни 1-5;
· метотрексат 1,5 г/м2 в/в (в течение 12 часов), день 1;
· винкристин 2 мг в/в, день 1;
· доксорубицин 50 мг/м2 в/в, день 3;
· цитарабин 150 мг/м2 в/в каждые 12 часов, дни 4-5 (всего 4 введения);
· этопозид 100 мг/м2 в/в, дни 4-5;
· дексаметазон 10 мг/м2 в/в, дни 1-5.
Блок С:
· метотрексат 1,5 г/м2 в/в (в течение 12 часов), день 1;
· винбластин 5 мг/м2 в/в, день 1;
· цитарабин 2 г/м2 в/в каждые 12 часов, дни 2-3 (всего 4 введения);
· этопозид 150 мг/м2 в/в, дни 3-5;
· дексаметазон 10 мг/м2 в/в, дни 1-5.
Профилактику нейролейкемии проводят в 1 день предфазы и в 1 день каждого блока в видеинтратекального введения химиопрепаратов:
· цитарабин 30 мг;
· метотрексат 15 мг;
· преднизолон 30 мг.
Ритуксимаб 375 мг/м2 в/в или ритуксимаб 1400 мг п/к (кроме первого введения) в 0 день каждого блока (всего 4 введения).
Хирургическое вмешательство, с указанием показаний для оперативного вмешательства:
· иссечение глубокого шейного лимфатического узла;
· иссечение подмышечного лимфатического узла;
· иссечение пахового лимфатического узла;
· простое иссечение другой лимфатической структуры;
· локальное иссечение лимфоузла;
· полная спленэктомия;
· биопсия кожи и подкожных тканей.
Цель проведения процедуры/вмешательства: верификация диагноза ЛПЗ
Показания: исключение/подтверждение диагноза ЛПЗ.
Показания для консультации специалистов:
· Консультации узких специалистов – по индивидуальным показаниям.
Показания для перевода в отделение интенсивной терапии и реанимации:нарушение витальных функций.
Индикаторы эффективности лечения[63]:
Эффективность проведенного лечения оценивается с помощью методов лучевой диагностиПЭТ/КТ или КТ с контрастированием (если ПЭТ/КТ недоступно). Критерии ответа (смотреть Приложение 4, настоящего КП).
Оценка эффективности в первом рецидиве:
· адекватное радиологическое исследование (при наличии очагов, исходно определяемых радиологически) должно быть выполнено после 3 — 4 и последнего цикла терапии;
· вовторное исследование костного мозга (аспирация + трепанобиопсия) по окончании терапевтической программы рекомендовано только при наличииисходного поражения;
· выполнение позитронно-эмиссионной томографии (ПЭТ) рекомендуется к обязательному выполнению по окончании всей лечебной программы. В случае позитивного ПЭТ-исследования рекомендуется гистологическое подтверждение наличия активной опухолевой ткани.
Оценка эффективности для рецидивирующих или рефрактерных ДВККЛ
· критерии эффективности терапии аналогичны таковым, применяемым для первой ремиссии. Оценка эффекта должна быть выполнена после 3 — 4 курсов терапии ≪спасения≫ (перед высокодозным лечением) и после окончания всей терапии. Результаты ПЭТ, выполненного перед высокодозным лечением коррелируют с прогнозом.
Дальнейшее ведение [63]:
· рекомендуется проводить сбор анамнеза и тщательное физикальное обследование один раз каждые три месяца на протяжении первых двух лет и затем один раз в год, акцентируя внимание на возможности развития вторичных опухолей и/или отсроченных побочных эффектов химиотерапии (УД D);
· развернутый анализ крови с обязательным определением уровня ЛДГ рекомендуется проводить на 3, 6, 12 и 24 месяцах наблюдения. Далее — только припоявлении подозрительных клинических симптомов у пациентов, подлежащих проведению дальнейшей терапии (УД D);
· необходимо проведение минимального адекватного радиологического контроля, включающего КТ обследование на 6, 12, 24 месяцах после окончания лечения (УД D). Рутинный ПЭТ-контроль не рекомендуется;
· пациенты группы высокого риска, у которых возможно дальнейшее проведение терапии в случае рецидива, могут подлежать более частому наблюдению.
МЕДИЦИНСКАЯ РЕАБИЛИТАЦИЯ, согласно клинического протокола по реабилитации.
ПАЛЛИАТИВНАЯ ПОМОЩЬ: согласно клинического протокола по паллиативной помощи.
[2] При сравнении физического развития и заболеваемости новорождённых, рождённых матерями, получавшими и не получавшими специфические противоопухолевые препараты, достоверных различий не выявлено. Пороков развития у этих новорождённых выявлено небыло. В исследовании А. Aviles, N. Neri было проведено обследование 84 новорождённых, матерям которых проводили полихимиотерапию (по схемам АВVD, ABD, EBVD или МОРР) вовремя беременности, у 10 из которых — в I триместре. Все пациентки родоразрешены на сроках 36-40 нед. без развития аномалий у плода. Однако в сообщении D.C. Doll аномалии развитияимели 4 из 7 плодов, матери которых получали лечение по схеме МОРР. Для лечения НХЛ вовремя беременности в настоящее время предпочтительнее использование схемы (R)-СНОР (ритуксимаб [при CD20+ лимфомах], циклофосфамид, доксорубицин, винкристин, преднизолон). В исследовании А. Aviles, N. Neri 29 беременных прошли курсы полихимиотерапии по схеме СНОР (из них 17 во время I триместра). Масса при рождении, память и возможность обучения у детей были в норме, не было выявлено врождённых, неврологических и психологических нарушений.
[1]По данным Европейской группы по трансплантации костного мозга (ЕВМТ) более половины всех ТГСК выполнены у пациентов с лимфопролиферативными заболеваниями, а среди аутоТГСК 87% приходится на пациентов с лимфомами (Ходжкина и неходжкинскими) и множественной миеломой. В последнее десятилетие увеличивается количество аллогенных трансплантаций (аллоТГСК), выполненных при различных лимфомах. Более широкое использование аллоТГСК связано с наличием эффекта “трансплантат-против-лимфомы”, впервые продемонстрированным R. Jones и соавторами в 1991 году, и с внедрением режимов кондиционирования со сниженной токсичностью.
Госпитализация
Показания для плановой госпитализации:
· проведение курсов химиотерапии;
· проведение биопсии лимфатического узла или экстранодального образования;
· мобилизация гемопоэтических стволовых клеток;
· аутологичная трансплантация гемопоэтических стволовых клеток.
Показания для экстренной госпитализации:
Соматически тяжелый пациент (ECOG≥3).
Информация
Источники и литература
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗСР РК, 2016
- 1. Scottish Intercollegiate Guidelines Network (SIGN). SIGN 50: a guideline developer’s handbook. Edinburgh: SIGN; 2014. (SIGN publication no. 50). [October 2014]. Available from URL: http://www.sign.ac.uk. 2. Гематология: руководство для врачей/ под.ред. Н.Н. Мамаева. – 2-е изд., доп.и испр. – СПб.: СпецЛит, 2011. 3. Steven H. Swerdlow,1 Elias Campo, et al., The 2016 revision of the World Health Organization classification of lymphoid neoplasms. BLOOD, 19 MAY 2016 x VOLUME 127, NUMBER 20 4. M. Dreyling, M. Ghielmini, R. Marcus, G. Salles, U. Vitolo, M. Ladetto Newly Diagnosed and Relapsed Follicular Lymphoma: ESMO Clinical Practice Guidelines Ann Oncol (2014) 25 (suppl 3): iii76-iii82 5. Алгоритмы диагностики и лечения злокачественных новообразований. Под редакцией д.м.н., проф. О.Г. Суконко, д.м.н. С.А. Красного. Минск 2012 6. О.В. Юрченко, О.В. Пономарева. Гистогенетические варианты диффузной крупноклеточной лимфомы: диагностика и лечение. Онкология. Т15. №1, 2013 7. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Non-Hodgkin`s Lymphomas. www.nccn.org 3.2016/ 8. Sandlund JT. Burkitt lymphoma: staging and response evaluation. Br J Haematol. 2012 Mar;156(6):761-5. doi: 10.1111/j.1365-2141.2012.09026.x. Epub 2012 Feb 1. 9. Oncopedia.Recommendations from the society for diagnosis and therapy of haematological and oncological diseases. Guidelines` 2016 10. Carr SE, Halliday V. Investigating the use of the neutropenic diet: a survey of UK dietitians. J Hum Nutr Diet. 2014 Aug 28. 11. Moody K, Finlay J, Mancuso C, Charlson M. Feasibility and safety of a pilot randomized trial of infection rate: neutropenic diet versus standard food safety guidelines. J PediatrHematolOncol. 2006 Mar; 28(3):126-33 12. Gardner A, Mattiuzzi G, Faderl S, Borthakur G, Garcia-Manero G, Pierce S, Brandt M, Estey E. Randomized comparison of cooked and noncooked diets in patients undergoing remission induction therapy for acute myeloid leukemia. J ClinOncol. 2008 Dec 10; 26(35):5684-8. 13. Carr SE, Halliday V. Investigating the use of the neutropenic diet: a survey of UKdietitians. J Hum Nutr Diet.2014 Aug 28. 14. Boeckh M. Neutropenic diet— good practice or myth?Biol Blood Marrow Transplant. 2012 Sep; 18(9):1318-9. 15. Trifilio, S., Helenowski, I., Giel, M. et al. Questioning the role of a neutropenic diet following hematopoetic stem cell transplantation. Biol Blood Marrow Transplant. 2012; 18: 1387–1392. 16. Persky DO, Unger JM, Spier CM et al., Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group study 0014.J Clin Oncol. 2008 May 10;26(14):2258-63. doi: 10.1200/JCO.2007.13.6929. Epub 2008 Apr 14. 17. Miller TP, Dahlberg S, Cassady JR et al., Chemotherapy alone compared with chemotherapy plus radiotherapy for localized intermediate- and high-grade non-Hodgkin’s lymphoma.. N Engl J Med. 1998 Jul 2;339(1):21-6 18. Feugier P, Van Hoof A, Sebban C, et al., Long-term results of the R-CHOP study in the treatment of elderly patients with diffuse large B-cell lymphoma: a study by the Groupe d’Etude des Lymphomes de l’Adulte.J Clin Oncol. 2005 Jun 20;23(18):4117-26. Epub 2005 May 2. 19. Pfreundschuh M, Trümper L, Osterborg A et al., CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group. Lancet Oncol. 2006 May;7(5):379-91 20. Purroy N, Bergua J, Gallur L et al., Long-term follow-up of dose-adjusted EPOCH plus rituximab (DA-EPOCH-R) in untreated patients with poor prognosis large B-cell lymphoma. A phase II study conducted by the Spanish PETHEMA Group. Br J Haematol. 2015 Apr;169(2):188-98. doi: 10.1111/bjh.13273. Epub 2014 Dec 18. 21. Wilson WH, Dunleavy K, Pittaluga S et al., Phase II study of dose-adjusted EPOCH and rituximab in untreated diffuse large B-cell lymphoma with analysis of germinal center and post-germinal center biomarkers. J Clin Oncol. 2008 Jun 1;26(16):2717-24. doi: 10.1200/JCO.2007.13.1391. Epub 2008 Mar 31. 22. Wilson WH, Jung SH, Porcu P et al., A Cancer and Leukemia Group B multi-center study of DA-EPOCH-rituximab in untreated diffuse large B-cell lymphoma with analysis of outcome by molecular subtype. Haematologica. 2012 May;97(5):758-65. doi: 10.3324/haematol.2011.056531. Epub 2011 Dec 1. 23. Chao NJ, Rosenberg SA, Horning SJ. CEPP(B): an effective and well-tolerated regimen in poor-risk, aggressive non-Hodgkin’s lymphoma.Blood. 1990 Oct 1;76(7):1293-8. 24. Moccia AA, Schaff K, Hoskins P, et al. R-CHOP with Etoposide Substituted for Doxorubicin (R-CEOP): Excellent Outcome in Diffuse Large B Cell Lymphoma for Patients with a Contraindication to Anthracyclines (abstract 408). Blood 2009; 114:170. 25. Peyrade F, Jardin F, Thieblemont C, et al. Attenuated immunochemotherapy regimen (R-miniCHOP) in elderly patients older than 80 years with diffuse large B-cell lymphoma: a multicentre, single-arm, phase 2 trial. Lancet Oncol 2011; 12:460. 26. Fields PA, Townsend W, Webb A, et al. De novo treatment of diffuse large B-cell lymphoma with rituximab, cyclophosphamide, vincristine, gemcitabine, and prednisolone in patients with cardiac comorbidity: a United Kingdom National Cancer Research Institute trial. J Clin Oncol 2014; 32:282. 27. Gisselbrecht C, Glass B, Mounier N Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. Clin Oncol. 2010 Sep 20;28(27):4184-90. doi: 10.1200/JCO.2010.28.1618. Epub 2010 Jul 26. Erratum in: J Clin Oncol. 2012 May 20;30(15):1896 28. Velasquez WS, Cabanillas F, Salvador P. Effective salvage therapy for lymphoma with cisplatin in combination with high-dose Ara-C and dexamethasone (DHAP). Blood. 1988 Jan;71(1):117-22. 29. Martín A, Conde E, Arnan M. R-ESHAP as salvage therapy for patients with relapsed or refractory diffuse large B-cell lymphoma: the influence of prior exposure to rituximab on outcome. A GEL/TAMO study. Haematologica. 2008 Dec;93(12):1829-36. doi: 10.3324/haematol.13440. Epub 2008 Oct 22 30. Velasquez WS, McLaughlin P, Tucker S. ESHAP—an effective chemotherapy regimen in refractory and relapsing lymphoma: a 4-year follow-up study. J Clin Oncol. 1994 Jun;12(6):1169-76. 31. Crump M, Baetz T, Couban S, Gemcitabine, dexamethasone, and cisplatin in patients with recurrent or refractory aggressive histology B-cell non-Hodgkin lymphoma: a Phase II study by the National Cancer Institute of Canada Clinical Trials Group (NCIC-CTG). Cancer. 2004;101(8):1835 32. Gopal AK, Press OW, Shustov AR, Efficacy and safety of gemcitabine, carboplatin, dexamethasone, and rituximab in patients with relapsed/refractory lymphoma: a prospective multi-center phase II study by the Puget Sound Oncology Consortium.Leuk Lymphoma. 2010 Aug;51(8):1523-9. doi: 10.3109/10428194.2010.491137. 33. López A, Gutiérrez A, Palacios A. GEMOX-R regimen is a highly effective salvage regimen in patients with refractory/relapsing diffuse large-cell lymphoma: a phase II study. Eur J Haematol. 2008 Feb;80(2):127-32. Epub 2007 Nov 20. 34. Zelenetz AD, Hamlin P, Kewalramani T, Ifosfamide, carboplatin, etoposide (ICE)-based second-line chemotherapy for the management of relapsed and refractory aggressive non-Hodgkin’s lymphoma. Ann Oncol. 2003;14 Suppl 1:i5-10. 35. Kewalramani T, Zelenetz AD, Nimer SD, Rituximab and ICE as second-line therapy before autologous stem cell transplantation for relapsed or primary refractory diffuse large B-cell lymphoma. Blood. 2004 May 15;103(10):3684-8. Epub 2004 Jan 22. 36. Gisselbrecht C, Glass B, Mounier N Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era.J Clin Oncol. 2010 Sep 20;28(27):4184-90. doi: 10.1200/JCO.2010.28.1618. Epub 2010 Jul 26. 37. Moreno Nogueira JA, Ruiz Borrego M, Treatment of aggressive non-Hodgkin’s lymphomas. Rev Clin Esp. 2009 Feb;209(2):88-92. Spanish. 38. Weidmann E, Kim SZ, Rost A,Bendamustine is effective in relapsed or refractory aggressive non-Hodgkin’s lymphoma. Ann Oncol. 2002 Aug;13(8):1285-9. 39. Vacirca JL, Acs PI, Tabbara IA, Bendamustine combined with rituximab for patients with relapsed or refractory diffuse large B cell lymphoma. Ann Hematol. 2014 Mar;93(3):403-9. doi: 10.1007/s00277-013-1879-x. Epub 2013 Aug 17. 40. Ohmachi K, Niitsu N, Uchida T, Multicenter phase II study of bendamustine plus rituximab in patients with relapsed or refractory diffuse large B-cell lymphoma. J Clin Oncol. 2013 Jun 10;31(17):2103-9. doi: 10.1200/JCO.2012.46.5203. Epub 2013 May 6. 41. Jacobsen ED, Sharman JP, Oki Y, Brentuximab vedotin demonstrates objective responses in a phase 2 study of relapsed/refractory DLBCL with variable CD30 expression. Blood. 2015 Feb 26;125(9):1394-402. doi: 10.1182/blood-2014-09-598763. Epub 2015 Jan 8. 42. Witzig TE, Vose JM, Zinzani PL, An international phase II trial of single-agent lenalidomide for relapsed or refractory aggressive B-cell non-Hodgkin’s lymphoma. Ann Oncol. 2011 Jul;22(7):1622-7. doi: 10.1093/annonc/mdq626. Epub 2011 Jan 12. 43. Wiernik PH, Lossos IS, Tuscano JM. Lenalidomide monotherapy in relapsed or refractory aggressive non-Hodgkin’s lymphoma.J Clin Oncol. 2008 Oct 20;26(30):4952-7. doi: 10.1200/JCO.2007.15.3429. Epub 2008 Jul 7. 44. Wang M, Fowler N, Wagner-Bartak N. Oral lenalidomide with rituximab in relapsed or refractory diffuse large cell, follicular and transformed lymphoma: a phase II clinical trial.Leukemia. 2013 Sep;27(9):1902-9. doi: 10.1038/leu.2013.95. Epub 2013 Apr 2. 45. Thomas DA, Faderl S, O’Brien S. Chemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult Burkitt and Burkitt-type lymphoma or acute lymphoblastic leukemia. Cancer. 2006 Apr 1;106(7):1569-80. 46. Thomas DA, Kantarjian HM, Cortes J, et al. Long-term outcome after hyper-CVAD and rituximab chemoimmunotherapy for Burkitt (BL) or Burkitt-like (BLL) leukemia/lymphoma and mature B-cell lymphocytic leukemia (ALL). Blood. 2008; 112:Abstract 1929. 47. Галстян Г.М.,Кременецкая А.М., Клясова Г.А.Новый короткий высокоинтенсивный пртокол терапии беркитта у взрослых ЛБ-М-04: промежуточные результаты. Гематология и трансфузиология. 2006.-N 6.-С.3-11. Библ. 36 назв. 48. Choi MK, Jun HJ, Lee SY. Treatment outcome of adult patients with Burkitt lymphoma: results using the LMB protocol in Korea.Ann Hematol. 2009 Nov;88(11):1099-106. doi: 10.1007/s00277-009-0729-3. Epub 2009 Mar 14. 49. Lacasce A, Howard O, Lib S, Fisher D, Modified magrath regimens for adults with Burkitt and Burkitt-like lymphomas: preserved efficacy with decreased toxicity.Leuk Lymphoma. 2004 Apr;45(4):761-7. 50. Mead GM, Sydes MR, Walewski J. An international evaluation of CODOX-M and CODOX-M alternating with IVAC in adult Burkitt’s lymphoma: results of United Kingdom Lymphoma Group LY06 study.Ann Oncol. 2002 Aug;13(8):1264-74. 51. Barnes JA, Lacasce AS, Feng Y. Evaluation of the addition of rituximab to CODOX-M/IVAC for Burkitt’s lymphoma: a retrospective analysis.Ann Oncol. 2011 Aug;22(8):1859-64. doi: 10.1093/annonc/mdq677. Epub 2011 Feb 21. 52. Evens AM, Carson KR, Kolesar J. A multicenter phase II study incorporating high-dose rituximab and liposomal doxorubicin into the CODOX-M/IVAC regimen for untreated Burkitt’s lymphoma.Ann Oncol. 2013 Dec;24(12):3076-81. doi: 10.1093/annonc/mdt414. Epub 2013 Oct 20. 53. Rizzieri DA, Johnson JL, Byrd JC et al., Improved efficacy using rituximab and brief duration, high intensity chemotherapy with filgrastim support for Burkitt or aggressive lymphomas: cancer and Leukemia Group B study 10 002. Br J Haematol. 2014 Apr;165(1):102-11. doi: 10.1111/bjh.12736. Epub 2014 Jan 15. 54. Dunleavy K, Pittaluga S, Shovlin M et al.,Low-intensity therapy in adults with Burkitt’s lymphoma. N Engl J Med. 2013 Nov 14;369(20):1915-25. doi: 10.1056/NEJMoa1308392. 55. Барях Е.А., Кравченко С.К., Обухова Т.Н., и соавт. Лимфома Беркитта: клиника, диагностика, лечение. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2009;2(2):137- 146 56. Biggar RJ: The Epidemiology of Malignancies in HIV/AIDS, in Feigal EG, Levine AM, Biggar RJ (eds): AIDS-Related Cancers and Their Treatment, pp 25-58. New York, Marcel Dekker Inc, 2000. 57. Lanoy E, Rosenberg PS, Fily F et al., HIV-associated Hodgkin lymphoma during the first months on combination antiretroviral therapy.Blood. 2011 Jul 7;118(1):44-9. doi: 10.1182/blood-2011-02-339275. Epub 2011 May 6. 58. Griffin TC, Weitzman S, Weinstein H, et al. A study of rituximab and ifosfamide, carboplatin, and etoposide chemotherapy in children with recurrent/refractory B-cell (CD20+) non-Hodgkin lymphoma and mature B-cell acute lymphoblastic leukemia: a report from the Children’s Oncology Group. Pediatr Blood Cancer.2009;52:177–181 59. Apperley J., Carreras E., Gluckman E., Masszi T. The 2014 revised edition of the EBMT-ESH Handbook on Haemopoietic Stem Cell Transplantation 60. Witzig TE, Vose JM, Zinzani PL et al.,An international phase II trial of single-agent lenalidomide for relapsed or refractory aggressive B-cell non-Hodgkin’s lymphoma. Ann Oncol. 2011 Jul;22(7):1622-7. doi: 10.1093/annonc/mdq626. Epub 2011 Jan 12. 61. Wiernik PH, Lossos IS, Tuscano JM et al., Lenalidomide monotherapy in relapsed or refractory aggressive non-Hodgkin’s lymphoma. J Clin Oncol. 2008 Oct 20;26(30):4952-7. doi: 10.1200/JCO.2007.15.3429. Epub 2008 Jul 7. 62. Wang M, Fowler N, Wagner-Bartak N et al., Oral lenalidomide with rituximab in relapsed or refractory diffuse large cell, follicular and transformed lymphoma: a phase II clinical trial. Leukemia. 2013 Sep;27(9):1902-9. doi: 10.1038/leu.2013.95. Epub 2013 Apr 2. 63. H. Tilly, M. Gomes da Silva, U. Vitolo et al., Diffuse Large B-Cell Lymphoma: ESMO Clinical Practice Guidelines. Ann Oncol (2015) 26 (suppl 5): v116-v125.
Информация
высокоактивная антиретровирусная терапия
fludeoxyglucose (англ. фтордезоксиглюкоза)
International Prognostic Index
Список разработчиков протокола с указанием квалификационных данных:
1) Кемайкин Вадим Матвеевич — АО «Национальный научный центр онкологии и трансплантологии», Директор департатмента онкологии, Главный внештатный гематолог МЗиСР РК, кандидат медицинских наук
2) Гайнутдинова Ольга Владимировна -врач гематолог, АО «Национальный научный центр онкологии и трансплантологии».
3) Клодзинский Антон Анатольевич – к.м.н., врач гематолог, ТОО «Центр гематологии»
4) РамазановаРайгульМухамбетовна –д.м.н., заведующая курсом гематологии, АО «Казахский медицинский университет непрерывного образования».
5) ГаббасоваСаулеТелембаевна -заведующая отделением гемобластозов, РГП на ПХВ «Казахский научно-исследовательский институт онкологии и радиологии».
6) КаракуловРоманКаракулович –д.м.н., Академик МАИ, главный научный сотрудник отделения гемобластозов «Казахский научно-исследовательский институт онкологии и радиологии».
7) Рапильбекова Гульмира Курбановна – д.м.н., профессор АО «Национальный научный центр материнства и детства», старший ординатор акушерского отделения №1, врач акушер-гинеколог. Калиева Мира Маратовна — к.м.н, доцент кафедры клинической фармакологии и фармакотерапии КазНМУ им. С. Асфендиярова.
Калиева Мира Маратовна — к.м.н, доцент кафедры клинической фармакологии и фармакотерапии КазНМУ им. С. Асфендиярова.Указание на отсутствие конфликта интересов:нет.
Список рецензентов:
1) Тургунова Людмила Геннадиевна – д.м.н., профессор, РГП на ПХВ «Карагандинский государственный медицинский университет», заведующая кафедрой терапевтических дисциплин факультета непрерывного
профессионального развития, врач-гематолог.Пересмотр протокола:через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
Индекс Карновского/Шкала ECOG-ВОЗ
Общее состояние онкологического больного рекомендовано оценивать по индексу Карновского (0-100%) или Шкале ECOG-ВОЗ (0-4 балла).Индекс Карновского Активность,% Шкала ECOG-ВОЗ Балл Состояние нормальное жалоб нет 100 Нормальная активность 0 Способен к нормальной деятельности, незначительные симптомы или признаки заболевания 90 Есть симптомы заболевания, но ближе к нормальному состоянию 1 Нормальная активность с усилием 80 Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе 70 Больше 50% дневного времени проводит не в постели, но иногда нуждается в отдыхе 2 Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей 60 Нуждается в значительной помощи и медицинском обслуживании 50 Нуждается в пребывании в постели более 50% дневного времени 3 Инвалид, нуждается в специальной помощи, в т.ч. медицинской 40 Тяжелая инвалидность, показана госпитализация, хотя смерть не предстоит 30 Не способен обслуживать себя, прикован к постели 4 Тяжелый больной. Необходимы активное лечение и госпитализация 20 Умирающий 10 Приложение 2
Классификация лимфом. ВОЗ 2016 год.
В- клеточные опухоли:
· Хронический лимфолейкоз/ лимфома из малых лимфоцитов;
· Моноклональный В-клеточный лимфоцитоз;
· В-пролимфоцитарный лейкоз;
· Лимфома селезенки из клеток маргинальной зоны;
· Волосатоклеточный лейкоз;
· Лимфома/ лейкоз селезенки, неклассифицируемый:
— Диффузная мелкоклеточная В- клеточная лимфома красной пульпы
селезенки;
— Волосатоклеточный лейкоз- подобный вариан.
· Лимфоплазмоцитарная лимфома
— Макроглобулинемия Вальденстрема
· Моноклональные гаммапатии неясного генеза (MGUS), IgM:
— Болезнь α- тяжелых цепей;
— Болезнь γ- тяжелых цепей;
— Болезнь μ- тяжелых цепей.
· Моноклональные гаммапатии неясного генеза (MGUS), IgG/A:
— Плазмоклеточная миелома;
— Солитарная плазмоцитома кости;
— Экстрамедуллярная миелома;
— Болезнь накопления моноклональных иммуноглобулинов.
· Экстранодальная лимфома из клеток маргинальной зоны лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT- лимфом);
· Нодальная лимфома из клеток маргинальной зоны;
· Нодальная лимфома из клеток маргинальной зоны, педиатрический вариант;
· Фолликулярная лимфома:
— In situ фолликулярная неоплазия;
— Фолликулярная лимфома дуоденального типа.
· Фолликулярная лимфома, педиатрический вариант;
· Крупноклеточная В- клеточная лимфома с IRF4;
· Первичная кожная центрофолликулярная лимфома;
· Лимфома из клеток мантии:
— In situ неоплазия из клеток мантии;
· Диффузная крупноклеточная В- клеточная лимфома, NOS:
— GCB-тип(анг. germinal center B-cell-like);
— ABC-тип (англ. activated B-cell-like).
· В-клеточная лимфома, богатая T-клетками/гистиоцитами;
· Первичная ДВККЛ центральной нервной сиситемы (ЦНС);
· Первичная кожная диффузная крупноклеточная В- клеточная лимфома с поражением нижних конечностей;
· EBV1+ DLBCL, NOS;
· EBV1+, кожно-слизистая язва;
· ДВККЛ, связанная с хроническим воспаленнием;
· Лимфоматоидный гранулематоз;
· Первичная медиастинальная (тимическая) крупноклеточная В- клеточная лимфома;
· Внутрисосудистая крупноклеточная В- клеточная лимфома;
· ALK + крупноклеточная В- клеточная лимфома;
· Плазмобластная лимфома;
· Первичная экссудативная лимфома;
· HHV81 DLBCL, NOS*;
· Лимфома Беркитта;
· Беркитоподобная лимфома с абберацией 11q;
· В-клеточная лимфома высокой степени злокачественности, с мутациями MYC и BCL2 и /или BCL6;
· В-клеточная лимфома высокой степени злокачественности, NOS;
· В- клеточная лимфома, неклассифицируемая, с признаками, промежуточными между диффузной крупноклеточной В- клеточной лимфомой и лимфомой Ходжкина;Т/ NK- клеточные опухоли:
· Т- клеточный пролимфоцитарный лейкоз;
· Т- клеточный гранулярный лимфоцитарный лейкоз;
· Хроническое лимфопролиферативное NK- клеточное заболевание;
· Агрессивный NK- клеточный лейкоз;
· Системная EBV Т-клеточная лимфома у детей;
· Гидроаоспенновидно- подобнаялимфома;
· Т- клеточная лимфома/ лейкоз взрослых;
· Экстранодальная NK/ T- клеточная лимфома, назальный тип;
· Ассоциированная с энтеропатией Т- клеточная лимфома;
· Мономорфная эпителиотропная кишечная Т-лимфома;
· Индолетние Т-клеточные лимфопролиферативные заболевания ЖКТ;
· Гепатоспленическая Т- клеточная лимфома;
· Подкожная панникулит- подобная Т- клеточная лимфома;
· Грибовидный микоз;
· Синдром Сезари;
· Первичные кожные CD30- позитивные Т- клеточные лимфомы;
· Лимфоматоидный папуллез;
· Первичная кожная анапластическая крупноклеточная лимфома;
· Первичная кожная γδ Т- клеточная лимфома;
· Первичная кожная CD8+ агрессивная эпидермотропная цитотоксическая Т- клеточная лимфома;
· Первичная кожная CD8+ Т- клеточная лимфома
· Первичная кожная периферическая CD8+ Т- клеточная лимфома
· Первичная кожная CD4+ мелко/ среднеклеточная Т- клеточная лимфома;
· Периферическая Т- клеточная лимфома, неуточненная;
· Ангиоиммунобластная Т- клеточная лимфома;
· Фолликулярная Т-клеточная лимфома;
· Нодальная периферическая Т-клеточная лимфома с фенотипом TFH;
· Анапластическая крупноклеточная лимфома, ALK- позитивная;
· Анапластическая крупноклеточная лимфома, ALK- негативная;
· Грудной имплантат-ассоциированной анапластическая крупно-клеточная лимфома;Лимфома Ходжкина:
· Нодулярная с лимфоидным преобладанием лимфома Ходжкина;
· Классическая лимфома Ходжкина;
· Лимфома Ходжкина, вариант нодулярный склероз;
· Лимфома Ходжкина, вариант, богатый лимфоцитами;
· Лимфома Ходжкина, смешанноклеточный вариант;
· Лимфома Ходжкина, вариант с лимфоидным истощением.Пострансплантационные лимфопролиферативные заболевания (PTLD):
· Плазматическая гиперплазия (PTLD);
· Инфекционный мононуклеоз (PTLD);
· Багровая фолликулярная гиперплазия;
· Полиморфная PTLD;
· Мономорфная PTLD (B- и T-/NK-клеточные типы)
· Классическая лимфома Ходжкина (PTLD).Новообразования гистиоцитарных и дендритных клеток:
· Гистиоцитарная саркома;
· Гистиоцитоз из клеток Лангергаса;
· Саркома из клеток Лангергаса;
· Неопределенный опухоль дендритных клеток;
· Саркома из дендритных клеток;
· Саркома фолликулярных дендритных клеток;
· Опухоль из ретикулярных фибробластических клеток;
· Рассеянная юношеская ксантогранулома
· Болезнь Эрдгейма-ЧестерПриложение 3
Классификация лимфом Ann Arbor, модификация Cotswold
Стадия I • поражение одной лимфатической зоны или структуры *;
• локализованное поражение одного экстралимфатического органа или ткани в пределах одного сегментаСтадия II • поражение двух или более** лимфатических зон по одну сторону диафрагмы;
• локализованное в пределах одного сегмента поражение одного
экстралимфатического органа или ткани и его регионарных лимфатических узлов с/без поражения других лимфатических областей по ту же сторону диафрагмыСтадия III • поражение лимфатических узлов или структур по обе стороны диафрагмы ***;
• локализованное в пределах одного сегмента поражение одного
экстралимфатического органа или ткани и его регионарных лимфатических узлов с поражением других лимфатических областей по обе стороны диафрагмыСтадия IV • диссеминированное (многофокусное) поражение одного или нескольких экстралимфатических органов, с или без поражения лимфатических узлов;
• изолированное поражение экстралимфатического органа с поражением отдаленных (не регионарных) лимфатических узлов;
• поражение печени и/или костного мозга• Для всех стадий А • отсутствие признаков В-стадии В **** один или более из следующих симптомов:
• лихорадка выше 38°С не менее трех дней подряд без признаков воспаления;
• ночные профузные поты;
• похудание на 10% массы тела за последние 6 месяцевE • локализованное экстранодальное поражение (при I-IIIстадиях) S • поражение селезенки (при I-IIIстадиях) Х • массивное (bulky) опухолевое поражение –очаг более 10 см в диаметре или медиастинально-торакальный индекс***** более 1/3 * К лимфатическим структурам относят лимфатические узлы, селезенку, вилочковую железу, кольцо Вальдейера, червеобразный отросток, пейеровы бляшки
** При лимфоме Ходжкина для второй стадии необходимо дополнительно арабской цифрой указывать количество пораженных лимфатических зон (например, стадия II4)
*** Рекомендуется различать стадию III1, с поражением верхних абдоминальных лимфатических узлов (ворота печени, селезенки, чревные л/у), и стадию III2, с поражением забрюшинных лимфузлов
**** Кожный зуд исключен из симптомов интоксикации
***** Медиастинально-торакальный индекс – отношение ширины срединной тени в самом широком месте к диаметру грудной клетки в самом широком ее месте – на уровне Th5-6на стандартных прямых рентгенограммахПриложение 4
Критерии LUGANO для оценки ответа при НХЛ
ПЭТ должно быть проведено с контрастным усилением и КТ (можно провести одновременно или по отдельности).Ответ Локализация (Вовлечение органов и систем) ПЭТ КТ (метаболический ответ) КТ (радиологический ответ) d Лимфатические узлы и экстралимфатические поражения 1,2 или 3* балла по шкале Deauville, с/без остаточной массой Все критерии из перечисленных: Лимфатические узлы / нодальные массы должны регрессировать к ≤1.5 см
Без экстралимфатического пораженияПолный ответ Не измеряемые очаги Не применяется Отсутствуют Увеличение в размерах внутренних органов Не применяется Уменьшение до нормальных размеров Новые очаги Не обнаружено Не обнаружено Костный мозг Нет данных за накопление фтордезоксиглюкозы в мозге Нормальная по морфологии; при сомнительном результате — проточная цитометрии и негативная ИГХ Лимфатические узлы и экстралимфатические поражения 4 или 5 баллов по шкале Deauville с меньшим накоплением FDG по сравнению результатом в дебюте. Нет новых очагов поражения или прогрессирования.
В промежуточном рестадировании эти данные свидетельствуют об ответе заболевания на лечение.
В конце лечения эти результаты могут свидетельствовать об остаточной болезни.Все критерии из перечисленных:
-уменьшение размеров лимфатических узлов и экстралимфатических поражений на ≥ 50%;
-когда степень поражения невозможно оценить на КТ из-за малых размеров (ориентировочный размер 5х5 мм);
-полное отсутствие поражения, 0х0 мм;
-для узлов >5 мм х 5 мм, но меньше, чем в норме, (рекомендовано использование фактического измерения для расчета);Частичный ответ Неизмеряемые очаги Не применяется Отсутствуют / нормальные, регресиированные, но нет увеличения Увеличение в размерах внутренних органов Не применяется Уменьшение размеров селезенки на 50% в длину (но не достигших размеров нормы) Новые очаги Не обнаружены Не обнаружены Костный мозг Остаточное поглощение FDG выше, чем поглощение в нормальном костном мозге, но снижено по сравнению с исходным уровнем (диффузное поглощение сочетается с реактивными изменениями после проведенной химиотерапии). Если имеются стойкие очаговые изменения в костном мозге на фоне ответа, рассмотреть дальнейшую оценку ответа с биопсией, или интервал сканирования. Не применяется a 3 балла по шкале Deauville у многих пациентов указывает на хороший прогноз при стандартной терапии, особенно при промежуточном рестадировании. Однако, в испытаниях с участием ПЭТ, где исследовались деэскалация доз химиопрепаратов, ответ 3 балла по шкале Deauville расценивался как неадекватный ответ (чтобы избежать недостаточного лечения).
Критерии LUGANO для оценки ответа при НХЛ
ПЭТ должно быть проведено с контрастным усилением и КТ (можно провести одновременно или по отдельности).Ответ Локализация (Вовлечение органов и систем) ПЭТ КТ (метаболический ответ) КТ (радиологический ответ) d Нет ответа или стабилизация заболевания Целевые узлы и узловые массы
Экстралимфатические пораженияSPD — сумма произведения перпендикулярных диаметров для множественных повреждений
LDi — самый длинный поперечный диаметр поражения
SDi — короткая ось перпендикулярна к LDI
PPD — крест произведение LDI и перпендикулярного диаметраПриложение 5

Оценка эффективности проведенной терапии по шкале Deauville
Приложение 6
Клинические и технические требования к лучевой терапии
Клинические требования
Оптимальный интервал между окончанием ХТ и началом лучевой терапии – 2-4 недели (но не более 6 недель).
Очень важным для планирования лучевой терапии является качество стадирования заболевания до начала химиотерапии. Описание очагов поражения по данным клинического осмотра, КТ, МРТ должно включать анатомически точную их локализацию, количество, максимальные размеры в сантиметрах, особенно зон массивного поражения, указание 3-х размеров зоны поражения, включая протяжённость. При описании поражения средостения обязательно определение медиастинально-торакального индекса (МТИ) по прямому рентгеновскому снимку. Для атипично расположенных пораженных лимфатических узлов, помимо описания их, необходимо указывать их координаты (расстояние в см по горизонтали и вертикали от легко определяемых анатомических ориентиров). Всю указанную выше информацию рекомендуется изображать графически на анатомической схеме человеческого тела во фронтальной проекции.
До начала ХТ при наличии полной информации об объеме исходного поражения рекомендуется совместная консультация гематологов-онкологов и радиологов. Особо должны быть выделены зоны сомнительного или вероятного поражения, лечебная тактика в отношении которых должна быть предварительно согласована и повторно обсуждена после окончания ХТ.
При всех поддиафрагмальных поражениях в случае планирования облучения селезёнки рекомендуется радиоизотопное исследование функции почек. При наличии единственной левой почки либо при значительном нарушении функции правой почки следует обсудить целесообразность спленэктомии, как альтернативы ее облучению.Технические требования
Для проведения лучевой терапии можно использовать гамма-излучение Со60, фотонное излучение энергией 6 МЭВ и 18 МЭВ (18 МЭВ используется в случае глубокого расположения мишени, при больших значениях передне-задних размеров). Электронное излучение различных энергий может использоваться для лечения поверхностно расположенных лимфатических узлов.
Расчёт дозы ЛТ должен проводиться в соответствии с МКРЕ-50-62, где указаны относительные точки и суммарные дозы. Разовая очаговая доза не должна превышать 1,8-2,0 Гр, лечение проводится ежедневно 5 раз в неделю. Следует избегать начала ЛТ в пятницу и окончания курса ЛТ в понедельник.
В зависимости от технической оснащенности радиологического отделения могут использоваться различные методики лучевой терапии: от лечения несколькими фигурными полями (требующего четкой стыковки смежных полей облучения во избежание пере- или недооблучения) до новейших методик конформной лучевой терапии (IMRT, RAPIDARC), сводящих к минимуму лучевое воздействие на нормальные ткани.
Для точного воспроизведения положения пациента во время лечения необходимо использовать фиксирующие приспособления – подголовники, индивидуальные пластиковые маски, подставки для нижних конечностей. При облучении всех пораженных зон, кроме паховых и бедренных лимфатических узлов, используются встречные передне-задние фигурные поля (они формируются с помощью защитных блоков или многолепестковых коллиматоров диафрагмы ускорителя).
При дополнительном облучении отдельных групп лимфатических узлов возможно любое расположение полей, минимизирующее лучевое повреждение здоровых тканей. При ЛТ остаточных объёмных опухолей рекомендуется объёмное планирование облучения, применение методики облучения тангенциальными полями, использование компенсаторных клиньев, методик конформной лучевой терапии (3D CRT).
При поражении лимфоидной ткани кольца Вальдейера облучение проводится с двух боковых встречных полей (необходима предварительная санация полости рта, использование защитных кап).
Каждое лечебное поле должно подтверждаться рентгеновскими снимками с помощью симулятора или системой контроля изображения на ускорителе.Объёмы облучения
Для выбора адекватного объёма облучения необходимо помнить об определении областей и зон поражения. На V международном симпозиуме по лимфоме Ходжкина в 2001г. было уточнено, что термином «зона» обозначаются анатомические зоны, по которым устанавливается стадия заболевания в соответствии с классификацией Ann Arbor. Термин «область» – более широкое понятие, область может включать в себя одну или более зон. Так в одну область были включены шейные, над- и подключичные лимфатические узлы с одной стороны. Также в одну область объединены медиастинальные лимфатические узлы и лимфатические узлы корней легких, одной областью считаются лимфатические узлы «верхнего этажа» брюшной полости (ворота печени, ворота селезенки и корень брыжейки) и одной областью – лимфатические узлы “нижнего этажа” брюшной полости — парааортальные и мезентериальные (рисунок 1).
Рисунок 1. Области и зоны поражения при лимфомах
Приложение 7
Факторы риска и профилактика тромботических и тромбоэмболических осложнений
Факторы риска и профилактика тромботических и тромбоэмболических осложнений у пациентов, которые получают талидомид или леналидомидФакторы риска Рекомендуемые действия Индивидуальные факторы риска:
• ожирение (ИМТ более 30 кг/м 2 );
• предшествующие тромботические события;
• центральный венозный катетер или искусственный водитель ритма;
• ассоциированные заболевания и состояния: заболевания ССС, хроническая болезнь почек, диабет, острые инфекции, иммобилизация;
• хирургические вмешательства: общая хирургия, травма, любая анестезия;
• использование эритропоэтина;
• тромбофилии.· нет факторов риска или один фактор риска (индивидуальный или связанный с лимфопролиферативным заболеванием): ацетилсалициловая кислота 80-325 мг 1 раз в сутки;
· 2 и более индивидуальных или связанных с лимфопролиферативным заболеванием факторов риска:
— Низкомолекулярные гепарины (эквивалент эноксапарина 40 мг 1 раз в сутки);
ИЛИ
— Полная доза варфарина (целевое значение МНО 2-3)Факторы риска связанные с лимфопролиферативным заболеванием:
• само наличие лимфомы, миеломы в особенности при большой инициальной опухолевой массе;
• повышенная вязкость крови.Факторы, связанные с лечением:
Сочетание талидомида или леналидомида с:
• высокими дозами дексаметазона (более 480 мг в месяц);
• доксорубицином;
• полихимиотерапией.· Низкомолекулярные гепарины (эквивалент эноксапарина 40 мг 1 раз в сутки);
ИЛИ
· Полная доза варфарина (целевое значение МНО 2-3).Прогностическая модель ассоциированных с химиотерапией тромбоэмболических осложнений KhoranaА.А. и соавт.
Характеристики пациента Баллы Верифицированная лимфома 1 Количество тромбцитов до начала химотерапии 350 тыс/мкл и выше 1 Уровень гемоглобина ниже 100 г/л или использование эритропоэтинов 1 Уровень лейкоцитов до начала химиотерапии выше 11 тыс/мкл 1 ИМТ выше 35 кг/м 2 1 Общее количество баллов Категория риска Риск симптомной тромбоэмболии 0 Низкий 0,8-3% 1, 2 Промежуточный 1,8-8,4% 3 и более Высокий 7,1-41% Рекомендации American Society of Clinical Oncology по профилактике и лечению тромбозов вен и тромбоэмболий у онкологических больных*
Цель Препарат Схема 1 Профилактика Госпитализированные онкологи- ческие больные хирургического или терапевтического профиля 3 Нефракционированный гепарин 5000 ЕД каждые 8 ч 2 Далтепарин 5000 МЕ/сут Эноксапарин 40 мг/сут Фондапаринукс 4 2,5 мг/сут Лечение ТВ и ТЭЛА Начальное 5 Далтепарин 4 100 МЕ/кг каждые 12 ч 200 МЕ/кг/сут 7 Эноксапарин 6 1 мг/кг каждые 12 ч 1,5 мг/кг/сут 6 Гепарин 80 ЕД/кг в/в струйно, затем 18 ЕД/кг/ч в/в (скорость введения корректируют с учетом АЧТВ**) Фондапаринукс 6 < 50 кг — 5 мг/сут 50–100 кг — 7,5 мг/сут > 100 кг —10 мг/сут Тинзапарин 175 МЕ/кг/сут Долгосрочное 3 Далтепарин 200 МЕ/кг/сут в течение 1 мес., затем 150 МЕ/кг/сут Варфарин 5–10 мг/сут внутрь, дозу корректируют так, чтобы МНО составляло 2–3 *ПРИМЕЧАНИЯ. Общая длительность антикоагулянтной терапии зависит от особенностей случая. Больным с активным злокачественным процессом обычно требуется терапия продолжительностью не менее 6 мес.
Относительные противопоказания к назначению антикоагулянтов включают следующее:
• некупируемое кровотечение;
• острая стадия внутричерепного кровоизлияния;
• расслаивающая аневризма аорты или аневризма сосудов головного мозга;
• бактериальный эндокардит;
• перикардит;
• обострение язвы желудка или других отделов ЖКТ;
• тяжелая, злокачественная артериальная гипертензия или гипертензия без надлежащего лечения;
• тяжелая травма головы;
• беременность (варфарин);
• гепариновая тромбоцитопения (гепарин, нефракционированный и низкомолекулярный);
• введение эпидурального катетера.
Сокращения: АЧТВ — активированное частичное тромбопластиновое время; МНО — международное нормализованное отношение.
1 Если нет особых показаний, все дозы вводятся подкожно.
2 Используется также введение 5000 МЕ каждые 12 ч, но этот режим, по-видимому, менее эффективен.
3 Длительность равна сроку госпитализации или времени до перехода на амбулаторное лечение.
4 FDA США не одобрило применение для этой цели.
5 Минимальный срок 5–7 дней; переход на варфарин возможен, только если МНО находится в допустимых границах 2 дня подряд.
6 Большую роль играет выведение почками. При клиренсе креатинина менее 30 мл/мин препарат назначать нежелательно; если применение все-таки необходимо, следует ориентироваться на анти-Ха-активность.
7 Как правило, используется АЧТВ, в 1,5–2,5 раза превышающее контрольное значение. Лучший метод определения терапевтического диапазона АЧТВ, соответствующего уровню гепарина 0,3–0,7 МЕ/мл, — это хромогенное определение уровня фактора Xa.Приложение 8
Синдром лизиса опухоли
При разрушении опухолевых клеток образуется пять основных субстанций, которые выводятся исключительно почками: продукты распада пурина ® ксантин, гипоксантин и мочевая кислота; калий; фосфат.
Аллопуринол тормозит распад ксантина и гипоксантина до мочевой кислоты путем ингибирования ксантиноксидазы, снижая образование уратов в сыворотке крови.
При превышении порога растворимости ксантин, гипоксантин и мочевая кислота могут кристаллизоваться в почечных канальцах и собирательных трубочках. Фосфат, соединяясь с кальцием, образует фосфат кальция и выпадает как в почечных канальцах, так и в концевых капиллярах тканей, следствием чего являются гипокальциемия, олиго/анурия и тканевые некрозы. Растворимость ксантина и мочевой кислоты в щелочной среде намного выше, чем в кислой, но щелочная среда напротив благоприятствует выпадению в осадок фосфата кальция. Кроме того при рh>7,5 может кристаллизоваться гипоксантин. Следовательно перезащелачивание мочи тоже может благоприятствовать выпадению продуктов клеточного распада.
Если перед началом циторедуктивной терапии наблюдается повышение уровня мочевой кислоты и/или калия, и/или фосфатов и/или креатинина, то мероприятия по нормализации этих показателей должны быть проведены до начала циторедуктивной терапии. Однако начало этой терапии не должно откладываться более чем на 24 часа.
Главным мероприятием является инициирование и поддержание высокого диуреза — 100-250 мл/м 2 / час. Если этого удается добиться, то метаболические нарушения бывают редко.
Если адекватного диуреза несмотря на достаточный объём инфузии, применение различных мочегонных средств (лазикс, маннитол, альбумин) добиться не удается, должны быть своевременно сделаны все необходимые приготовления к гемодиализу. Причиной олиго/анурии в этом случае является распространённое опухолевое поражение почек и/или обструкция опухолью (лимфомой) нисходящих мочевых путей, либо развитие тяжёлой уратной или кальциево-фосфатной нефропатии, либо комбинация этих патологических состояний.
Гиперкалиемия является наиболее опасным осложнением синдрома острого лизиса опухоли. Если после проведения профилактических/терапевтических мероприятий уровень калия повышается или при предшествующей гиперкалиемии не происходит его быстрого снижения, то угрожающее состояние может развиться в течение нескольких ближайших часов.
Тяжелый синдром острого лизиса опухоли часто осложняется развитием гипокоагуляционной фазы синдрома диссеминированного внутрисосудистого свертывания (ДВС), требующего массивной заместительной терапии свежезамороженной плазмой (не мене 1000 мл 2 раза в день), концентратами тромбоцитов и нередко – проведения плазмафереза.Профилактика синдрома лизиса опухоли
1. аллопуринол — 10 мг/кг в сутки в 2-3 приема (max – 600 мг/сутки) в течение 3 — 8 дней.
Инфузионная терапия:
· Объем = 3000-5000 мл/м 2 /сутки.
· 5% раствор глюкозы « 0,9% раствор NaCl = 1 : 1.
· Удельная плотность мочи < 1010.
· Контроль баланса жидкостей. Баланс: количество выделенной мочи = количество введенной жидкости — потери жидкости с дыханием.
· Контрольное взвешивание 1-2 раза в сутки.
· Интенсивность контроля за диурезом должна соответствовать ситуации и возрасту пациента.
· при недостаточном мочевыведении — лазикс 1-10 мг/кг в сутки внутривенно или инфузией, при сопутствующей гипопротеинемии даже умеренной — альбумин, при необходимости — допамин 3-5 мкг/кг/мин.
· Инициальная инфузия — без калия. Умеренная гипокалиемия — желательна.
· Защелачивание мочи: — NaHCO340 — 80 ммоль/л добавить к постоянной инфузии (или 100-200 ммоль/м 2 /сутки параллельной инфузией).
· Регулирование необходимого объёма NaHCO3 соответственно pH мочи
· значение pH мочи=7,0 является идеальным! — сохраняется достаточная растворимость для мочевой кислоты и ксантина и отсутствует опасность образования фосфорнокальциевых конкрементов.
Лабораторный контроль каждые 12-24 часа: биохимический анализ крови — Na + , K + , Cl — , Ca ++ , фосфаты, мочевая кислота, креатинин, мочевина, белок, альбумин.Многоликий молекулярно-генетический портрет диффузной В-крупноклеточной лимфомы, или в поисках новых терапевтических подходов
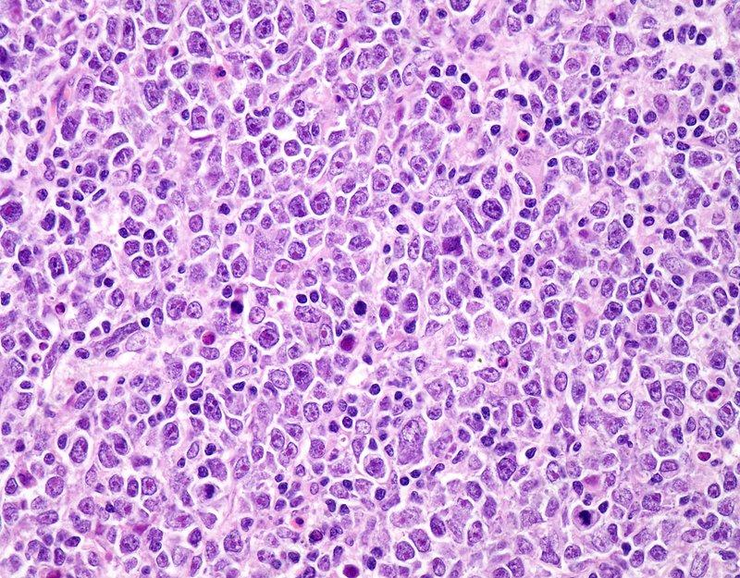
Обзор
Светооптическая микроскопия ткани, пораженной диффузной В-клеточной крупноклеточной лимфомой.
Автор
Редакторы
- Медицина
- Онкология
- Персонализированная медицина
Статья на конкурс «Био/Мол/Текст»: Слово «лимфома» означает опухоль, происходящую из особых клеток иммунной системы — лимфоцитов. Эта опухоль представляет собой скопления злокачественных клеток в организме, предшественниками которых могут быть Т- или В-лимфоциты. В данном обзоре предпринята попытка сконцентрировать наиболее актуальную научную информацию о молекулярной и генетической неоднородности одного из самых распространенных и агрессивных типов лимфом — диффузной В-клеточной крупноклеточной лимфомы, с рассмотрением перспективы персонализированной медицины для данного заболевания.

Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
В онкогематологии все лимфомы классифицируют на два больших класса: лимфома Ходжкина, которая из-за своих уникальных биологических особенностей стоит особняком, и неходжкинские лимфомы. Составляя приблизительно 30% от всех случаев неходжкинских лимфом, диффузная В-клеточная крупноклеточная лимфома (сокращенно ДВККЛ) является одной из самых частых и агрессивных лимфом в мире [1]. На сегодняшний день стандартом первой линии терапии ДВККЛ является режим R-CHOP (читается как «эр-чоп»), в состав которого входят препараты: циклофосфамид, доксорубицин, винкристин и преднизолон с добавлением терапевтического моноклонального антитела ритуксимаб. К сожалению, достигнутыми результатами такой терапии в виде 60% успешного лечения пациентов нельзя удовлетвориться [1]. Остальные 40% больных либо сразу не отвечают на режим R-CHOP, либо довольно быстро рецидивируют, и такие случаи довольно трудно поддаются дальнейшему лечению [1]. Для большего понимания всей драматичности ситуации стоит подчеркнуть, что достижение даже частичной ремиссии по окончании первой линии терапии не является залогом успешного лечения. Именно отсюда такая потребность в поиске новых, альтернативных и перспективных методов в лечении.
Что ж, теперь я хочу пригласить вас в удивительный и сложный мир молекулярного и генетического разнообразия лимфомы. Уверяю вас, что биология рака — как огромный океан: себя можно представить в небольшом батискафе в бездонном морском пространстве; здесь много неизвестного, ты порой не понимаешь, как оценить весь масштаб происходящего, ощущаешь себя мелкой крупицей. Все это пугает и завораживает одновременно. Готовы к погружению?
Такая разная лимфома
Два паттерна экспрессии генов ДВККЛ определяют клинический прогноз
Диффузная В-клеточная крупноклеточная лимфома неспецифицированная (DLBCL, NOS — diffuse large B-cell lymphoma not otherwise specified) представляет собой отдельное заболевание в системе классификации ВОЗ 2017 года [2]. Однако пациенты по-разному отвечают на режим R-CHOP и имеют разный прогноз в отношении выживаемости, что свидетельствует о биологической неоднородности опухоли. Конечно, можно говорить о клинической «разношерстности» пациентов с неодинаковым возрастом, сопутствующей патологией, стадией заболевания на момент постановки диагноза, однако все эти факторы не решают фундаментальной проблемы опухолевой гетерогенности и не дают возможности построения дальнейшей лечебной тактики, основанной на персонализированном подходе.
Наверняка причины опухолевой гетерогенности скрываются в молекулярно-биологических особенностях лимфом. Так, более 20 лет назад была опубликована работа, в которой на основе анализа экспрессии генов методом ДНК-микрочипов исследователи Alizadeh A. и соавторы (2000) выявили три молекулярных подтипа диффузной В-клеточной крупноклеточной лимфомы: GCB- и ABC-подтип, а также неклассифицированный вариант, отличающиеся качественным составом матричной РНК в клетках [3]. GCB-подтип (germinal center B-cell like subtype) ДВККЛ имеет профиль экспрессии генов, соответствующий таковому у B-лимфоцитов герминативного центра лимфатического фолликула (это особенная зона в лимфатическом узле, где В-лимфоцит «обучается» отвечать и реагировать на тот или иной антиген). Стоит полагать, что GCB-подтип лимфомы возникает непосредственно из В-клетки герминативного центра. При злокачественной трансформации этих же клеток может возникать и другой гистологический вариант лимфомы — фолликулярная лимфома, которая характеризуется относительно вялым или, как еще говорят, индолентным течением. Пациенты с фолликулярной лимфомой не всегда требуют начала лечения на момент постановки диагноза, за ними можно просто наблюдать, и в целом фолликулярная лимфома характеризуется более благоприятным прогнозом в сравнении с ДВККЛ.
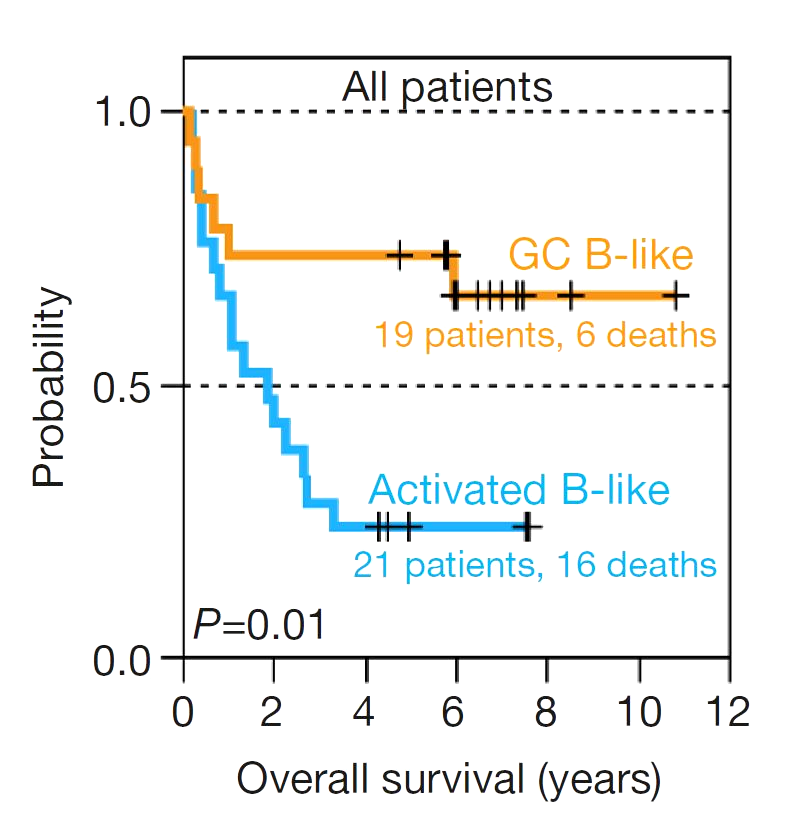
Рисунок 1. Кривые общей выживаемости больных диффузной В-крупноклеточной лимфомой в зависимости от молекулярного подтипа.
Возможно, именно различия в экспрессии генов лежат в основе различного исхода пациентов? Авторы этого же исследования проанализировали общую выживаемость больных, которые получали сопоставимые схемы лечения. Оказалось, что пациенты с GCB-подтипом ДВККЛ имели статистически значимые различия в выживаемости в сравнении с АВС-подтипом (activated B-cell like subtype) ДВККЛ: в среднем общая пятилетняя выживаемость для всех пациентов составила 52%, однако 76% пациентов с GCB-подтипом по достижении пятилетнего рубежа были все еще живы, в то время как только 16% пациентов с ABC-подтипом остались в живых [3]. Исследовательская группа предоставила данные по выживаемости в виде кривых выживаемости Каплана—Мейера (рис. 1). Эти кривые имеют ступенчатый вид и очень часто используются в клинических исследованиях для оценки выживаемости пациентов. В таких графиках каждая ступенька означает наступление неблагоприятного для пациента события: прогрессирование заболевания (при изучении выживаемости без прогрессирования) или летальный исход (при изучении общей выживаемости).
Таким образом, был получен окончательный вывод: диффузная В-клеточная крупноклеточная лимфома представляет собой не одно заболевание, а группу различных по молекулярному патогенезу заболеваний с неодинаковым клиническим прогнозом.
К большому сожалению, даже на сегодняшний день в рутинной онкогематологической практике использование методов анализа экспрессии генов невозможно из-за дороговизны и сложности метода. В качестве альтернативного метода определения молекулярного подтипа ДВККЛ в клинике врачами-патологоанатомами используется окрашивание ткани опухоли в исследовании, основанном на взаимодействии антитела с антигеном — иммуногистохимическая реакция по алгоритму Hans [4], [5]. Данный метод основан на оценке относительного уровня экспрессии всего трех маркеров: CD10, BCL6 и MUM1 (рис. 2). Хоть этот метод более доступен, он не так точен и не позволяет в чистом виде выделить АВС-подтип, поэтому в иммуногистохимическом алгоритме предусмотрено разделение ДВККЛ на GCB- и non-GCB-подтипы.
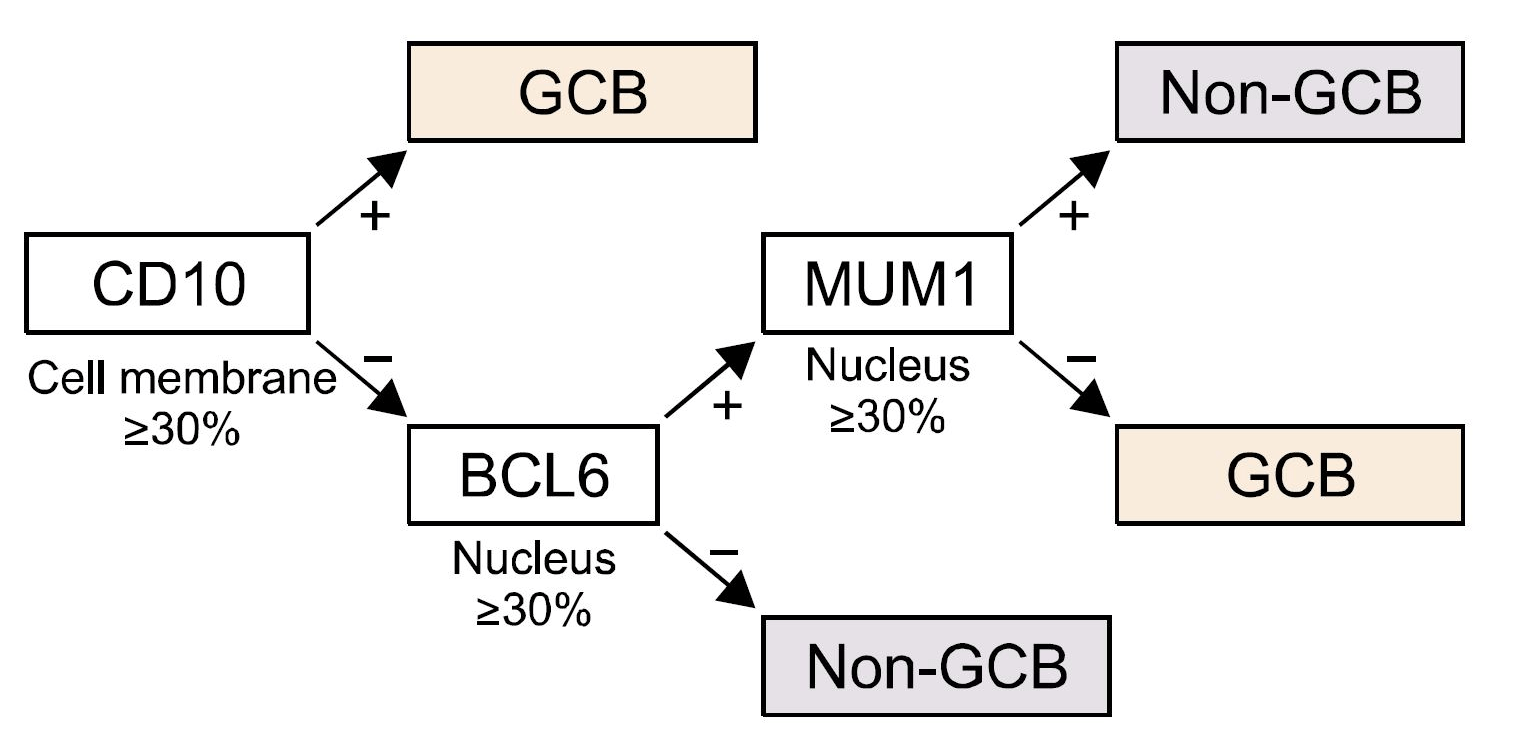
Рисунок 2. Алгоритм Hans для иммуногистохимической идентификации подтипов.
Молекулярные основы патогенеза ABC- и GCB-подтипов ДВККЛ
Генетические поломки, обуславливающие формирование злокачественных лимфом, возникают на определенном этапе нормального развития В-лимфоцита. Опухолевые В-лимфоциты неходжкинских лимфом имеют биологические особенности нормальных В-лимфоцитов, и они используют эти свойства для собственного выживания и размножения злокачественного клона. Это означает, что функционирование В-клеток лимфом в значительной степени определяется уровнем развития или дифференцировки В-лимфоцитов, из которых опухоль происходит. Обратите внимание на основные последовательные стадии дифференцировки В-лимфоцита (рис. 3), начиная от стволовой кроветворной клетки и заканчивая плазматической клеткой, основная функция которой — секреция защитных антител [6]. Это знание еще пригодится нам в дальнейшем.
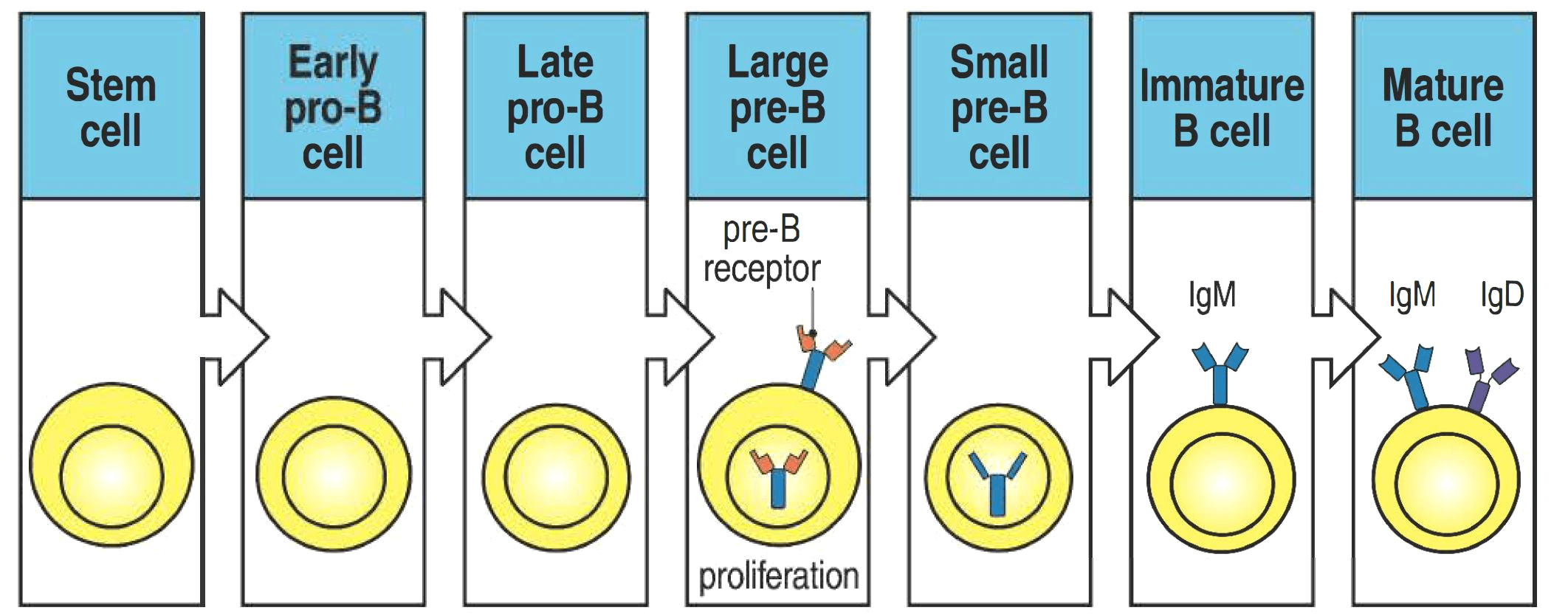
Рисунок 3. Последовательные этапы развития В-лимфоцита.
В костном мозге в процессе В-лимфопоэза (формирования В-лимфоцита из стволовой кроветворной клетки) происходит созревание В-клеточного рецептора лимфоцита — будущего специфичного антитела — за счет V(D)J-рекомбинации при участии ферментов RAG1 и RAG2, которые вносят разрывы в двухцепочечную молекулу ДНК, устраняемые простым соединением концов ДНК. Данное молекулярное событие может стать источником формирования хромосомных транслокаций (перестроек) и образования химерных генов, которые в нормальных клетках отсутствуют и гиперэкспрессия которых значима в патогенезе лимфом. Другим потенциальным источником возникновения генетических поломок является герминативный центр лимфатического фолликула, о котором мы уже говорили ранее. Именно здесь происходят события, связанные с модификацией ДНК, которые представляют собой еще один источник мутагенеза — соматическая гипермутация (накопление большего количества мутаций в генах иммуноглобулинов при участии цитозиндезаминазы AID), в процессе которой происходит созревание аффинитета (сродства) В-клеточного рецептора к антигену, и переключение классов иммуноглобулинов. Таким образом, на определенных этапах нормального развития любого В-лимфоцита существуют молекулярные механизмы, которые создают предпосылки к возникновению генетических поломок и, как следствие, — к развитию лимфом. Возникновение той или иной генетической поломки в В-лимфоците носит вероятностный характер.
Мы не будем далее подробно рассматривать все сложные молекулярные механизмы, лежащие в основе развития В-клеточного звена иммунитета. Все, что сейчас достаточно понимать, так это то, что В-лимфоцит берет свое начало в костном мозге от стволовой кроветворной клетки. Далее В-клетка с током крови мигрирует в лимфатические узлы, где образует герминативый центр — своего рода «школу», где происходит отбор и дополнительное созревание, а также «обучение» распознаванию антигена, после чего успешно окончивший «образовательную программу» В-лимфоцит превращается в плазмоцит, готовый синтезировать специфические антитела, или в В-клетку памяти. Давайте подробнее остановимся только на молекулярных характеристиках В-клетки герминативного центра и плазматической клетки, так как это имеет прямое отношение к подтипам ДВККЛ. Целый набор транскрипционных факторов, то есть регуляторов транскрипции генов — BCL6, MTA3, SPIB, BACH2, OCT2, OCAB, IRF8 — формируют фенотип В-клетки герминативного центра (рис. 4) [7]. Эти клетки экспрессируют BCL6, представляющий собой репрессор (то есть подавитель, угнетатель) транскрипции. Белок BCL6 подавляет многие гены, вовлеченные в дифференцировку плазматических клеток, клеточный цикл, ответ на повреждение ДНК и программируемую клеточную смерть. Но как только В-лимфоцит герминативного центра начинает дифференцироваться в плазматическую клетку, повышение уровня экспрессии плазмоклеточных маркеров IRF4 и Blimp-1 угнетает BCL6, тем самым продвигая клетку к конечному, терминальному этапу дифференцировки — плазмоциту.
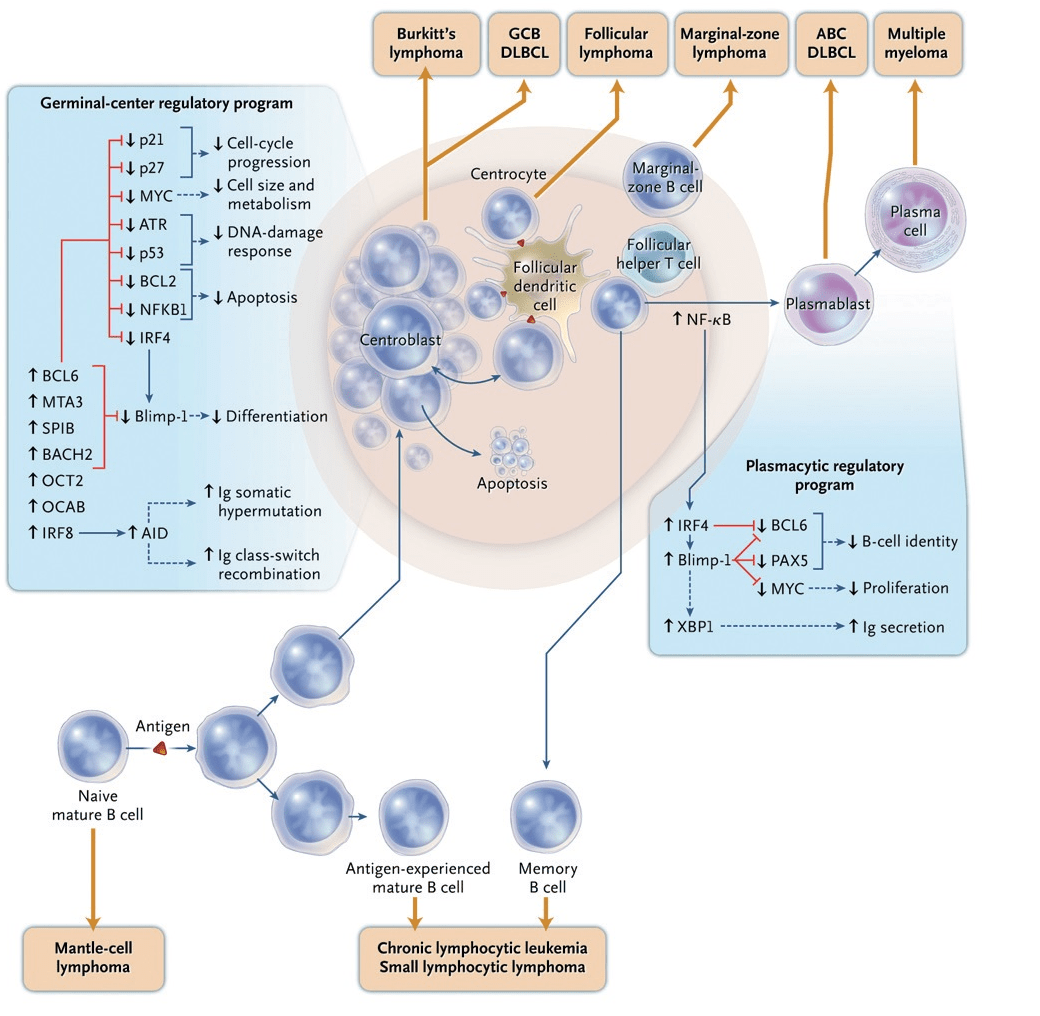
Рисунок 4. В-клеточная дифференцировка, лимфомагенез и профиль экспрессии генов на различных этапах созревания В-лимфоцита. Злокачественные лимфомы могут возникнуть на разных этапах нормального развития В-лимфоцита. По мере созревания В-лимфоцита его генетическая регуляторная программа переключается с профиля В-лимфоцита герминативного центра на плазмоцитоидный профиль.
Наконец, мы добрались до кульминационной части данного раздела. В случае прогностически более благоприятного варианта — GCB-подтипа ДВККЛ — экспрессионный профиль генов таков, что он соответствует профилю В-лимфоцита герминативного центра, при этом активность молекулярного сигнального пути NF-kB (nuclear factor kappa-B) в таких клетках снижена [7]. Наоборот, в случае клинически неблагоприятного АВС-подтипа ДВККЛ активность NF-kB высока, что может служить одним из механизмов избегания программируемой клеточной гибели — апоптоза. Такие опухолевые клетки экспрессируют маркеры, характерные для плазматических клеток, включая IRF4 и транскрипционный фактор XBP1 — регулятор секреции иммуноглобулинов. Однако при этом полное развитие В-лимфоцитов АВС-подтипа лимфомы в нормальный плазмоцит невозможно из-за блока дифференцировки [7].
Роль активации NF-kB и сигнального пути В-клеточного рецептора в АВС-подтипе ДВККЛ
Как уже было отмечено ранее, успешная стратегия выживания опухолевого В-лимфоцита может объясняться высокой зависимостью от NF-kB для АВС-подтипа ДВККЛ, но не для GCB-подтипа. А также известно о том, что каскадный внутриклеточный сигнальный путь В-клеточного рецептора в случае АВС-подтипа находится в состоянии хронической гиперактивации [7]. Существует довольно несложный способ продемонстрировать, что эти сигнальные пути являются жизненно важными для опухолевых клеток. Для этого достаточно их заблокировать или выключить. На клеточных линиях, являющихся моделями АВС-подтипа ДВККЛ, исследователи Davis R.E. и соавторы (2010) с помощью явления РНК-интерференции продемонстрировали нежизнеспособность опухолевого клона при подавлении экспрессии одного из ключевых посредников сигнала от В-клеточного рецептора — Брутоновской тирозинкиназы [8]. С другой стороны, Lam L.T. и соавторы (2005) успешно подтвердили токсический эффект блокатора IKK, который связан с путем NF-kB в В-лимфоцитах АВС-подтипа [9].
Что, если результаты этих исследований использовать в терапевтических целях? Сложная система внутриклеточных молекул-посредников злокачественного В-лимфоцита АВС-подтипа ДВККЛ может стать интересным объектом терапевтического воздействия (рис. 5). В фармакологической тяжелой артиллерии врача-гематолога уже сегодня имеются блокаторы В-клеточного рецепторного каскада (ибрутиниб — ингибитор Брутоновской тирозинкиназы, дувелисиб — ингибитор PI3K, полатузумаб ведотин — связывает CD79b) и протеасомные ингибиторы (бортезомиб), которые, косвенно воздействуя на NF-kB, предотвращают его проникновение в клеточное ядро и реализацию программы выживания. Более интересной терапевтической мишенью для лечения ДВККЛ могут стать компоненты комплекса CARD11/BCL10/MALT1 (рис. 5). Приблизительно 10% всех АВС-подтипов лимфом имеют активационную мутацию в CARD11, которая обуславливает автономное формирование внутрицитоплазматических белковых агрегатов CARD11/BCL10/MALT1/TRAF6, что приводит к активации IKK, а в последующем — к запуску NF-kB [7]. Причем такая мутация делает независимым сигнальный путь NF-kB от посредников (мессенджеров) сигнала от В-клеточного рецептора, стоящих выше CARD11.
Рисунок 5. Функционирование внутриклеточного сигнального каскада В-клеточного рецептора для нормального В-лимфоцита (А) и в случае В-лимфоцита АВС-подтипа ДВККЛ с мутантным и диким вариантами CARD11 (B).
Использование таргетных препаратов, упомянутых выше, уже одобрено для лечения многих гематологических заболеваний, но в случае с ДВККЛ имеются нюансы, о которых мы подробнее поговорим с вами в разделе «Несменяемый монарх „Сэр“-чоп».
Повторяющиеся мутационные паттерны ДВККЛ отражают профиль экспрессии генов
Рисунок 6. Секторальные диаграммы, отражающие относительное представительство молекулярного подтипа ДВККЛ на основе профиля экспрессии генов одному из четырех генетических подтипов, и наоборот.
(а) — доля молекулярных подтипов ДВККЛ (АВC-подтип, GCB-подтип и неклассифицируемый) среди генетических вариантов ДВККЛ (MCD, BN2, N1, EZB).
(б) — доля генетических подтипов ДВККЛ (MCD, BN2, N1, EZB) среди молекулярных подтипов ДВККЛ (АВC-подтип, GCB-подтип и неклассифицируемый). (в) — общая доля всех генетических подтипов ДВККЛ среди всех случаев.Не так давно представления о разнообразии ДВККЛ несколько усложнились. Schmitz et al. (2018) провели секвенирование экзома [10] и транскриптомный анализ RNA-seq 574 образцов ДВККЛ и выявили группы повторяющихся от случая к случаю мутаций в опухолевой ДНК, которые ассоциированы с одним из молекулярных подтипов [11]. Исследовательской группе удалось выделить четыре генетических типа ДВККЛ: MCD (сосуществующие мутации MYD88 и CD79b в опухоли), BN2 (транслокация BCL6 и мутация NOTCH2), N1 (мутация NOTCH1) и EZB (мутация EZH2 и транслокация BCL2) [11]. Только 46,6% случаев ДВККЛ удалось классифицировать по данным генетическим группам; оставшаяся часть лимфом не может быть отнесена ни к одному из подтипов и считается неклассифицированной. Нетрудно заметить (рис. 6), что подавляющее большинство молекулярных подтипов в случае MCD и N1 генетических вариантов соответствуют АВС-подтипу, а EZB вариант — GCB-подтипу [11]. Примечательно, что определение генетических групп, подобно молекулярным группам, имеет клиническое значение с точки зрения прогноза для пациента. Исследование безрецидивной и общей выживаемости пациентов в свете генетических подтипов позволяет сделать вывод о том, что прогностически более неблагоприятными вариантами можно считать N1 и MCD варианты (рис. 7).
Рисунок 7. Кривые безрецидивной (а) и общей (б) выживаемости больных ДВККЛ различных генетических подтипов.
Современный многоликий молекулярно-генетический портрет ДВККЛ был «написан» только в 2020 году. Wright G.W. и соавторы (2020) предложили использовать алгоритм LymphGen для генетической классификации ДВККЛ, расширив уже имеющуюся классификацию двумя новыми вариантами, а именно ST2 и А53 (рис. 8), основываясь на повторяющихся сочетаниях мутаций в SGK1 плюс TET2 и анеуплоидии (т.е. явлении, при котором количество хромосом в клетке становится не кратно 23) с мутацией TP53, соответственно [12]. Таким образом, современный алгоритм LymphGen позволяет распределить по подтипам уже 63,1% случаев диффузной В-клеточной крупноклеточной лимфомы [12].
Рисунок 8. Интегральная схема, отражающая взаимоотношение молекулярных подтипов лимфомы на основе профиля экспрессии генов и генетических подтипов, а также потенциальные молекулярные мишени для терапевтических приложений для того или иного генетического типа.
Несменяемый монарх «Сэр»-чоп
Несмотря на очевидный прогресс в понимании молекулярно-генетического разнообразия и патогенеза ДВККЛ и вопреки многообещающим результатам, полученным при исследовании токсического эффекта таргетных лекарственных препаратов на опухолевые клетки в экспериментальных моделях, на текущий момент в самых последних обновлениях американских клинических онкологических рекомендаций NCCN и в европейских рекомендациях медицинской онкологии ESMO альтернатив режиму R-CHOP в первой линии терапии нет [13].
Такие несоответствия обусловлены тем, что не всегда логичная и стройная идея об эффективности лекарственного препарата, подтвердившаяся в доклинических исследованиях, сможет оправдать себя в клинических исследованиях, в которых принимают участие живые больные люди. Более того, даже наличие статистически значимых различий между экспериментальным лечением и золотым стандартом или плацебо в пользу экспериментального лекарственного препарата не говорит о реальной клинической значимости, выраженной в количестве месяцев или лет жизни, прожитых пациентом в ремиссии в хорошем качестве. Уже имеющиеся результаты крупных клинических исследований II и III фаз по лечению пациентов с впервые выявленной ДВККЛ в попытке улучшить результаты лечения путем добавления ибрутиниба (исследование PHOENIX), леналидомида (исследования ROBUST и E1412) или бортезомиба (исследование REMoDL-B) к стандартному режиму терапии R-CHOP в первой линии, к сожалению, не увенчались успехом [14–17].
Вместо заключения. Зачем изучать такую сложную молекулярную биологию рака?
Если вы уже устали, дойдя до этого момента, из-за всех сложных биологических концепций разнообразия ДВККЛ, то я поспешу вас обрадовать тем, что в этом обзоре освещается лишь только один гистологический вариант лимфомы. Да, современные молекулярно-биологические представления опухолевого роста разнообразны и огромны. Одних внутриклеточных молекулярных посредников, участвующих в каскадных сигналах, существует сколько! А сколько мутаций во всех раковых генах! Весь этот массив информации в голове просто не удержать.
Сегодняшний рынок онкологического биофармацевтического производства представляет совокупность лекарственных препаратов, назначение которых основано на знаниях генетики рака, создавая тем самым возможность прицельного, направленного воздействия на опухоль. Да, да, вы, наверное, уже догадались, что я сейчас говорю именно о персонифицированной или персонализированной медицине в онкологии. Клиницисты сегодня знают довольно немало таких примеров: назначение эрлотиниба пациенту с аденокарциномой легкого при наличии мутации L858R в гене рецептора эпидермального фактора роста EGFR, вемурафениб для лечения распространенной меланомы при обнаруженной мутации в опухоли V600E в гене BRAF, иматиниб как блокатор BCR-ABL при терапии хронического миелолейкоза, мидостаурин в лечении острого миелоидного лейкоза при выявленной мутации в FLT3. Всего этого и многого чего другого просто не было, если бы не развивалась биомедицинская наука. От знаний в молекулярной биологии и генетики выигрывают абсолютно все: ученые удовлетворяют собственный научный интерес и любопытство, врачи принимают участие в клинических исследованиях, развивается фармацевтический рынок, появляются новые профессиональные кадры, а пациенты дольше живут, имея хорошее качество жизни.
Пусть сегодня успехи в выборе клинически эффективного таргетного лекарственного препарата на основе молекулярно-генетических характеристик ДВККЛ не так грандиозны, как хотелось бы, совершенно очевидно одно — дальнейшее усложнение наших представлений в отношении молекулярной генетики опухолей, особенно в условиях расширенной доступности технологий высокопроизводительного секвенирования непременно приведут к революционным терапевтическим подходам в не столь отдаленном будущем. В заключение стоит отметить, что попытка модифицировать схему R-CHOP предпринимается сейчас авторами исследования POLARIX, где они предлагают сравнить режим Pola-R-CHP (полатузумаб ведотин, ритуксимаб, циклофосфамид, доксорубицин, преднизолон) со стандартом, и уже получены результаты: 2-летняя выживаемость без прогрессирования у пациентов из группы лечения Pola-R-CHP составила 76,7% в сравнении с 70,2% у пациентов стандартной терапии R-CHOP. Более того, за последние два года появились возможности лечения рефрактерных или рецидивирующих форм ДВККЛ, такие как биспецифические моноклональные антитела (глофитамаб, мосунетузумаб, эпкоритимаб, одронекстамаб) и CAR-T клеточная терапия.
Диффузная В-крупноклеточная лимфома
Диффузная В крупноклеточная лимфома (ДВКЛ) — это группа опухолей лимфатической системы, в основе которой лежит трансформация В-лимфоцитов в злокачественные клетки.
Причины возникновения и группы риска
Причиной возникновения ДВКЛ является изменение В-лимфоцитов, т. е. нарушение структуры ДНК. Из-за этого клетки начинают бесконтрольно расти и размножаться, рассеиваясь по всему организму и поражая различные органы и системы. Почему возникают эти мутации, достоверно не установлено. Более того, есть много людей, у которых обнаруживаются характерные генетические поломки, но нет лимфомы. Данный вопрос продолжает изучаться.
В настоящее время принято говорить о факторах риска, которые повышают вероятность развития данного заболевания:
- Врожденные и приобретенные иммунодефициты: синдром Вискотта-Олдрича, Луи-Бара, СПИД, необходимость лечения, которое снижает иммунитет: цитостатики, иммуносупрессоры при трансплантации органов и др.
- Вирусные инфекции: ВИЧ, гепатит С, Т-лимфотропный вирус.
- Аутоиммунные заболевания: ревматоидный артрит, волчанка и др.
- Токсическое воздействие инсектицидов, гербицидов, бензола.
- Лечение посредством цитостатической и лучевой терапии.
Симптомы диффузной крупноклеточной В лимфомы
Крупноклеточная лимфома может проявляться множеством симптомов, но все их многообразие можно уложить в три синдрома:
- Увеличение лимфатических узлов — лимфаденопатия. Чаще всего, лимфома манифестирует безболезненным увеличением лимфатических узлов, которые можно обнаружить визуально или при пальпации. Но бывает так, что поражаются узлы, недоступные для осмотра и пальпации (например, в грудной или брюшной полости), тогда этого признака сразу может и не быть.
- Симптомы интоксикации: повышение температуры, не связанное с инфекцией, сильная потливость, потеря веса. Комбинацию этих признаков называют В-симптоматикой. Ее наличие имеет значение при определении стадии заболевания.
- Симптомы, которые развиваются, когда крупноклеточная лимфома переходит на другие органы и системы. Это могут быть боли в груди и кашель, боли в животе и нарушение стула. При поражении ЦНС развиваются головные боли, нарушение зрения и рвота. Из-за разрушения костного мозга снижается иммунитет, развивается анемия и склонность к опасным кровотечениям.
Классификация, формы и стадии диффузной лимфомы
Современная классификация крупноклеточной лимфомы базируется на клинических данных и степени распространенности опухолевого процесса.
Классификация Ann Arbor:
- 1 стадия. Поражение ограничено одной лимфатической зоной или одним экстралимфатическим органом или одним сегментом экстралимфатической ткани.
- 2 стадия. Поражено две и более зоны лимфатических узлов по одну сторону диафрагмы. При поражении внелимфатических органов или тканей обнаруживаются метастазы в регионарные лимфатические узлы.
- 3 стадия. Имеются единичные очаги поражения по обе стороны диафрагмы.
- 4 стадия. Имеются множественные очаги поражения экстралимфатических органов, либо ограниченное поражение экстралимфатических органов с отдаленными метастазами, либо поражение печени и костного мозга.

Классификация Ann Arbor дополняется модификацией Cotswold:
- А — нет В-симптомов.
- В — есть хотя бы один из В-симптомов.
- Е — есть локализованные экстранодальные очаги.
- S — лимфома поразила селезенку.
- X — имеется массивное опухолевое тканей и внутренних органов.
Диагностика диффузной крупноклеточной лимфомы
Диагноз неходжкинская лимфома выставляется на основании гистологического и иммуногистохимического исследования опухолевой ткани. Для того чтобы получить материал, проводят инцизионную или эксцизионную биопсию лимфатических узлов. Помимо этого, выполняют молекулярно-генетические и иммунофенотипические исследования, которые позволят определить вид опухоли, наличие тех или иных генетических изменений и подобрать оптимальный метод лечения.
Для определения стадии лимфомы проводят следующие исследования:
- Трепанобиопсия костного мозга.
- Методы лучевой диагностики — УЗИ, КТ, ПЭТ-КТ, МРТ.
- Также назначается ряд лабораторных анализов — развернутый анализ крови, определение маркеров парентеральных гепатитов, анализ на ВИЧ, биохимические исследования и др.
Лечение диффузной В-крупноклеточной лимфомы
Лечение диффузной лимфомы определяется исходя из следующих данных:
- Риски рецидива согласно IPI.
- Возраст пациента.
- Его состояние (сможет ли больной перенести высокодозную полихимиотерапию).
В качестве основных методов лечения крупноклеточной лимфомы применяется химиотерапия и в некоторых случаях облучение. Перед началом терапии фертильных пациентов обсуждается вопрос о криоконсервации гамет (половых клеток), поскольку лечение может вызвать бесплодие.

Главным критерием подбора терапии является международный прогностический индекс IPI, который включает следующие аспекты:
- Возраст. Младше 60 лет — 0 баллов, старше — 1 балл.
- Состояние пациента по ECOG (активность больного и способность к самообслуживанию). 1-2 балла по ECOG это 0 по IPI, и 3-4 балла по ECOG — это 1 балл по IPI.
- Уровень ЛДГ. В норме — 0 баллов по IPI, повышен — 1 балл.
- Стадия лимфомы. 1-2 — 0 баллов, 3-4 — 1 балл.
- Наличие более 1 экстранодальной зоны поражения. Нет — 0, да — 1.
Интерпретация IPI следующая:
- 0-1 балл — лимфома низкого риска.
- 2 балла — лимфома промежуточно низкого риска.
- 3 балла — лимфома промежуточно высокого риска.
- 4-5 баллов — лимфома высокого риска.
Пациенты из группы низкого и промежуточно-низкого риска начинают свое лечение с 6 циклов иммунохимиотерапии по протоколу R-CHOP-21. Эта схема, помимо цитостатиков, предполагает применение иммунотерапевтического препарата ритуксимаба. Такая схема позволяет добиться пятилетней выживаемости у 80% больных. Для пациентов с 3-4 стадией заболевания, лечение дополняется лучевой терапией на зоны массивного и экстранодального опухолевого поражения.

Лечение пациентов из групп промежуточно-высокого и высокого риска подбирается индивидуально с учетом возраста и состояния больного по шкале ECOG. Молодым пациентам с хорошим соматическим состоянием назначаются более агрессивные схемы лечения, предполагающие проведение высокодозной химиотерапии с трансплантацией гемопоэтических стволовых клеток (ГСК). При высоких рисках поражения нервной системы проводится несколько циклов интратекальной химиотерапии, когда препараты вводят в спинномозговой канал. Пожилым и слабым пациентам подбираются более щадящие схемы. Оценка эффективности лечения производится в середине циклов химиотерапии и после их окончания.
Восстановление после лечения крупноклеточной неходжкинской лимфомы
В целом, после того как у пациента диагностировали ремиссию, он должен регулярно наблюдаться у онколога. Сначала раз в три месяца, потом раз в полгода, а потом ежегодно. Если через пять лет после достижения ремиссии, у пациента нет признаков заболевания, его считают выздоровевшим и снимают с учета.
Рецидивы крупноклеточной лимфомы
При лечении диффузной В-крупноклеточной лимфомы долгосрочной ремиссии удается достичь в 70-80 % случаев, но у ряда пациентов возникает рецидив. Лечение рецидивов проводится по следующей схеме:
- Химиотерапия второй линии. Она должна подавить опухолевый рост, в то же время не нанося ущерба гемопоэтическим стволовым клеткам.
- Сбор ГСК.
- Высокодозная химиотерапия. Используются высокие дозы цитостатиков, которые уничтожают самые стойкие опухолевые клетки, но они же губят и кроветворение, поэтому чтобы его восстановить проводят следующий этап.
- Трансплантация гемопоэтических стволовых клеток, которая призвана восстановить кроветворение.
У пациентов из групп высокого риска, которые уже прошли аутологичную трансплантацию, и получили рецидив диффузной лимфомы, проводят аллогенную трансплантацию, т. е. используют стволовые клетки доноров. В этих случаях также есть шансы на полную ремиссию, но они не превышают 50%.
Осложнения диффузной В крупноклеточной лимфомы
Химиотерапия и лучевая терапия диффузной крупноклеточной лимфомы пагубно влияют не только на злокачественную опухоль, но и на все быстро делящиеся клетки. Это кроветворные клетки, эпителий кожи и слизистых оболочек и др. Поэтому в процессе лечения и восстановления большое внимание уделяется профилактике осложнений. В первую очередь, это борьба с инфекциями (бактериальными, вирусными, грибковыми), нарушением кровесвертывающей системы и работы пищеварительного тракта.
Помимо этого, в долгосрочной перспективе есть риск развития следующих осложнений:
- Возникновение других злокачественных опухолей: рак легкого, молочной железы, желудка, а также лейкозов и других видов лимфом. Наибольшие риски отмечаются в первые десятилетия после прекращения лечения.
- Кардиоваскулярные осложнения: нарушение работы миокарда, быстрый атеросклероз кровеносных сосудов, повреждение клапанов сердца и др.
- Поражение легких: пульмониты, пневмосклероз и пневмофиброз.
- Осложнение со стороны эндокринной системы: гипотиреоз, бесплодие, нарушение сперматогенеза.
Прогноз и профилактика крупноклеточной лимфомы
Прогноз течения диффузной В крупноклеточной лимфомы зависит от показателя IPI. Чем больше баллов, тем хуже прогноз. Для больных, имеющих 4-5 баллов (высокий риск), пятилетняя выживаемость колеблется в пределах 31%. При низких рисках пятилетняя выживаемость составляет около 91%.
Что касается специфической профилактики, то ее на сегодняшний день не существует, а все рекомендации для минимизации риска заболевания сводятся к ведению здорового образа жизни и правильному питанию.
Источник https://diseases.medelement.com/disease/%D0%B2-%D0%BA%D1%80%D1%83%D0%BF%D0%BD%D0%BE%D0%BA%D0%BB%D0%B5%D1%82%D0%BE%D1%87%D0%BD%D1%8B%D0%B5-%D0%BB%D0%B8%D0%BC%D1%84%D0%BE%D0%BC%D1%8B-%D1%83-%D0%B2%D0%B7%D1%80%D0%BE%D1%81%D0%BB%D1%8B%D1%85/14980
Источник https://biomolecula.ru/articles/mnogolikii-molekuliarno-geneticheskii-portret-diffuznoi-limfomy
Источник https://www.euroonco.ru/onkogematologiya/limfoma/diffuznaja-b-krupnokletochnaja-limfoma