Хронический миелолейкоз: 200 лет борьбы со случайной мутацией

В июле этого года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) впервые за историю отечественной фармацевтики присвоило орфанный статус российскому экспериментальному лекарству. Им стал препарат для лечения хронического миелоидного лейкоза. MedAboutMe разбирался, что это за болезнь и есть ли шансы избавиться от нее полностью, например, с помощью нового средства, созданного нашими учеными.

Суперфуды в косметике: сочные коктейли для здоровья кожи и волос
ХМЛ: история открытия

История открытия хронического миелолейкоза (ХМЛ) и его лечения тесно связана с историей науки и медицины. А началось знакомство медиков с ХМЛ в 1811 году, когда Петер Каллен описал пациента с острым воспалением селезенки и «молочной кровью». В 1845 году, когда еще микроскопы уже были, а методов окрашивания клеток еще не придумали, шотландский патологоанатом Джон Беннетт описал в своих статьях ткани увеличенной селезенки и печени, полученные от двух пациентов, умерших «от заражения крови». В частности, Беннетт представил изображения лейкоцитемии — необычных клеток крови. А буквально через 1,5 месяца аналогичную картину обнародовал другой патологоанатом — немец Рудольф Вирхов. И он первым предположил, что дело не в сепсисе, а в неизвестной ранее болезни. Еще через 2 года Вирхов обнаружил аналогичный случай и впервые озвучил название предполагаемой болезни — «селезеночная лейкемия». Так что ХМЛ — это первое заболевание, названное «лейкемией».
Надо отметить, медицинское сообщество негативно восприняло доклады Вирхова. Один из его коллег даже заявил: «У нас уже достаточно болезней, нам не нужны новые!» Но история шла своим чередом. В 1846 году было опубликовано подробное описание болезни, сделанное не патологоанатом, а врачом, лечившим еще живого человека. А с 1880 года, с появлением методов окрашивания клеток для микроскопического исследования ученые получили возможность не только в подробностях рассмотреть клетки ХМЛ, но и выявить разные формы «лейкемии».
В 1950-х годах американские исследователи П. Ноуэлл и Д. Хангерфорд обнаружили, что у всех пациентов с ХМЛ одна из хромосом укорочена. Более того, полученные ими данные говорили о клоновом характере болезни, то есть она развивалась из единственной клетки, получавшей благодаря мутации дополнительные преимущества в росте. Это в итоге и вело к увеличению клона больных клеток. По имени города, в котором было сделано данное открытие, укороченная хромосома стала называться «филадельфийской» (Ph+). Но позднее оказалось, что дело не просто в укороченной хромосоме.
Что же такое хронический миелоидный лейкоз?
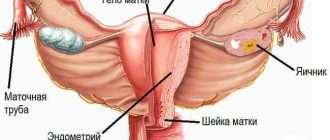
Сегодня известно, что хронический миелолейкоз развивается в результате транслокации — обмена участками между 9-й и 22-й хромосомами. То есть, 9-я хромосома теряет кусочек, а 22-я — его себе прицепляет. Главная проблема в том, что при переносе этот участок ДНК встраивается в область, где находится онкоген ABL. У людей этот ген кодирует белок, необходимый для кроветворения, причем отдельный его домен играет роль фермента тирозинкиназы и запускает процессы пролиферации клеток (их активного размножения). Еще один домен предназначен, чтобы останавливать работу тирозинкиназы. При перемещении участка с 9-й хромосомы образуется новый ген BCR-ABL — это маркер хронического миелолейкоза. Белок, который должен блокировать функцию тирозинкиназы, больше не работает. Пролиферация запускается «на полную катушку» и, кроме того, отменяется апоптоз (запрограммированная смерть старых и поврежденных клеток).
Стволовые клетки, где выявлена транслокация с 9 на 22 хромосому, получили название Ph-позитивных. У пациентов с ХМЛ есть и Ph-позитивные клетки, и Ph-негативные. И первые в силу своей бесконтрольной активности вытесняют вторых.
Как проявляется ХМЛ?

Для описания хронического миелолейкоза используют не перечень симптомов — он слишком обширен, а перечень синдромов, то есть симптомокоплексов. Соответственно, выделяют:
- Синдром опухолевой интоксикации.
У пациента наблюдается анемия, он ощущает слабость, потливость, боли в суставах и костях, постоянный зуд. Человек теряет вес, у него ухудшается аппетит, держится субфебрильная температура.
- Синдром опухолевой пролиферации (то есть бесконтрольное размножение клеток и трансформация их в клетки опухоли).
Увеличивающаяся селезенка приводит к появлению болей в левом боку. Часто также увеличивается печень.
- Анемический синдром.
Слабость, постоянная одышка, тахикардия, пониженное артериальное давление, непереносимость физических нагрузок, бледность слизистых оболочек и кожи. На этом фоне могут активизироваться уже имеющиеся сердечно-сосудистые болезни.
- Геморрагический синдром.
Развивается на фоне дефицита тромбоцитов (тромбоцитопении) и проявляется в виде кровотечений даже при легких травмах, высыпаний в виде петехий (мелкие точечные кровоподтеки) и синяков.
- Тромботические проявления.
Значительно повышается риск развития тромбоэмболий органов и тканей, тромбозов.
Три фазы болезни
В течение ХМЛ выделяют три основные фазы:
- Хроническая фаза — ее диагностируют у 80% пациентов, это начальная фаза заболевания.
- Фаза акселерации — на этой стадии выявляется 8-10% пациентов, патологический процесс в разгаре.
- Бластный криз — к врачам на этой стадии впервые попадают только 1-2%. Болезнь в этой фазе максимально агрессивна.
Срок жизни пациентов, у которых болезнь была выявлена в фазе акселерации и на стадии бластного криза, недолог — 6-12 месяцев.
Кто болеет ХМЛ?

Это редкое заболевание. Оно встречается с частотой 1,4-1,6 случаев на 100 тысяч взрослых людей. В основном хроническим миелолейкозом болеют именно взрослые: на это заболевание среди них приходится 20% от всех лейкозов и только 2% — у детей. Чаще болезнь впервые проявляется у пациентов в возрасте 40-50 лет.
Мужчины болеют чуть чаще женщин, соотношение составляет 1,4:1.
В нашей стране проживает 8 тысяч людей с диагнозом «хронический миелолейкоз». Заболеваемость составляет 0,08 случая на 100 тысяч россиян.
Лечение ХМЛ: от мышьяка до современной химиотерапии
ХМЛ и мышьяк
С 1865 года новую болезнь стали пробовать лечить. Особой любовью врачей середины-конца XIX века пользовался мышьяк. Его применяли в виде «фаулерова раствора», который представлял собой 1%-ный водно-спиртовой раствор арсенита калия. Дабы не перепутать препарат с водой, его ароматизировали лавандой. Это средство было изобретено еще в XIII веке Томасом Фаулером, и им лечили практически все, что не лечилось другими способами: астму, сифилис, экзему, эпилепсию, ревматизм. Неудивительно, что было решено опробовать мышьяковую панацею и против свежеоткрытой лейкемии.
И в общем эффект определенный был достигнут. Селезенка становилась меньше, больные чувствовали себя лучше. Правда, недолго — жизнь человека с ХМЛ после постановки диагноза даже на фоне лечения не превышала 2-3 лет.
Лучевая терапия ХМЛ
В 1895 году наука обрела мощное средство диагностики и терапии — рентген. За это открытие К. Рентген получил Нобелевскую премию по физике, но врачи быстро сообразили, как можно использовать рентгеновское излучение для лечения больных. Американец Н. Сенн в 1903 году впервые применил лучевую терапию для терапии ХМЛ. Обработанная рентгеновскими лучами селезенка действительно стала меньше, количество лейкоцитов снизилось — казалось, решение найдено. Но, увы, со временем выяснилось, что эффект лучевой терапии длится около полугода, и с каждым следующим разом становится все слабее и короче.
И все же, за неимением других средств, терапия рентгеновскими лучами оставалась единственным методом для лечения пациентов с ХМЛ практически до середины XX века. Болезнь удавалось вывести на стадию ремиссии, которая длилась около полугода, а в среднем такой больной жил 3-3,5 года. Прожить 5 лет удавалось лишь 15% пациентов.
Химиотерапия ХМЛ

Эпоху химиотерапии ХМЛ открыл англичанин Д. Голтон. Он впервые использовал для борьбы с болезнью миелосан, синтезированный в 1953 году его соотечественниками. Этот препарат имеет множество имен: американцы называют его бусульфан, французы — мизульбан, англичане — милеран, ну а миелосан — принятое в России название.
Новое лекарство казалось чудом. Оно хорошо переносилось и демонстрировало высокую эффективность, даже в случаях лечения людей, которым не помогала лучевая терапия. Препарат позволял держать под контролем уровень лейкоцитов и не давал разрастись селезенке. Пациенты с ХМЛ перестали становиться инвалидами уже в первый год болезни — вместо стационаров они смогли жить дома и вести полноценную жизнь. И ее продолжительность тоже выросла и составляла 3,5-4,5 года. До 5 лет доживали уже 30-40% пациентов. Причиной тому было отсутствие тяжелых побочных эффектов, свойственных рентгенотерапии: анемия, кахексия (истощение), инфекции.
Миелосан продлил жизнь, пациенты стали жить дольше и, значит, больше больных стало доживать до фазы бластного криза и терминальной стадии недуга. Смерть таких пациентов была нелегкой. Скачки температуры, чередующиеся с приступами озноба, кахексия, стремительное увеличение селезенки и печени, слабость и, главное, сильнейшие боли. Даже возник спор: не следует ли считать миелосан причиной развития бластного криза? Ведь при рентгенотерапии такого количества случаев не наблюдалось. Но в 1959 году было проведено исследование, в ходе которого было доказано, что через 3 года с его начала в живых оставалось 62% больных, лечившихся миелосаном, и только треть группы, которую лечили рентгеновскими лучами. В целом, продолжительность жизни при приеме миелосана была на год больше, чем при лучевой терапии. Это исследование стало последней точкой в принятии решения о практически полном отказе от рентгенотерапии, как основного метода лечения ХМЛ.
Ученые продолжали поиски лекарства. Была доказана эффективность применения гидроксимочевины, которая блокировала фермент рибонуклеотидазу, участвующую в синтезе ДНК. И это вещество продлило жизнь пациентов с ХМЛ еще на 10 месяцев.
А в 1957 году медицина получила в свое распоряжение интерфероны — и в лечении ХМЛ начался новый этап. С их помощью буквально за пару месяцев удавалось вывести пациента в ремиссию, причем у некоторых больных снижалось количество Ph-позитивных клеток.
Путем сочетания интерферонов с другими препаратами удалось добиться того, что от 27% до 53% пациентов имели все шансы прожить уже 10 лет с момента постановки диагноза, а в группах, где болезнь выявили на очень ранних стадиях — на 10 лет жизни могли рассчитывать от 70% до 89% больных.
Главное, что не устраивало врачей и ученых в интерферонах — это все еще был не метод лечения ХМЛ. Избавиться полностью от Ph-позитивных клеток даже с их помощью не удавалось.
Пересадка стволовых клеток
В конце прошлого века стал набирать популярность метод трансплантации геомпоэтических стволовых клеток. Речь шла уже о 10- и даже 20-летней выживаемости — и это были вполне реальные цифры для трети пациентов, пролеченных этим методом. Но, во-первых, и этот метод не излечивал пациента полностью. А во-вторых, только у 20-25% людей с хроническим миелолейкозом есть шанс найти совместимого родственного донора. Если речь идет о неродственном доноре — вероятность его отыскать значительно ниже. То есть, изначально далеко не все пациенты могут быть пролечены данным методом.
Ингибиторы тирозинкиназы
Наконец, ученым удалось нащупать слабое место у болезни. Настоящей победой над ХМЛ стал иматиниб (Гливек) — это вещество встраивается в «карман» белка ABL-тирозинкиназы и блокирует его работу. Эффективность нового лекарства была так высока, что FDA стремительно зарегистрировало его и дало добро на применение. Результаты лечения иматинибом были значительно лучше, чем любым другим методом.
Но нет в мире совершенства. Оказалось, что со временем многие пациенты развивают устойчивость к этому лекарству, а повышение дозы — слишком токсично для организма.
В ходе интенсивных фармацевтических поисков были созданы ингибиторы тирозинкиназ II поколения — нилотиниб (Тасигна) и дазатиниб (Спрайсел). Сегодня они назначаются, если есть риск того, что терапия иматинибом может перестать действовать. Часто такие препараты комбинируют с интерферонами и другими лекарствами, усиливающими эффект. И на сегодняшний день — это лучшее работающее лекарство, что есть у медицины для больных ХМЛ. Благодаря им, 80% пациентов живут не менее 10 лет, причем в трети случаев они умирают не от ХМЛ, а от других заболеваний.
В России пациенты в рамках программы «7 нозологий» бесплатно получают иматиниб (стоимость лечения за год составляется от 200 тысяч до 1 миллиона рублей). А вот тем из них, у кого организм развил устойчивость к иматинибу, приходится несладко. Ингибиторы тирозинкиназы II поколения в нашей стране не оплачиваются в рамках программы государственных гарантий. То есть лечение должно проводиться за счет бюджета региона, где проживает человек. А это означает бесконечное затягивание выделения денег и, как следствие, слишком позднее получение лекарства.
В начале статьи мы упоминали достижение российских исследователей из компании «Фьюжн Фарма», которая входит в кластер биомедтехнологий Фонда «Сколково». Ученые разработали селективный ингибитор тирозинкиназы III поколения. Предполагается, что созданная ими молекула под названием PF-114 должна будет еще более эффективно подавлять активность белка, который кодируется геном BCR-ABL. На данный момент исследователи приступили к 1-й фазе клинических испытаний. И то, что FDA присвоила препарату орфанный статус, говорит о значимости и важности этих испытаний не только для России, но и для мирового медицинского сообщества. Возможно, именно наши ученые сделают еще один шаг к полному излечению хронического миелолейкоза.
Хронический лейкоз
Хронический лейкоз – это первичное опухолевое заболевание системы кроветворения, субстратом которого выступают зрелые и созревающие клетки миелоидного или лимфоидного ряда. Различные формы хронического лейкоза протекают с преобладанием интоксикационного (слабость, артралгии, оссалгии, анорексия, похудание), тромбогеморрагического (кровоточивость, тромбозы различной локализации), лимфопролиферативного синдромов (увеличение лимфоузов, спленомегалия и др.). Решающее значение в диагностике хронического лейкоза принадлежит исследованию ОАК, биоптатов костного мозга и лимфоузлов. Лечение хронических лейкозов проводится методами химиотерапии, лучевой терапии, иммунотерапии, возможна трансплантация костного мозга.
МКБ-10


Общие сведения
Хронический лейкоз – хронические лимфопролиферативные и миелопролиферативные заболевания, характеризующиеся избыточным увеличением количества кроветворных клеток, сохраняющих способность к дифференцировке. В отличие от острых лейкозов, при которых происходит пролиферация низкодифференцированных гемопоэтических клеток, при хронических лейкозах опухолевый субстрат представлен созревающими или зрелыми клетками. Для всех типов хронических лейкозов характерна длительная стадия доброкачественной моноклоновой опухоли.
Хронические лейкозы поражают преимущественно взрослых в возрасте 40-50 лет; мужчины болеют чаще. На долю хронического лимфоидного лейкоза приходится около 30% случаев, хронического миелоидного лейкоза — 20% всех форм лейкемии. Хронический лимфолейкоз в гематологии диагностируется в 2 раза чаще, чем хронический миелолейкоз. Лейкозы у детей протекают в хроническом варианте крайне редко — в 1-2% случаев.
Причины
Истинные причины, приводящие к развитию хронического лейкоза, неизвестны. В настоящее время наибольшее признание получила вирусно-генетическая теория гемобластозов. Согласно данной гипотезе, некоторые виды вирусов (в числе которых – вирус Эбштейна-Барр, ретровирусы и др.) способны проникать в незрелые кроветворные клетки и вызывать их беспрепятственное деление.
Не подвергается сомнению и роль наследственности в происхождении лейкозов, поскольку доподлинно известно, что заболевание нередко носит семейный характер. Кроме этого, хронический миелолейкоз в 95% случаев ассоциирован с аномалией 22-й хромосомы (филадельфийской или Рh-хромосомы), фрагмент длинного плеча которой транслоцирован на 9-ю хромосому.
Факторы риска
Наиболее значимыми предрасполагающими факторами к различным видам и формам хронических лейкозов выступают воздействия на организм:
- высоких доз радиации;
- рентгеновского облучения;
- производственных химических вредностей (лаков, красок и др.);
- лекарственных препаратов (солей золота, антибиотиков, цитостатиков);
- длительный стаж курения.
Риск развития хронического лимфоцитарного лейкоза повышается при длительном контакте с гербицидами и пестицидами, а хронического миелоидного лейкоза – при радиационном облучении.
Патогенез
В патогенезе хронического лимфолейкоза значимая роль принадлежит иммунологическим механизмам – об этом свидетельствует его частое сочетание с аутоиммунной гемолитической анемией и тромбоцитопенией, коллагенозами. Вместе с тем, у большинства больных хроническими лейкозами причинно значимых факторов выявить не удается.
Классификация
В зависимости от происхождения и клеточного субстрата опухоли хронические лейкозы делятся на:
- Лимфоцитарные: хронический лимфолейкоз, болезнь Сезари (лимфоматоз кожи), волосатоклеточный лейкоз, парапротеинемические гемобластозы (миеломная болезнь, макроглобулинемия Вальденстрема, болезни легких цепей, болезни тяжелых цепей).
- Миелоцитарные (гранулоцитарные): хронический миелолейкоз, эритремия, истинная полицитемия, хронический эритромиелоз и др.
- Моноцитарные: хронический моноцитарный лейкоз и гистиоцитозы.
В своем развитии опухолевый процесс при хроническом лейкозе проходит две стадии: моноклоновую (доброкачественную) и поликлоновую (злокачественную). Течение хронического лейкоза условно подразделяется на 3 стадии: начальную, развернутую и терминальную.

Симптомы хронического лейкоза
Хронический миелоидный лейкоз
В начальном периоде хронического миелолейкоза клинические проявления отсутствуют или неспецифичны, гематологические изменения выявляются случайно при исследовании крови. В доклиническом периоде возможно нарастание слабости, адинамии, потливости, субфебрилитета, болей в левом подреберье.
Переход хронического миелоидного лейкоза в развернутую стадию знаменуется прогрессирующей гиперплазией селезенки и печени, анорексией, похуданием, выраженными болями в костях и артралгиями. Характерно образование лейкемических инфильтратов на коже, слизистых полости рта (лейкемический периодонтит), ЖКТ. Геморрагический синдром проявляется гематурией, меноррагией, метроррагией, кровотечениями после экстракции зубов, кровавыми поносами. В случае присоединения вторичной инфекции (пневмонии, туберкулеза, сепсиса и др.) температурная кривая приобретает гектический характер.
Терминальная стадия хронического миелоидного лейкоза протекает с резким обострением всех симптомов и выраженной интоксикацией. В этот период может развиваться плохо поддающееся терапии и угрожающее жизни состояние – бластный криз, когда из-за резкого увеличения количества бластных клеток течение заболевания становится похожим на острый лейкоз. Для бластного криза характерна агрессивная симптоматика: лейкемиды кожи, тяжелые кровотечения, вторичные инфекции, высокая температура, возможен разрыв селезенки.
Хронический лимфолейкоз
Долгое время единственным признаком хронического лимфолейкоза может быть лимфоцитоз до 40-50%, незначительное увеличение одной-двух групп лимфоузлов. В развернутый период лимфаденит принимает генерализованную форму: увеличиваются не только периферические, но и медиастинальные, мезентериальные, забрюшинные узлы. Возникает сплено- и гепатомегалия; возможно сдавление холедоха увеличенными лимфатическими узлами с развитием желтухи, а также верхней полой вены с развитием отеков шеи, лица, рук (синдром ВПВ). Беспокоят упорные оссалгии, кожный зуд, рецидивирующие инфекции.
Тяжесть общего состояния больных хроническим лимфоидным лейкозом обусловлена прогрессированием интоксикации (слабость, потливость, лихорадка, анорексия) и анемического синдрома (головокружение, одышка, сердцебиение, обморочные состояния).
Терминальная стадия хронического лимфоидного лейкоза характеризуется присоединением геморрагического и иммунодефицитного синдромов. В этот период развивается тяжелая интоксикация, возникают кровоизлияния под кожу и слизистые, носовые, десневые, маточные кровотечения.
Осложнения
Иммунодефицит, обусловленный неспособностью функционально незрелых лейкоцитов выполнять свои защитные функции, проявляется синдромом инфекционных осложнений. У больных хроническим лимфолейкозом часты легочные инфекции (бронхиты, бактериальные пневмонии, туберкулезные плевриты), грибковые поражения кожи и слизистых, абсцессы и флегмоны мягких тканей, пиелонефриты, герпетическая инфекция, сепсис.
Нарастают дистрофические изменения внутренних органов, кахексия, почечная недостаточность. Летальный исход при хроническом лимфоидном лейкозе наступает от тяжелых инфекционно-септических осложнений, кровотечений, анемии, истощения. Возможна трансформация хронического лимфолейкоза в острый лейкоз или лимфосаркому (неходжкинскую лимфому).
Диагностика
Предполагаемый диагноз устанавливается на основании анализа гемограммы, с результатами которой пациент должен быть немедленно направлен к врачу-гематологу. Для подтверждения диагноза проводится:
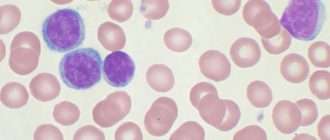
- Общий анализ крови. Типичные для хронического миелоидного лейкоза изменения включают: анемию, присутствие единичных миелобластов и гранулоцитов на разной стадии дифференцировки; в период бластного криза количество бластных клеток увеличивается более чем на 20%. При хроническом лимфолейкозе определяющими гематологическими признаками выступают выраженный лейкоцитоз и лимфоцитоз, наличие лимфобластов и клеток Боткина-Гумпрехта.
- Пункции и биопсии. С целью определения морфологии опухолевого субстрата показано выполнение стернальной пункции, трепанобиопсии, биопсии лимфоузлов. В пунктате костного мозга при хроническом миелолейкозе увеличено количество миелокариоцитов за счет незрелых клеток гранулоцитарного ряда; в трепанобиоптате определяется замещение жировой ткани миелоидной. При хроническом лимфоидном лейкозе миелограмма характеризуется резким усилением лимфоцитарной метаплазии.
- Инструментальные исследования. Для оценки выраженности лимфопролиферативного синдрома применяются УЗИ лимфатических узлов, селезенки, рентгенография грудной клетки, лимфосцинтиграфия, МСКТ брюшной полости и ряд других.
Лечение хронического лейкоза
На ранней доклинической стадии лечение неэффективно, поэтому больные подлежат динамическому наблюдению. Общережимные мероприятия предполагают исключение физических перегрузок, стрессов, инсоляции, электропроцедур и теплолечения; полноценное витаминизированное питание, длительные прогулки на свежем воздухе.
В развернутом периоде миелолейкоза назначается химиотерапевтическое лечение (бусульфан, митобронитол, гидроксимочевина и др.), при выраженной спленомегалии проводится облучение селезенки. Подобная тактика, хоть и не приводит к полному излечению, но существенно тормозит прогрессирование болезни и позволяет отсрочить наступление бластного криза. Кроме медикаментозной терапии, при хроническом миелоцитарном лейкозе используются процедуры лейкафереза. В ряде случаев излечение достигается с помощью трансплантации костного мозга.
При переходе хронического миелолейкоза в терминальную стадию назначается высокодозная полихимиотерапия. В среднем после установления диагноза больные хроническим миелолейкозом живут 3-5 лет, в отдельных случаях – 10-15 лет. Также проводится цитостатическая терапия (хлорбутин, циклофосфамид), иногда в сочетании со стероидной терапией, облучением лимфоузлов, селезенки, кожи. При значительном увеличении селезенки выполняется спленэктомия. Применяется трансплантация стволовых клеток, однако ее эффективность еще требует подтверждения.

Прогноз
Продолжительность жизни больных хроническим лимфоидным лейкозом может составлять от 2-3 лет (при тяжелых, неуклонно прогрессирующих формах) до 20-25 лет (при относительно благоприятном течении).
Хронический лейкоз

Хроническим лейкозом называют злокачественное заболевание, при котором клетки крови под влиянием злокачественной мутации перестают выполнять свою функцию, из-за чего ухудшается общее состояние пациента, развиваются различные осложнения. Патология поражает клетки как миелоидного, так и лимфоидного ряда, причём развивается медленно, начальная стадия продолжается в течение нескольких лет. На финальной стадии злокачественные клетки дают многочисленные метастазы во внутренние органы, усугубляя недомогание. Наиболее часто болезнь выявляют у людей зрелого и пожилого возраста, причём мужчины страдают чаще, чем женщины. Дети составляют всего 1-2% от общего числа заболевших.
Виды заболевания
Наиболее распространён принцип классификации хронических лейкозов по клеточному субстрату опухолей, где они делятся на:
- миелоцитарные, развивающиеся на клетках миелоидного ряда;
- лимфоцитарные, развивающиеся на клетках лимфоидного ряда;
- моноцитарные, развивающиеся на моноцитах — наиболее крупной разновидности лейкоцитов.
Патологии моноцитарного типа встречаются относительно редко — примерно в 5% случаев.
Симптомы
На начальной стадии болезни признаки хронического лейкоза практически отсутствуют. В дальнейшем пациент может отмечать общее ухудшение самочувствия, необъяснимый упадок сил и быструю утомляемость, у него уменьшается масса тела, а по ночам обильно выделяется пот. Специфические проявления патологии зависят от вида опухоли.
Симптомы хронического лейкоза лимфоцитарного типа — это:
- увеличение лимфатических узлов;
- отёки;
- одышка, кашель;
- небольшое увеличение селезёнки и печени;
- появление лейкемических инфильтратов в тканях внутренних органов, что приводит к развитию воспалений, изъязвлению и некротизации тканей;
- инфильтраты, шелушение, покраснение кожи;
- частые инфекции, которые легко переходят в хроническую форму.
При миелоцитарном хроническом лейкозе симптомы у взрослых пациентов более выражены уже на первых этапах заболевания:
- быстрая утомляемость и слабость, усиливающаяся с течением времени;
- обильное потоотделение при незначительных усилиях;
- боли в левом подреберье;
- боли в пояснице, напоминающие радикулит;
- повышенная температура тела;
- образование инфильтратов во внутренних органах.
В этих случаях увеличения печени и селезёнки не происходит.
Причины и факторы риска
Онкогематологам до сих пор неизвестно, по какой причине хронический лейкоз развивается у пациентов, однако замечено, что определённые факторы существенно увеличивают риск возникновения болезни. В первую очередь, это:
- наследственная предрасположенность;
- некоторые вирусные инфекции — папилломавирус, ретровирус, болезнь Эпштейна-Барра и др.;
- генетические отклонения — наличие «филадельфийской хромосомы», фрагмента длинного плеча;
- радиоактивное излучение — в том числе лучевая терапия по поводу другого онкозаболевания;
- длительный контакт с определёнными группами веществ, содержащимися в лакокрасочной продукции, топливе и смазочных материалах;
- приём некоторых лекарственных препаратов;
- курение табака.
Стадии
Онкологи различают две основные стадии хронического лейкоза:
- моноклоновую, или доброкачественную форму, при которой признаки болезни практически отсутствуют;
- поликлоновую, при которой течение заболевания приобретает злокачественный характер.
По характеру течения и степени поражения организма выделяют:
- начальную стадию, когда злокачественный процесс развивается в клетках костного мозга, практически не выходя за его границы;
- развёрнутую, когда поражённые лейкоциты проникают в кровь и вызывают появление характерных симптомов;
- терминальную, которую часто называют бластным кризом, при которой число бластных клеток в крови лавинообразно увеличивается, они проникают с током крови во все органы, приводя к множественным поражениям и патологическим изменениям тканей.
Диагностика
Чтобы диагностировать хроническую лейкемию, необходимы лабораторные анализы крови и костного мозга. Для уточнения степени поражения организма пациенту назначают инструментальные исследования внутренних органов.
- Анализ крови общий — для выявления уровня лейкоцитов.
- Анализ крови биохимический — для выяснения точного состава крови.
- Стернальная пункция костного мозга — для уточнения состояния клеточного ряда.
- Трепанобиопсия и биопсия лимфоузлов — для определения стадии болезни.
- УЗИ — чтобы установить степень поражения лимфоузлов и органов.
- Рентген грудной клетки — для изучения состояния внутренних органов.
- МСКТ брюшной полости — чтобы уточнить стадию болезни и степень поражения органов.
Лечение
В зависимости от типа заболевания онкогематологи индивидуально формируют схему лечения хронического лейкоза с учётом возраста и состояния пациента, наличия хронических болезней и других факторов. Для этого обычно используют следующие методы.
- Химиотерапия является основной лечебной методикой. Применение специальных препаратов позволяет избавиться от 99% злокачественных клеток, что существенно облегчает состояние пациента. В дальнейшем курсы химиопрепаратов необходимы для избавления от оставшихся бластных клеток и поддержания ремиссии. Общая продолжительность составляет не менее двух-трёх лет.
- Лучевая терапия. Этот метод используется как вспомогательный для уничтожения остатков злокачественных клеток.
- Трансплантация костного мозга. К этому методу прибегают в случаях, когда не удаётся добиться стойкой ремиссии при помощи препаратов. Лучшими донорами, как правило, становятся братья и сёстры пациента, но возможна и пересадка от неродственного донора.
- Лейкаферез. Извлечение из крови пациента повреждённых лейкоцитов выполняется при их чрезмерном количестве, вызывающем загущение крови и создающем угрозу для нормального кровообращения.
На всех этапах лечения для защиты от инфекций осуществляется антибиотикотерапия, а для улучшения общих показателей — переливание донорской крови и её препаратов, в качестве которых обычно выступает эритроцитная масса.
Прогнозы
После постановки диагноза при отсутствии лечения больной в среднем живёт 2-3 года. Современные методы позволяют довести выживаемость пациентов с хроническим лейкозом до 80-85%. Наиболее высоки шансы на выздоровление у детей. Среди пациентов старше 65 лет доля излеченных составляет 15-20%, однако это средние показатели. В крупных медицинских центрах с современным оборудованием цифры существенно более высоки.
Профилактика
В настоящее время не существует профилактических мер, позволяющих со стопроцентной гарантией избежать онкозаболевания крови. Поскольку вероятность успешного излечения на терминальной стадии болезни невысока, пациентам, для которых действуют факторы риска, необходимо регулярно проходить обследование, направленное на раннюю диагностику хронического лейкоза.
Реабилитация
Восстановление больных хроническим лейкозом после лечения — это сложный, длительный и тяжёлый процесс, который включает следующие направления:
- медицинское — нормализация функций органов и систем;
- физическое — укрепление мышц, адаптация к нагрузкам, восстановление иммунитета;
- социально-психологическое — устранение последствий стрессов и депрессий, решение личностных и семейных проблем.
Кроме того, больной должен скрупулёзно выполнять все клинические рекомендации при хроническом лейкозе, так как небрежность и неаккуратность могут привести к ухудшению состояния и даже к летальному исходу.
Диагностика и лечение хронического лейкоза в Москве
Клиника Института ядерной медицины проводит диагностические исследования для выявления хронического лейкоза, а также предлагает последующее лечение этого заболевания. К услугам пациентов — современная медицинская техника, позволяющая использовать передовые лечебные технологии, и высокая квалификация онкогематологов. На счету у каждого из наших врачей — сотни выздоровевших пациентов, возвращённых к нормальной счастливой жизни. Не отказывайтесь от своего шанса на здоровье, обращайтесь в клинику.
Вопросы и ответы
Сколько времени длится лечение хронического лейкоза?
Длительность курса лечения зависит от множества факторов — от стадии болезни, возраста пациента, его индивидуальных особенностей и скорости восстановления организма. В среднем, лечение занимает 2-3 года, из которых не менее полугода приходится провести в стационаре. Затем в течение 5 лет необходимо регулярно посещать онколога и проходить обследования, чтобы исключить рецидив.
Как нужно питаться при хроническом лейкозе?
Специальный режим питания — одно из обязательных условий выздоровления. Рацион должен включать повышенное количество легкоусвояемых белков, овощей и фруктов. Долю углеводов рекомендуется существенно уменьшить, а от жиров отказаться практически полностью.
Есть ли шансы у больного в терминальной стадии хронического лейкоза?
Возможность излечения существует у каждого пациента, невзирая на его возраст и тяжесть болезни. Для выздоровления крайне важен позитивный психологический настрой, вера в свои силы, поддержка семьи и друзей, желание продолжать жизнь.
Источник https://medaboutme.ru/articles/khronicheskiy_mieloleykoz_200_let_borby_so_sluchaynoy_mutatsiey/
Источник https://www.krasotaimedicina.ru/diseases/hematologic/chronic-leukemia
Источник https://inuclear.ru/zabolevanija/khronicheskiy-leykoz/