Хронический лимфолейкоз
Хронический лимфолейкоз — злокачественное лимфопролиферативное заболевание, при котором опухолевыми клетками являются патологические В-лимфоциты, способные накапливаться в костном мозге, периферической крови и лимфатических узлах. В норме В-лимфоциты в течение своей жизни превращаются в иммуноглобулинсекретирующую клетку, которая обеспечивает приобретённый иммунитет. Опухолевые В-лимфоциты такой функции лишены, и, таким образом, иммунитет больного страдает, и повышается риск присоединения инфекционных заболеваний. Помимо этого, по мере прогрессирования заболевания нарушается выработка эритроцитов, нейтрофилов и тромбоцитов, возможно развитие аутоиммунных процессов. Наконец, хронический лимфолейкоз может трансформироваться в В-клеточный пролимфоцитарный лейкоз, в высокодифференцированную неходжкинскую лимфому, в частности — в диффузную В-крупноклеточную лимфому.
Причины развития лимфолейкоза
Хронический лейкоз является самым распространённым видом лейкоза, составляя до 30% в общей структуре заболеваемости. Частота встречаемости составляет 4 случая на 100 тысяч населения; у лиц старше 80 лет частота составляет более 30 случаев на 100 тысяч населения.
Факторами риска развития хронического лимфолейкоза являются:
- Пожилой возраст. До 70% всех выявленных случаев приходится на людей старше 60 лет,
- Мужской пол. Мужчины заболевают в два раза чаще женщин,
- Воздействие ионизирующего излучения,
- Контакт с бензолом и бензином.
Симптомы
Для хронического лимфолейкоза характерно длительное бессимптомное течение; основной причиной обращения к врачу являются изменения в общем анализе крови, сданном в рамках профилактического осмотра или по поводу иного заболевания. Активных жалоб на момент первичного осмотра пациент может и не предъявлять, но при этом зачастую даже в этой ситуации уже выявляется увеличение лимфатических узлов и изменение их консистенции до тестоватой. Сами лимфоузлы не уплотнены, сохраняют подвижность относительно окружающих тканей. В случае присоединения инфекции лимфатические узлы значительно увеличиваются; по мере прогрессирования хронического лимфолейкоза лимфоузлы — в первую очередь брюшной полости — способны
образовывать конгломераты.
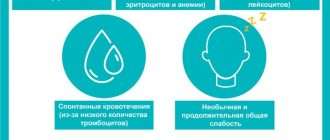
Первые возникающие жалобы обычно не носят специфического характера: повышенная утомляемость, слабость, выраженная потливость. По мере развития заболевания могут возникнуть аутоиммунные проявления, в первую очень гемолитические анемии (в 10-25% случаев) и тромбоцитопении (в 2-3% случаев). Гемолитическая анемия развивается в связи с разрушением самим организмом эритроцитов; чаще всего развивается, как и сам хронический лимфолейкоз, постепенно, но может проявиться и острым кризом — с повышением температуры, появлением желтухи, потемнения мочи. Тромбоцитопения может быть гораздо более опасным состоянием в связи с развитием кровотечений, в том числе и жизнеугрожающих (например, кровоизлияния в головной мозг).
Кроме того, так как В-лимфоциты относятся к клеткам, обеспечивающим иммунитет, типичным является присоединение инфекционных осложнений, в том числе оппортунистических, то есть вызванных микроорганизмами, постоянно находящимися в человеческом организме и не проявляющими себя при адекватном иммунном ответе. Чаще всего оппортунистическими инфекциями поражаются лёгкие.
Диагностика хронического лимфолейкоза
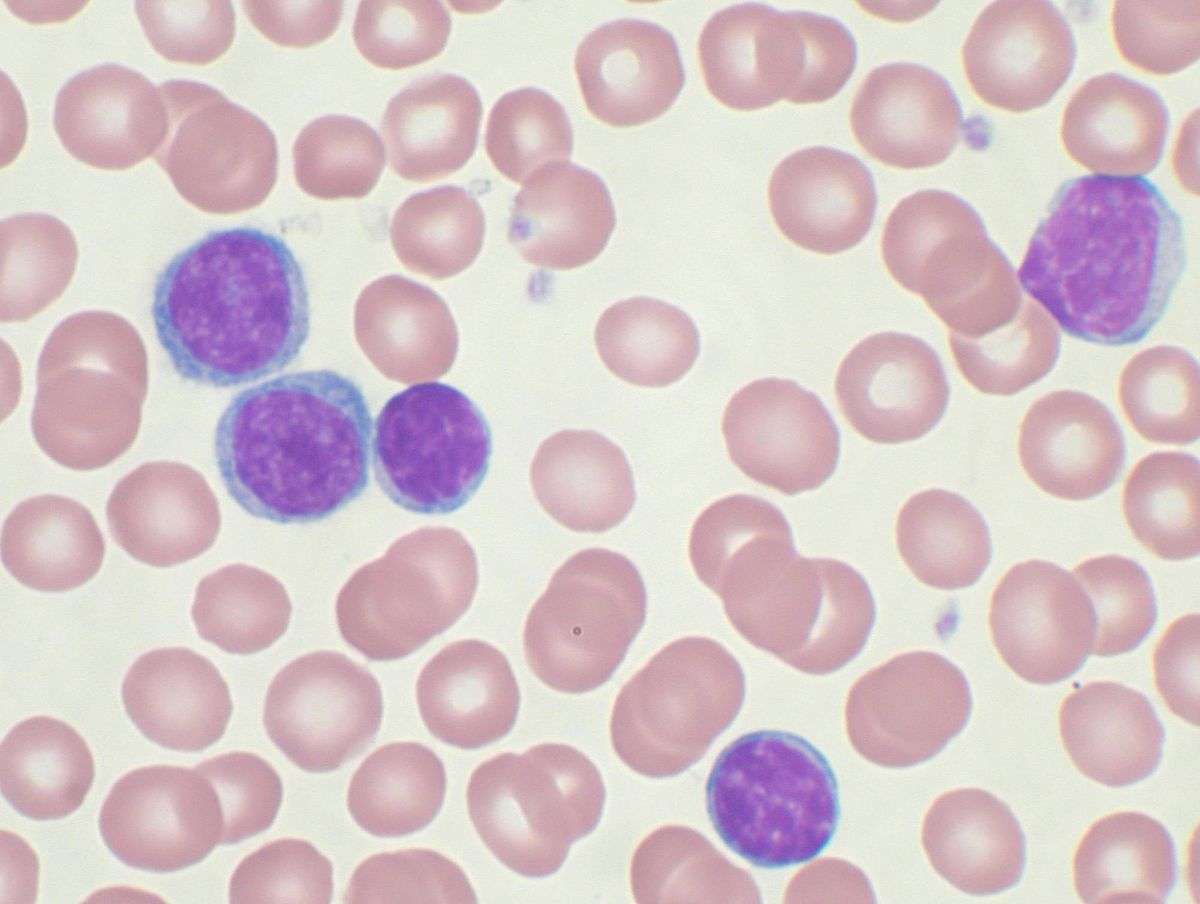
Диагноз хронического лимфолейкоза может быть заподозрен при оценке результатов обычного клинического анализа крови — обращает на себя внимание увеличение абсолютного количества лимфоцитов и лейкоцитов. Основным диагностическим критерием является абсолютное количество лимфоцитов, превышающее 5×10 9 л и прогрессивно увеличивающееся по мере развития лимфолейкоза, достигая цифр 100-500×10 9 л. Важно обращать внимание не только на абсолютное число, — если в начале заболевания лимфоциты составляют до 60-70% от всего количества лейкоцитов, то при его дальнейшем развитии они могут составлять 95-99%. Другие показатели крови, такие, как гемоглобин и тромбоциты, могут быть в норме, но при прогрессировании заболевания может быть выявлено их снижение. Абсолютным критерием для установки диагноза «хронический лимфолейкоз» является выявление более 5000 клональных В-лимфоцитов в 1 мкл периферической крови.
В биохимическом анализе крови может быть выявлено снижение общего белка и количества иммуноглобулинов, но это характерно для более поздних стадий заболевания. Обязательным этапом в диагностическом поиске является трепанбиопсия костного мозга. При гистологическом исследовании полученного пунктата на ранних этапах заболевания так же, как и в общем анализе крови, обнаруживается небольшое содержание лимфоцитов (40–50%), но при высоком лейкоцитозе лимфоциты могут составлять 95–98% костномозговых элементов.
Так как изменения в костном мозге являются неспецифическими, окончательный диагноз хронического лимфолейкоза устанавливается на основании данных иммуногистохимического исследования. Характерный иммунофенотип хронического лимфолейкоза включает экспрессию антигенов CD19, CD5, CD20, CD23, также отмечается слабая экспрессия на поверхности клеток иммуноглобулинов IgM (нередко одновременно с IgD) и антигенов CD20 и CD22. Главным цитогенетическим маркером, непосредственно влияющим на выбор терапии, является делеция 17p. Желательно выполнять анализ, направленный на выявлении этой делеции, до начала лечения, так как её выявление приводит к изменению тактики ведения пациента. Помимо биопсии костного мозга, в случае значительного увеличения отдельных лимфатических узлов показана пункция и их с целью исключения лимфомы.
Из инструментальных методов диагностики проводятся рентгенография органов грудной клетки и УЗИ наиболее часто поражаемых групп лимфоузлов и органов брюшной полости – в первую очередь печени и селезёнки, так как именно эти органы чаще всего поражаются при хроническом лимфолейкозе.

Стадии заболевания
В настоящее время стадирование осуществляется согласно классификации, предложенной Binet:
- A — содержание гемоглобина более 100 гл, тромбоцитов — более 100×10 9 л, поражено менее трёх лимфатических областей (к ним относятся: шейные лимфоузлы, подмышечные лимфоузлы, паховые лимфоузлы, печень, селезёнка),
- B — содержание гемоглобина более 100 гл, тромбоцитов — более 100×10 9 л, поражено более трёх лимфатических областей,
- C — содержание гемоглобина менее 100 г или тромбоцитов — менее 100×10 9 л.
Помимо классификации по Binet, используется классификация по Rai, используемая преимущественно в США. Согласно ей, выделяют четыре стадии заболевания:
- 0 — клинические проявления включают в себя только повышение лимфоцитов более 15×10 9 в периферической крови и более 40% в костном мозге,
- I — повышено количество лимфоцитов, диагностируется увеличение лимфоузлов,
- II — повышено количество лимфоцитов, диагностируется увеличение печени иили селезёнки вне зависимости от увеличения лимфоузлов,
- III — наблюдается повышение количества лимфоцитов и снижение уровня гемоглобина менее 110 гл вне зависимости от увеличения селезёнки, печени и лимфоузлов,
- IV — наблюдается повышение количества лимфоцитов и снижение числа тромбоцитов менее 100×10 9 вне зависимости от уровня гемоглобина, увеличения органов и лимфоузлов.
0 стадия характеризуется благоприятным прогнозом, I и II — промежуточным, III и IV — неблагоприятным.
Лечение
В настоящее время хронический лимфолейкоз хорошо поддаётся лечению благодаря широкому спектру химиотерапевтических препаратов. Важно отметить, что современные руководства не рекомендуют начинать агрессивное лечение сразу же после установки диагноза — в случаях, когда клинические проявления минимальны, возможно активное динамическое наблюдение до момента возникновения показаний к проведению специфического лечения, к коим относятся:
- Возникновение или нарастание интоксикации, которая проявляется потерей массы тела более чем на 10% за полгода, ухудшением общего состояния; появление лихорадки, субфебрильной температуры, ночных потов.
- Нарастание явлений анемии и/или тромбоцитопении;
- Аутоиммунная анемия и/или тромбоцитопения — в случае, если состояние не корректируется преднизолоном;
- Значительные размеры селезёнки — нижний край на расстоянии >6 см и более ниже рёберной дуги;
- Размер поражённых лимфатических узлов более 10 см или его прогрессивное увеличение;
- Увеличение количества лимфоцитов более, чем на 50% за 2 месяца, или вдвое за 6 месяцев.
Основным методом лечения хронического лимфолейкоза на данный момент является химиотерапия. Один из первых химиотерапевтических агентов, показавших свою эффективность в лечении хронического лимфолейкоза, хлорамбуцил, используется и в настоящее время, хоть и ограниченно. С течением времени вместо хлорамбуцила стали использовать циклофосфамид, в комбинации с другими препаратами, и соответствующие схемы (например, CHOP, COP, CAP) на данный момент применяются у пациентов молодого возраста с хорошим соматическим статусом.
Впервые введённый в клиническую практику в 80-х годах прошлого века флударабин показал эффективность в отношении достижения стойкой ремиссии, превышающую эффективность хлорамбуцила, особенно в сочетании с циклофосфамидом. Важно отметить, что эта схема эффективна даже в случае развития рецидива заболевания. Последним словом в лечении хронического лейкоза в настоящее время является применение иммунотерапевтических средств — препаратов из группы моноклональных тел. В рутинную клиническую практику прочно вошел ритуксимаб. Данный препарат взаимодействует с антигеном CD20, который ограниченно экспрессируется при хроническом лимфолейкозе, поэтому для эффективного лечения требуется сочетание ритуксимаба с какой-либо из принятых схем химиотерапии, чаще всего с флударабином или COP. Ритуксимаб в монорежиме может применяться как поддерживающая терапия при частичном ответе на лечение.
Перспективным выглядит применение препарата алемтузумаб, который взаимодействует с антигеном CD52. Его также используют как в монорежиме, так и в комбинации с флударабином.
Отдельно хотелось бы упомянуть хронический лимфолейкоз с делецией 17p. Этот подтип лимфолейкоза часто бывает резистентен к стандартным схемам химиотерапии.
Определённые успехи в лечении этого подвида лимфолейкоза достигнуты благодаря применению упомянутого выше алемтузумаба. Кроме того, перспективным средством в этой ситуации является ибрутиниб. В настоящее время этот препарат применяется в монорежиме, сочетание его с различными схемами химиотерапии исследуется; определённое преимущество показала схема, включающая ибрутиниб, ещё одно моноклональное тело — ритуксимаб, и бендамустин.

Лучевая терапия, которая столетие назад была практически единственной возможностью лечения таких больных, и по сей день не утратила актуальности: рекомендуется её проведение в рамках комплексного подхода на область поражённых лимфоузлов, если наблюдается их продолженный рост на фоне стабилизации остальных проявлений заболевания. В этом случае необходимая суммарная доза составляет 20-30 Гр. Также лучевой метод может быть применён при рецидивах заболевания.
В лечении хронического лимфолейкоза нашёл своё место и хирургический метод, заключающийся в удалении поражённой селезёнки. Показаниями к данному вмешательству являются:
- Увеличение селезёнки в сочетании с тяжелой анемией и/или тромбоцитопенией, особенно если наблюдается химиорезистентность,
- Массивное увеличение селезёнки при условии отсутствия ответа на химиотерапию,
- Тяжёлая аутоиммунная анемия и/или тромбоцитопения при резистентности к медикаментозному лечению.
При развитии резистентности к применяемым ранее химиотерапевтическим агентам или же при быстром прогрессировании после проведённого лечения может быть проведена трансплантация костного мозга. Трансплантация костного мозга показана в первой ремиссии пациентам из группы высокого риска, молодым пациентам в отсутствие эффекта от проводимого лечения, пациентам с делецией 17p/мутацией TP53 при наличии прогрессии заболевания. Важно отметить, что после проведённой трансплантации рекомендуется применение ритуксимаба и леналидомида в качестве поддерживающей терапии с целью предотвращения рецидива.
Наконец, пациентам требуется проведение и поддерживающей терапии, которая включает:
- Переливание эритроцитарной массы при анемии;
- Переливание тромбоцитарной массы при кровотечении, вызванном тромбоцитопенией;
- Противомикробные средства при присоединении бактериальной, грибковой или вирусной инфекции, а также для её профилактики;
- Применение преднизолона в дозе 1-2 мг/кг при развитии аутоиммунных процессов.
В случае развития рецидива заболевания тактика лечения зависит от ряда факторов, таких как: проведённая ранее терапия, срок наступления рецидива, клиническая картина. В случае раннего (то есть возникшего в периоде 24 месяцев и ранее) рецидива основным препаратом является ибрутиниб. Он применяется как самостоятельно, так и в составе упомянутой выше схемы лечения (ибрутиниб+ритуксимаб+бендамустин).
Альтернативным препаратом выбора может быть алемтузумаб. Демонстрируя сопоставимую с ибрутинибом эффективность, он, однако, демонстрирует значительно большую токсичность.
Наконец, у ряда пациентов по поводу раннего рецидива хронического лимфолейкоза может быть выполнена трансплантация костного мозга.
В случае позднего (возникшего в срок более 24 месяцев с момента завершения лечения) рецидива основным критерием выбора является проведённая ранняя терапия.
- Если проводимая ранее терапия на основе флударабина не сопровождалась значительной токсичностью, то можно вернуться к этой схеме, а также дополнить её ритуксимабом.
- В случае выявления цитопении возможно применение ритуксимаба в сочетании с высокими дозами глюкокортикостероидов.
- При проведённом ранее лечении хлорамбуцилом показано применение схем с флударабином или сочетанием бендамустина и ритуксимаба.
- Монотерапия ибрутинибом или его сочетание с одной из схем полихимиотерапии также может быть эффективна при рецидиве хронического лимфолейкоза.
Оценка эффективности лечения
Диагностические исследования, направленные на оценку эффекта от проведённого лечения, проводятся не ранее, чем через 2 месяца после окончания последнего курса химиотерапии. Результат может быть оценён следующим образом:
- Полная ремиссия: уменьшение до нормальных размеров печени, селезёнки, лимфоузлов (допустимо их увеличение в размере не более чем 1,5 см), снижение числа лимфоцитов менее 4×10 9 л в периферической крови и менее 30% в костном мозге, повышение числа тромбоцитов более 100×10 9 л, гемоглобина — более 110 гл, нейтрофилов — более 1,54×10 9 л.
- Частичная ремиссия: уменьшение размеров лимфоузлов, печени и селезёнки на 50% и более, снижение количества лимфоцитов в периферической крови на 50%, повышение числа тромбоцитов более 100×10 9 л, гемоглобина — более 110 гл, нейтрофилов — более 1,54×10 9 л или же повышение любого из этих параметров более чем на 50% от исходного уровня.
- Признаками прогрессирования заболевания являются, напротив, увеличение размеров лимфоузлов, печени и селезёнки на 50% и более, а также уменьшение количества тромбоцитов на 50% и более от исходного уровня и уменьшение количества тромбоцитов на 20 гл и более.
Для установления полной ремиссии необходимо соблюдение всех перечисленных критериев, частичной — по крайней мере 2 критерия, касающихся состояния внутренних органов, и минимум одного критерия, касающегося клеточного состава крови.
Следует учитывать, что терапия ибрутинибом может привести к полному ответу со стороны лимфатических узлов и селезёнки, но с сохранением лейкоцитоза в периферической крови. Это состояние обозначается, как частичный ответ с лимфоцитозом.
Прогноз
Значительные успехи в терапии хронического лимфолейкоза позволили сделать это заболевание потенциально излечимым или же достаточно долго поддерживать жизнь человека без прогрессирования основного заболевания с сохранением её качества.
Напротив, без лечения заболевание медленно, но неуклонно прогрессирует, что способно стать причиной гибели пациента спустя несколько лет после дебюта заболевания, поэтому своевременное обращение к врачу и начало адекватной терапии очень важны.
Хронический лимфоцитарный лейкоз

Хронический лимфоцитарный лейкоз – это постоянная выработка костным мозгом и накопление в тканях измененных лимфоцитов – клеток иммунной системы, которые не способны бороться с инфекциями и защищать организм от различных заболеваний.
Как развивается лимфолейкоз?
С самого рождения в теле человека, в том числе в костном мозге, образуются не только обычные клетки, но и отличающиеся от них мутировавшие – измененные. Они становятся такими из-за воздействия различных химических веществ, наследственных особенностей или случайных сбоев. Наш иммунитет выявляет и уничтожает большинство из них, но некоторым все же удается выжить. Они становятся лейкемическими и приобретают опасные свойства:
- перестают созревать и производить нормальные клетки крови;
- быстро размножаются;
- игнорируют апоптоз – механизм «запрограммированной» смерти, из-за чего существуют гораздо дольше, чем длится их правильный жизненный цикл.
Такие способности позволяют им накапливаться в костном мозге, вытеснять нормальные клетки, попадать в кровеносную систему, с ее помощью распространяться в различные области организма и препятствовать нормальной работе тканей.
При хроническом лейкозе такие клетки созревают не полностью – они становятся похожими на нормальные лейкоциты, необходимые нашему телу для борьбы с инфекциями, но не могут выполнять их функции.
Что такое костный мозг, кровь и лимфоидная ткань?
Различные типы лейкемии начинаются в определенных типах клеток крови. Для того, чтобы понять принцип развития заболевания и его влияния на организм, нужно разобраться с работой основных тканей тела.
Костный мозг
Эта мягкая внутренняя часть некоторых костей – черепа, лопаток, ребер, таза и позвоночника состоит из:
- Жировых клеток.
- Небольшого количества стволовых клеток, из которых образуются различные клетки крови.
- Зрелых кроветворных клеток.
- Поддерживающих тканей, которые помогают клеткам расти.
Внутри костного мозга стволовые клетки делятся, созревают и образуют новые клетки крови, которые становятся лейкоцитами, эритроцитами, лимфоцитами или тромбоцитами.

Типы клеток крови
Красные кровяные тельца, или эритроциты, переносят кислород из легких в другие ткани и возвращают углекислый газ обратно в дыхательные пути. Их нехватка – анемия, может вызвать слабость, усталость и одышку – нехватку воздуха.
Тромбоциты необходимы для закупорки вызванных порезами или ушибами отверстий в кровеносных сосудах. Если в теле человека их слишком мало, у него развиваются кровотечения и появляются кровоподтеки.
Белые кровяные тельца, или лейкоциты, помогают организму бороться с инфекциями. При понижении их уровня работа иммунной системы нарушается, а вероятность заражения – увеличивается.
Типы лейкоцитов
Лимфоциты – это полностью зрелые противостоящие инфекциям клетки, которые развиваются из лимфобластов – особого типа стволовых клеток костного мозга. Именно из них в основном состоит лимфоидная ткань иммунной системы, находящаяся в лимфатических узлах Лимфатические узлы – это небольшие органы иммунной системы, задерживающие и обезвреживающие опасные для организма вещества. , вилочковой железе Вилочковая железа, или тимус – небольшой орган, расположенных за верхней частью грудины, перед сердцем. В нем происходит созревание и развитие некоторых лимфоцитов. , селезенке Селезенка производит лимфоциты, уничтожает микроорганизмы и другие вредные вещества, а также хранит нормальные клетки крови. , миндалинах Миндалины – расположенные в задней части глотки скопления лимфатической ткани, которые участвуют в выработке антител – белков, не позволяющих вдыхаемым и проглатываемым микроорганизмам размножаться. , а также дыхательной и пищеварительной системах.
- В-лимфоциты: защищают организм от микробов. Именно они чаще всего становятся лейкозными. Созревают и превращаются в плазматические клетки, вырабатывающие антитела – белки, которые прикрепляются к микробам – бактериям, вирусам и грибкам, благодаря чему их распознают и уничтожают гранулоциты.
- Т-лимфоциты: распознают зараженные вирусами клетки, разрушают их и регулируют активность иммунной системы.
Гранулоциты: борются с инфекциями. Развиваются из особых клеток костного мозга – миелобластов, содержат в себе ферменты – белки и другие вещества, способные уничтожать бактерии.
Моноциты. Развиваются из присутствующих в костном мозге монобластов. На протяжении примерно суток они циркулируют в кровотоке, после чего проникают в различные ткани и превращаются в макрофаги, способные переваривать некоторые виды микробов. Кроме того, они помогают лимфоцитам распознавать опасные микроорганизмы и вырабатывать антитела для борьбы с ними.
Все эти клетки содержатся в теле человека в определенном количестве. Нарушение правильного баланса и замещение их на измененные клетки приводит к тяжелым последствиям – сбоям в работе всех систем, включая дыхательную, иммунную, кровеносную и пищеварительную, и отказу важнейших органов.
Типы лимфоцитарного лейкоза
Самый распространенный вид хронического лимфолейкоза развивается в В-лимфоцитах.
Пролимфоцитарный лейкоз: формируется в пролимфоцитах – незрелых В- или Т-лимфоцитах, и быстро распространяется. Большинство его случаев поддается лечению, но у обладателей подобного диагноза нередко случаются рецидивы – возвращение заболевания.
Лейкоз из больших гранулярных лимфоцитов. Его клетки довольно крупные и имеют признаки Т-, либо других типов лимфоцитов. Почти все такие лейкозы медленно развиваются и лечатся препаратами, подавляющими иммунную систему. Некоторые их формы довольно агрессивны – они быстро распространяются и плохо реагируют на терапию.
Волосатоклеточный лейкоз: формируется в измененных В-лимфоцитах. Его клетки необычно выглядят под микроскопом – на их поверхности есть тонкие выступы, похожие на волоски. Данное заболевание обычно хорошо поддается лечению.

Причины развития хронического лимфолейкоза
Точная причина большинства всех его случаев не известна, но принцип образования неправильных лимфоцитов понятен.
Нормальные человеческие клетки растут и работают по «программе», заложенной в содержащихся в них хромосомах, образующих молекулу ДНК. Она несет в себе переданные от родителей гены, которые влияют не только на наш внешний вид:
- онкогены: способствуют росту и делению клеток;
- супрессоры опухолей: замедляют их деление и вызывают гибель по окончанию жизненного цикла.
Каждый раз, когда клетка готовится к делению на 2 новых, она делает новую копию ДНК. Этот процесс не идеален – в его ходе могут возникать ошибки, приводящие к «включению» онкогенов и «выключению» супрессоров опухолей.
Нормальные В-лимфоциты являются частью нашей иммунной системы. Они «запрограммированы» на рост и деление с антигеном – чужеродным веществом, которое обычно не встречается в организме человека. К ним относятся, например, микробы – вирусы, бактерии и грибки. Хронический лимфолейкоз начинается в результате бесконтрольного деления В-лимфоцитов после их взаимодействия с антигеном. Причина этого медицинскому сообществу не понятна, но известны факторы, увеличивающие вероятность подобного события.
- Возраст: примерно 9 из 10 обладателей данного диагноза старше 50 лет.
- Некоторые исследования показали, что часть случаев связана с длительным воздействием радиоактивного газа радона и некоторых пестицидов – химических препаратов, которые используются для борьбы с сорняками и вредителями.
- Пол: у мужчин заболевание встречается несколько чаще, чем у женщин.
- Семейный анамнез: более чем в 2 раза повышены риски людей, у близких кровных родственников которых – родителей, братьев, сестер или детей, уже выявлено заболевание.
- Раса, этническая принадлежность. У проживающих в различных регионах и странах азиатов хронический лимфоцитарный лейкоз возникает реже, чем у европеоидов. Такая статистика подтверждает мнение ученых о том, что основную роль в его развитии играет генетика, а не окружающая среда.
Симптомы и признаки хронического лимфолейкоза
У многих пациентов на момент постановки диагноза никаких проблем со здоровьем нет. Заболевание часто обнаруживают по данным анализов крови при обращении к врачу из-за различных не связанных с ним нарушений.
Симптомы лимфолейкоза часто сложно распознать и легко принять за признаки различных расстройств. К ним относят:
- Слабость.
- Постоянную усталость.
- Увеличение размеров лимфатических узлов, похожих на плотные шишки под кожей.
- Потерю веса без усилий со стороны пациента.
- Повышенную температуру.
- Ночную потливость.
- Боль или чувство переполнения в области живота, сытость даже после небольшого приема пищи из-за увеличения селезенки или печени.
Многие симптомы заболевания возникают из-за замещения лейкозными клетками нормальных кроветворных клеток костного мозга. В результате этого процесса в организме пациентов присутствует слишком мало эритроцитов, правильно работающих лимфоцитов и тромбоцитов:
- Анемия – нехватка переносящих кислород эритроцитов. Приводит к слабости, усталости и одышке – ощущению нехватки воздуха.
- Лейкопения – дефицит нормальных лейкоцитов увеличивает риск развития инфекций.
- Нейтропения: низкий уровень нейтрофилов – особого типа гранулоцитов, необходимых для борьбы с бактериями.
- Лимфоцитоз – избыток измененных лимфоцитов, не способных бороться с инфекциями.
- Тромбоцитопения – нехватка тромбоцитов, приводящая к появлению большого количества кровоподтеков, частым или сильным носовым кровотечениям и кровоточивости десен.
У людей с хроническим лимфолейкозом из-за неправильной работы иммунитета развиваются инфекции – обычные простуда или герпес, пневмония – воспаление легких, или другие тяжелые заболевания.
Кроме того, в некоторых случаях лейкозные клетки вырабатывают неправильные антитела – белки, атакующие нормальные клетки крови. Эта особенность также приводит к снижению количества нормальных тромбоцитов, эритроцитов и лейкоцитов.

Диагностика хронического лимфолейкоза
Обследование начинается с опроса о беспокоящих симптомах, дате их появления, возможных факторах риска, общем самочувствии и состоянии здоровья, а также о известных тяжелых заболеваниях у кровных родственников. Затем проводится осмотр лимфатических узлов, брюшной полости и других областей тела, которые могли пострадать от лейкоза. После чего назначается целый ряд процедур.
- Анализы крови. Необходимы для подсчета различных типов клеток крови и химических веществ, а также качества работы внутренних органов, таких как печень и почки. У пациентов с хроническим лимфолейкозом очень много лимфоцитов – их содержание в количестве более чем 10 тысяч на кубический миллиметр крови фактически подтверждает диагноз.
- Анализ костного мозга. Как правило, для выявления заболевания достаточно данных показателей крови. Данное исследование проводится перед началом лечения для оценки его распространения и в процессе терапии для определения ее эффективности. Как правило, образцы берутся из задней части бедренной кости в ходе:
- аспирации – вытягивания густого жидкого костного мозга иглой в шприц;
- и обычно проводимой после нее биопсии – удаления небольшого кусочка кости и костного мозга с помощью специального инструмента.
Любые из вышеперечисленных исследований и диагностику лимфолейкоза можно пройти в онкологическом центре «Лапино-2».
Мы проводим полное обследование и берем все необходимые анализы, результаты которых получаем из собственной лаборатории.
Наши специалисты не только выявляют заболевания, но и проводят любое их лечение – без очередей и потерь времени.
Пациентам, проходящим терапию в других медицинских учреждениях, мы предлагаем услугу второго мнения – консультацию врача любой специальности. Независимые эксперты «Лапино-2» помогут вам убедиться в правильности уже поставленного диагноза или найти в нем ошибки и неточности.Стадии хронического лимфолейкоза
Для большинства видов онкологических заболеваний стадирование – это оценка количества поврежденных новообразованиями тканей. С помощью этой информации врачи определяют примерные прогнозы человека, и исходя из них подбирают самое подходящее лечение.
Хронический лимфоцитарный лейкоз же опухолей обычно не образует, но нередко к моменту выявления успевает распространить измененные клетки в другие ткани и органы. Перспективы его обладателей зависят от результатов лабораторных анализов и визуализирующих исследований.Лимфолейкоз стадируется по 2 международным системам, но в Российской Федерации применяется только одна из них – Binet. Она классифицирует заболевание по:
- количеству пораженных групп лимфоидной ткани, к которой относятся лимфоузлы шеи, паха и подмышек, селезенка и печень;
- наличию или отсутствию анемии – нехватки переносящих кислород эритроцитов, или
- тромбоцитопении – необходимых для правильной свертываемости крови тромбоцитов.
Стадия А: увеличено менее чем 3 участков лимфоидной ткани без анемии и тромбоцитопении.
Стадия В: укрупнено более чем 3 области лимфоидной ткани.
Стадия С: увеличено любое количество областей лимфоидной ткани, присутствуют анемия и/или тромбоцитопения.Лечение хронического лимфолейкоза
Многие пациенты с данным диагнозом живут очень долго, а доказательств пользы раннего начала лечения, тяжело переносимого организмом, на сегодняшний день не существует. Именно по этой причине врачи назначают его только после появления беспокоящих симптомов и прогрессирования, то есть ускорения развития заболевания.
В качестве начальной терапии специалисты применяют множество различных лекарств и их комбинаций. Они включают в себя:
- Моноклональные антитела – искусственные, то есть созданные в лаборатории белки иммунной системы, которые прикрепляются к определенной мишени – белкам, находящимся на поверхности измененных клеток.
- Химиотерапию – препараты, которые принимаются внутрь либо вводятся в вену или мышцу и уничтожают лейкозные клетки. Они попадают в кровоток и распространяются по всему телу, воздействуя на любые его области. Такое лечение проводится циклами, включающими в себя периоды отдыха, необходимые организму для восстановления.
- Таргетную терапию – препараты, которые работают только против определенных изменений, присутствующих в неправильных клетках. Они блокируют белки, которые помогают им быстро расти и существовать гораздо дольше, чем длится обычный жизненный цикл.
Если единственной серьезной проблемой является разрастание областей лимфоидной ткани, врачи назначают местное лечение:
- Лучевую терапию – разрушение лейкозных клеток с помощью радиации.
- Хирургию– удаление вызывающей тяжелые симптомы увеличенной селезенки.
В некоторых случаях избыток неправильных клеток приводит к лейкостазу – нарушению кровообращения. Их количество может уменьшить химиотерапия, но это происходит не раньше, чем через несколько дней после введения первой дозы препаратов. Перед ее проведением выполняется лейкаферез – изъятие излишков измененных клеток. Эта процедура сразу же улучшает показатели крови, но эффект от нее длится не долго.
Пациентам, у которых врачи обнаружили очень высокий риск развития заболевания, перед началом лечения может быть рекомендована трансплантация стволовых клеток, из которых образуются нормальные клетки крови.

Прогнозы и выживаемость при хроническом лимфолейкозе
Перспективы каждого пациента индивидуальны и зависят от огромного количества показателей.
Благоприятные прогностические факторы, связанные с длительной продолжительностью жизни:
- Не диффузное, то есть очаговое поражение костного мозга.
- Повреждение только одной части тринадцатой хромосомы.
- Низкая доля лейкозных клеток, содержащих менее 20% белка ZAP-70 или менее 30% CD38.
- Наличие клеток с измененным геном IGHV.
Неблагоприятные прогностические факторы, уменьшающие возможную продолжительность жизни:
- Пожилой возраст.
- Диффузное поражение костного мозга, то есть замещение большого его количества лейкозными клетками.
- Повреждение частей 17 или 11 хромосом.
- Трисомия – 3 двенадцатых хромосомы вместо двух в неправильных клетках.
- Лейкозные клетки без изменения гена IGHV.
- Высокий уровень в крови бета-2-микроглобулина – белка, присутствующего на поверхности почти всех клеток организма. Его количество в крови повышается при воспалениях, лимфоме, лейкозе и других заболеваниях.
- Отсутствие в измененных клетках гена TP53.
- Время, необходимое для удвоения количества лимфоцитов в организме – менее 1 года.
- Высокая доля лейкозных клеток, содержащих более 20% белка ZAP-70 или более 30% CD38.
- Избыток пролимфоцитов, из которых развиваются лимфоциты.
Продолжительность жизни пациентов с хроническим лимфолейкозом в последние годы значительно увеличилась. На сегодняшний день пятилетняя выживаемость, или вероятность прожить 5 или более лет с момента постановки диагноза, составляет 83%.
Зейналова Первин Айдыновна Гематолог, онколог, доктор медицинских наук, профессор, врач высшей категории. Заведующая отделением онкогематологии
Хронический лимфоцитарный лейкоз/лимфома из малых лимфоцитов
Определение заболевания или состояния (группы заболеваний или состояний)
Хронический лимфоцитарный лейкоз (ХЛЛ) и лимфома из малых лимфоцитов (ЛМЛ) – это В-клеточные опухоли из малых В-лимфоцитов. ХЛЛ и ЛМЛ биологически представляют собой одну нозологическую форму. Отличие между ними состоит в том, что при ХЛЛ в крови наблюдается значительный лимфоцитоз (≥5000 моноклональных В-лимфоцитов), тогда как при ЛМЛ выявляется поражение лимфатических узлов, селезенки, но содержание клональных В-клеток в крови ≤5 × 109/л, отсутствуют морфологические признаки поражения костного мозга.Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
С91.1 – Хронический лимфоцитарный лейкоз

Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
— 800 RUB / 5500 KZT / 27 BYN — 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
ХЛЛ может классифицироваться по стадиям (см. раздел Стадирование), а также по группам риска (см. Определение групп риска) [12].
Стадирование
Стадию ХЛЛ устанавливают на основании физикального исследования и анализа крови по критериям J.L. Binet (табл. 1) [12]. Компьютерная томография (КТ), рентгеновское и ультразвуковое исследование (УЗИ) для установления стадии не требуется. Стадия констатируется на текущий момент, указывается в диагнозе и служит ориентиром при определении показаний к терапии.
Стадирование ЛМЛ осуществляется по результатам обследования в соответствии с критериями классификации Ann Arbor (см. раздел Дополнительная информация данных рекомендаций) [13].
Таблица 1. Стадии хронического лимфоцитарного лейкоза по Binet
Стадия Характеристика Медиана выживаемости, мес. Доля пациентов
в дебюте, %A Гемоглобин >100 г/л,
тромбоциты >100 × 10 9 /л,
поражено>120 60 B Гемоглобин >100 г/л,
тромбоциты >100 × 10 9 /л,
поражено >3 лимфатических областей*61 30 C Гемоглобин или
уровень тромбоцитов32 10 *Лимфатические области: шейные лимфатические узлы, подмышечные лимфатические узлы (c 1 или 2 сторон), паховые лимфатические узлы (c 1 или 2 сторон), печень, селезенка.
- наличие del(17p) и/или мутаций TP53,
- мутационный статус генов вариабельного региона иммуноглобулинов (IGHV),
- уровень β2-микроглобулина,
- стадию,
- возраст пациентов.
Таблица 2. Международный прогностический индекс
Параметр Отрицательное значение Отношение рисков Баллы TP53 (17p) Делеция/мутация 4,2 4 Статус IGHV Без мутаций 2,6 2 Уровень β2-микроглобулина, мг/л >3,5 2,0 2 Стадия B/С по Binet или I–IV по Rai 1,6 1 Возраст >65 лет 1,7 1 Возможные значения шкалы 0–10 Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Молекулярный патогенез ХЛЛ – комплексный многоступенчатый процесс, который приводит к репликации клона В-лимфоцитов [1–3]. Почти во всех случаях хроническому лимфолейкозу предшествует моноклональный В-клеточный лимфоцитоз (МВКЛ), который обнаруживается высокоточными методами иммунофенотипирования у 5–15 % лиц старше 40 лет, риск развития МВКЛ увеличивается с возрастом [4]. МВКЛ инициируется комплексом факторов, который включает мутации ряда генов, антигенную стимуляцию, сигналы от микроокружения, эпигенетические модификации и, наконец, цитогенетические нарушения. В результате появляется клон лимфоцитов с фенотипом клеток ХЛЛ. Учитывая многократно преобладающую частоту МВКЛ, к развитию ХЛЛ приводят дополнительные генетические нарушения в 1 из 100 случаев МВКЛ. Клетки ХЛЛ существенно влияют на микроокружение, инициируя появление особого микроокружения и даже специализированных клеток (nurse-like cells), которые определяют их клональную экспансию и дают возможность переживать генотоксические стрессы. Время и химиотерапия приводят к клональной эволюции с накоплением генетических нарушений, которые делают клетки ХЛЛ все более автономными, быстро делящимися и рефракторными к терапии.
Клетки ХЛЛ/ЛМЛ экспрессируют В-клеточные антигенные рецепторы с ограниченным репертуаром специфичности. Постоянная передача сигнала через эти рецепторы и характер этой передачи являются ключевым фактором, определяющим жизнеспособность клеток ХЛЛ и также характер развития этой опухоли. Предполагается, что сигнальный путь В-клеточного рецептора не зависит от антигенов, но осуществляется автономно, возможно при взаимодействии клеток ХЛЛ друг с другом [5,6].Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ХЛЛ – самый частый вид лейкоза у взрослых. В европейских странах заболеваемость им составляет 5 случаев на 100 тыс. человек в год. Заболеваемость увеличивается с возрастом. У лиц старше 70 лет она составляет более 20 случаев на 100 тыс. человек в год. Медиана возраста на момент установления диагноза в европейских странах – 69 лет [7–10]. В Российской Федерации ХЛЛ выявляется реже: в 2017 г. заболеваемость составила 2,95 случая на 100 тыс. человек, медиана возраста на момент установления диагноза – 68 лет [11].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Заболевание может протекать бессимптомно или проявляться лимфаденопатией, увеличением миндалин, спленомегалией, гепатомегалией и неспецифическими симптомами, обусловленными анемией (утомляемость, недомогание), иммуносупрессией (присоединением инфекционных осложнений), интоксикацией (В-симптомами – температурой тела >38°С более 2 нед. подряд без признаков воспаления, ночными профузными потами, похуданием на 10 % массы тела за последние 6 мес.).
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния
Для постановки диагноза ХЛЛ требуются общий анализ крови и иммунофенотипическое исследование с использованием многоцветной проточной цитометрии, которое предпочтительнее выполнять по крови.- МВКЛ >5 000 в 1 мкл крови;
- фенотип СD19+, CD5+, CD23+, CD79b+dim, CD20+dim, CD22+dim, sIg dim, CD81dim, CD160dim;
- рестрикция легких цепей (каппа либо лямбда);
- >30 % лимфоцитов в костном мозге;
- диагноз ХЛЛ не устанавливается при наличии цитопении или связанных с заболеванием симптомов при количестве моноклональных В-лимфоцитов
Жалобы и анамнез
- Всем пациентам с подозрением на ХЛЛ, а также всем пациентам с верифицированным ХЛЛ при каждом приеме у гематолога рекомендуется сбор анамнеза и жалоб при заболеваниях органов кроветворения и крови для оценки состояния пациента, а также для выявления факторов, которые могут оказать влияние на выбор лечебной тактики пациента [12,16].
Физикальное обследование
- Всем пациентам с подозрением на ХЛЛ/ЛМЛ или выявленным ХЛЛ/ЛМЛ при первичном или повторном приеме, при контрольных обследованиях и при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение визуального терапевтического осмотра, терапевтической пальпации и терапевтической аускультации для уточнения распространенности заболевания и оценки состояния пациента, в том числе отдельных органов и систем [12,16].
Лабораторные диагностические исследования
Лабораторные исследования для оценки общего состояния пациента
- Всем пациентам с подозрением на ХЛЛ/ЛМЛ или выявленным ХЛЛ/ЛМЛ при первичном или повторном приеме, при оценке ремиссии через 2 мес. после завершения терапии, при контрольных обследованиях и при подозрении на рецидив заболевания рекомендуется выполнить развернутый клинический анализ крови с определением уровня гемоглобина, количества эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы и количества ретикулоцитов для верификации диагноза, уточнения активности заболевания, определения возможности проведения терапии и/или (в случае ранее проведенной терапии) – развития нежелательных явлений лечения [12,16].
- Всем пациентам с ХЛЛ/ЛМЛ перед проведением противоопухолевой терапии для оценки общего состояния, определения необходимости проведения сопутствующей или сопроводительной терапии или редукции доз препаратов рекомендуется выполнение следующих лабораторных исследований:
Лабораторные исследования для верификации диагноза и оценки прогностических факторов
- При подозрении на ХЛЛ у пациентов с числом В-лимфоцитов ≥5000 в 1 мкл рекомендуется выполнить иммунофенотипирование лимфоцитов крови методом проточной цитофлуориметрии с целью верификации диагноза [17].
- При подозрении на ЛМЛ у пациентов без клинического лимфоцитоза в крови, а также у пациентов с подозрением на трансформацию рекомендуется выполнить биопсию лимфатического узла (очага поражения) и патолого-анатомическое исследование биопсийного (операционного) материала лимфатического узла с применением иммуногистохимических методов для верификации диагноза [12,16,18].
- Пациентам с подозрением на ХЛЛ/ЛМЛ для оценки объема поражения костного мозга и состояния остальных ростков кроветворения, исключения поражения костного мозга другими опухолями и инфекциями, а также для получения исходного образца костного мозга, необходимого для сравнения с образцом, полученным после проведения терапии рекомендуется: 1) получение цитологического препарата костного мозга путем пункции (стернальной пункции), цитологическое (миелограмма) и иммунофенотипическое (методом проточной цитофлуориметрии) исследование мазка костного мозга либо 2) получение гистологического препарата костного мозга (трепанобиопсия), патолого-анатомическое исследование биопсийного (операционного) материала костного мозга с применением иммуногистохимических методов в следующих случаях [17]:
- Всем пациентам с ХЛЛ/ЛМЛ перед началом 1-й и всех последующих линий терапии рекомендуется проведение молекулярно-цитогенетического исследования с применением метода флуоресцентной гибридизации (FISH) на делецию 17p и определение мутаций гена TP53, а также (при наличии возможности) на +12; del(11q), del(13q), del(17p) для определения прогностической группы и выработки тактики лечения [14].
- Всем пациентам с ХЛЛ/ЛМЛ на момент установления диагноза рекомендуется определение мутации генов IGHV для уточнения прогноза заболевания [14].
- Всем пациентам с ХЛЛ/ЛМЛ через 6 мес. после завершения лечения рекомендуется иммунофенотипирование биологического материала методом проточной цитофлуориметрии для выявления маркеров минимальной остаточной болезни (МОБ) при гемобластозах [19].
Другие обязательные лабораторные исследования
- Всем пациентам с ХЛЛ/ЛМЛ перед проведением 1-й линии противоопухолевой терапии рекомендуется определение основных групп крови по системе AB0, определение антигена D системы резус (резус-фактора), определение фенотипа антигенов эритроцитов для возможности выполнения гемотрансфузии при наличии показаний до, во время или после терапии [16].
- Всем пациентам с ХЛЛ/ЛМЛ перед проведением терапии антителами к CD20 или ибрутинибом** с целью уточнения риска и в случае необходимости профилактики реактивации вирусного гепатита [20]рекомендуется выполнение развернутого вирусологического исследования для выявления маркеров вируса гепатита B, которое должно включать определение:
- Всем первичным пациентам с ХЛЛ/ЛМЛ перед проведением 1-й линии противоопухолевой терапии рекомендуется молекулярно-биологическое исследование крови на наличие вируса иммунодефицита человека (Определение антител классов M, G (IgM, IgG) к вирусам иммунодефицита человека ВИЧ-1 и ВИЧ-2 (Human immunodeficiency virus HIV 1 и Human immunodeficiency virus HIV 2) в крови для уточнения необходимости одновременного проведения противоопухолевой и антиретровирусной терапии [16].
- Всем пациентам с ХЛЛ/ЛМЛ на момент установления диагноза, после каждой иммуносупрессивной терапии и после каждой тяжелой бактериальной инфекции рекомендуется определение уровня иммуноглобулинов [12,16].
Инструментальные диагностические исследования
- Всем пациентам перед началом терапии ХЛЛ/ЛМЛ, при оценке ремиссии через 2 мес. после завершения терапии (если имелось поражение лимфатических узлов области средостения и/или легочной ткани), а также при подозрении на рецидив/прогрессирование заболевания рекомендуется выполнение КТ грудной клетки, органов брюшной полости и малого таза (с контрастированием) для уточнения наличия и распространенности лимфаденопатии или оценки противоопухолевого эффекта, если исследование выполнено в динамике [12,16].
- Пациентам перед началом терапии ХЛЛ/ЛМЛ, если выявлены противопоказания к КТ, при оценке ремиссии через 2 мес. после завершения терапии (если имелось поражение лимфатических узлов области средостения и/или легочной ткани), а также при подозрении на рецидив/прогрессирование заболевания рекомендуется для уточнения наличия и распространенности лимфаденопатии выполнить следующие исследования [12,16]:
- Пациентам с подозрением на ХЛЛ/ЛМЛ либо с установленным диагнозом ХЛЛ/ЛМЛ, у которых имеются клинические признаки синдрома Рихтера или ходжкинской трансформации (прогрессирующий рост лимфатических узлов, потеря веса, персистирующая лихорадка без признаков инфекции, высокий уровень лактатдегидрогеназы, гиперкальциемия), рекомендуется выполнить позитронную эмиссионную томографию с применением туморотропных радиофармпрепаратов для исключения трансформации либо для выявления зон с вероятной трансформацией [21].
- Всем пациентам с верифицированным ХЛЛ/ЛМЛ перед началом терапии для своевременного выявления сопутствующей патологии со стороны сердечно-сосудистой, дыхательной и пищеварительной систем и для определения необходимости их профилактики или лечения рекомендуется выполнить следующие исследования [16]:
Иные диагностические исследования
- Всем пациентам с ХЛЛ/ЛМЛ с коморбидностью, которая может повлиять на выбор программы противоопухолевого лечения, перед началом терапии рекомендуется консультация соответствующего врача-специалиста (врача-кардиолога, врача-невролога, врача-оториноларинолога и др.) [16].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Показания к началу терапии В-клеточного ХЛЛ
- Всем пациентам с верифицированным ХЛЛ/ЛМЛ рекомендуется начало специфической терапии только при наличии показаний в соответствии с критериями IWCLL 2018 (см. приложение А3.2) [12,16].
Первая линия лечения ХЛЛ
Цели лечения в первую очередь определяются возрастом, а также числом и тяжестью сопутствующих заболеваний (табл. 3).
Таблица 3. Подразделение на группы пациентов с хроническим лимфоцитарным лейкозом
Коморбидность, возраст Нет значимой коморбидности Значимая коморбидность Старческий возраст, органные патологии Цель терапии Долгосрочная ремиссия, эрадикация МОБ Контроль над болезнью,
низкая токсичностьПаллиативная Существует объективная шкала оценки числа и тяжести сопутствующих заболеваний (коморбидности) – CIRS (Cumulative Illness Rating Score) (см. приложение Г2). В реальной клинической практике оценка кумулятивного индекса коморбидности не требуется. В настоящее время понятие «значимая коморбидность» не может быть объективно и воспроизводимо определено. В связи с этим распределение пациентов на терапевтические группы проводится по решению врача.
Результаты крупных клинических исследований 2000-х гг. убедительно свидетельствуют о низкой эффективности иммунохимиотерапии у пациентов с делецией 17p. Однако это цитогенетическое нарушение выявляется до начала терапии 1-й линии только у 7 % пациентов. Число пациентов с клинической рефрактерностью (прогрессированием на фоне лечения или быстрым рецидивом) приблизительно в 2 раза больше. Эти наблюдения легли в основу понятия ХЛЛ высокого риска.- К 1-й группе относятся молодые пациенты (менее 65 лет) без делеции 17p и/или мутации TP53 с хорошим соматическим статусом без сопутствующих заболеваний. В этой группе необходимо стремиться к достижению полной ремиссии, по возможности с эрадикацией МОБ, поскольку только такая тактика может привести к реальному увеличению продолжительности жизни. Основа лечения пациентов этой группы – курсовая иммунохимиотерапия. В подгруппе пациентов без мутаций генов IGHV комбинация ибрутиниба** и ритуксимаба** оказалась значительно более эффективной и менее токсичной по сравнению с режимом FCR. У пациентов без мутаций генов IGHV может рассматриваться возможность терапии ибрутинибом**.
- Ко 2-й группе относятся пациенты преклонного возраста (старше 65 лет), а также молодые пациенты со множеством сопутствующих заболеваний. В этой группе нужно стремиться к достижению эффективного контроля над опухолью, избегая неоправданной токсичности. Аналоги пуринов в этой группе лучше не использовать или применять в редуцированном виде.
- К 3-й группе относятся пациенты с делецией 17p и/или мутацией TP53 независимо от возраста и коморбидности. Терапией выбора у этих пациентов является применение ибрутиниба** в монорежиме. У молодых пациентов при возможности терапия ибрутинибом** должна служить подготовкой к трансплантации аллогенных стволовых клеток.
Первая линия лечения ХЛЛ/ЛМЛ у пациентов моложе 65 лет с хорошим соматическим статусом без выявленной делеции 17p или мутации TP53
- Пациентам с верифицированным ХЛЛ/ЛМЛ моложе 65 лет без значимой коморбидности (физически активным, без тяжелых сопутствующих заболеваний, с нормальной функцией почек) без делеции 17p или мутации TP53 в качестве 1-й линии лечения рекомендуется для достижения ремиссии проведение иммунохимиотерапии по схеме FCR: (Ритуксимаб** – 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1; #Флударабин** – 25 мг/м 2 в/в кап., дни 1–3; #Циклофосфамид** – 250 мг/м 2 в/в кап., дни 1–3). (схемы режимов лечения см. в приложении А3.3) [23,24].
- Пациентам с верифицированным ХЛЛ/ЛМЛ моложе 65–70 лет без значимой коморбидности (физически активным, без тяжелых сопутствующих заболеваний, с нормальной функцией почек) без делеции 17p или мутации TP53, у которых не может быть проведен режим FCR (схемы режимов лечения см. в приложении А3.3), в качестве 1-й линии рекомендуется проведение иммунохимиотерапии по схеме RB (ритуксимаб** – 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1; #бендамустин** – 90 мг/м 2 в/в кап., дни 1, 2) для достижения ремиссии (схемы режимов лечения см. в приложении А3.3) [25,26].
- Пациентам с верифицированным ХЛЛ/ЛМЛ моложе 65–70 лет без значимой коморбидности без мутаций генов IGHV при наличии возможности в качестве одной из опций 1-й линии терапии может быть рекомендована для достижения ремиссии терапия ибрутинибом** в монорежиме в дозе 420 мг/сут (3 капсулы) внутрь 1 раз в день до прогрессирования или развития непереносимой токсичности или в комбинации с ритуксимабом** (ибрутиниб** – 420 мг/сут (3 капсулы) внутрь 1 раз в день, ежедневно; #ритуксимаб** – 50 мг/м 2 в/в кап., день 1 цикла 2; 375 мг/м 2 в/в кап., день 2 цикла 2; 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1 циклов 3–7, лечение возобновляется на 29-й день, всего 7 циклов) (схемы режимов лечения см. в приложении А3.3) [27,28].
- Пациентам, получающим ритуксимаб** в 1-й линии лечения ХЛЛ/ЛМЛ, при сложности осуществления венозного доступа начиная со 2-й дозы может быть рекомендовано применение подкожной формы ритуксимаба** в фиксированной дозе 1600 мг (схемы режимов лечения см. в приложении А3.3) [30].
Первая линия лечения ХЛЛ у пожилых пациентов и пациентов с коморбидностью без выявленной делеции 17p или мутации TP53
- Пациентам с верифицированным ХЛЛ/ЛМЛ старше 65–70 лет и пациентам с тяжелыми сопутствующими заболеваниями или угнетением почечной функции без делеции 17p или мутации TP53рекомендуется для достижения ремиссии проведение 1-й линии терапии по одной из следующих схем в зависимости от предпочтений и опыта медицинского центра и лечащего врача (схемы режимов лечения см. в приложении А3.3):
- Хлорамбуцил** 0,5 мг/кг внутрь, дни 1, 15 + обинутузумаб** 1000 мг в/в, день 1 (100 мг в течение 4 часов), 2 (900 мг), 8, 15 (цикл 1), день 1 (циклы 2–6). Лечение возобновляется на 29-й день [31].
- #Бендамустин** 90 мг/м 2 в/в кап., дни 1, 2 ± ритуксимаб** 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1. Лечение возобновляется на 29-й день [25,26,32].
- Ибрутиниб** 420 мг/сут (3 капсулы) внутрь 1 раз в день, ежедневно ± ритуксимаб** 50 мг/м 2 в/в кап., день 1 цикла 2; 375 мг/м 2 в/в кап., день 2 цикла 2; 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1 циклов 3–7, лечение возобновляется на 29-й день [33–35].
- Режим FCR-Lite (ритуксимаб** – 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1; флударабин** – 20 мг/м 2 внутрь, дни 1–3; циклофосфамид** – 150 мг/м 2 внутрь, дни 1–3. Лечение возобновляется на 29-й день) [36].
- Хлорамбуцил** 10 мг/м 2 внутрь, дни 1–7 + ритуксимаб** 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1. Лечение возобновляется на 29-й день [37,38].
- #Венетоклакс 20 мг/сут, дни 22–28 цикла 1; 50 мг/сут дни 1–7 цикла 2; 100 мг/сут дни 8–14 цикла 2; 200 мг/сут дни 15–21 цикла 2; 400 мг/сут дни 22–28 цикла 2, далее 400 мг/сут в течение 12 мес + обинутузумаб** 100 мг, день 1 цикла 1; 900 мг день 2 цикла 1; 1000 мг день 8 цикла 1; 1000 мг день 15 цикла 1; 1000 мг день 1 цикла 2; 1000 мг день 1 циклов 3–6 [39].
- Венетоклакс в режиме монотерапии 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), до прогрессирования или развития непереносимой токсичности – пациентам, которым лечение ибрутинибом** не может быть назначено [40].
- Пациентам старше 75–80 лет с верифицированным ХЛЛ/ЛМЛ и невысокой ожидаемой продолжительностью жизни, обусловленной возрастом, органной недостаточностью, тяжелыми сопутствующими заболеваниями, рекомендованы наименее токсичные варианты терапии:
- Монотерапия хлорамбуцилом** 0,07–0,20 мг/кг внутрь ежедневно в течение 2–4 нед. с последующим подбором дозы. [41].
- Монотерапия моноклональными антителами к CD20 — ритуксимаб** или обинутузумаб** в соответствующей зарегистрированной инструкции дозировке [42].
- Монотерапия ибрутинибом** в малых дозах, соответственно зарегистрированной инструкции [43].
Первая линия лечения ХЛЛ у пациентов с делецией 17p или мутацией TP53
- Пациентам с верифицированным ХЛЛ/ЛМ из группы высокого риска (с del(17p) и/или мутацией TP53) для достижения ремиссии при наличии возможности рекомендована терапия ибрутинибом** до прогрессирования или развития непереносимой токсичности. Ибрутиниб** может применяться как в монорежиме, так и в комбинации с иммунохимиопрепаратами (бендамустин**, ритуксимаб**) (схемы режимов лечения см. в приложении А3.3) [33,44].
- Пациентам с верифицированным ХЛЛ/ЛМЛ из группы высокого риска (с del(17p) и/или мутацией TP53) при наличии возможности рекомендована терапия комбинацией венетоклакса 20 мг/сут, дни 22–28 цикла 1; 50 мг/сут дни 1–7 цикла 2; 100 мг/сут дни 8–14 цикла 2; 200 мг/сут дни 15–21 цикла 2; 400 мг/сут дни 22–28 цикла 2, далее 400 мг/сут в течение 12 мес. и обинутузумаба** 100 мг, день 1 цикла 1; 900 мг день 2 цикла 1; 1000 мг день 8 цикла 1; 1000 мг день 15 цикла 1; 1000 мг день 1 цикла 2; 1000 мг день 1 циклов 3–6. фиксированной продолжительностью 12 мес. (схемы режимов лечения см. в приложении А3.3) [39].
- Молодым пациентам с верифицированным ХЛЛ/ЛМЛ без значимой коморбидности из группы высокого риска (с del(17p) и/или мутацией TP53) после терапии ибрутинибом** и при достижении объективного ответа в 1-й линии рекомендовано рассмотреть возможность проведения трансплантации аллогенных гемопоэтических стволовых клеток в качестве консолидации [45,46].
- Пациентам с верифицированным ХЛЛ/ЛМЛ из группы высокого риска (с del(17p) и/или мутацией TP53), которым лечение ибрутинибом** не может быть назначено, при наличии возможности рекомендуется назначение венетоклакса в режиме монотерапии (схемы режимов лечения см. в приложении А3.3) [47].
Выбор терапии ХЛЛ 2-й и последующих линий
- терапия 1-й линии;
- время наступления рецидива;
- клиническая картина рецидива.
- Пациентам с поздним рецидивом ХЛЛ/ЛМЛ после иммунохимиотерапии (>24 мес. после последней терапии) при отсутствии делеции 17p и мутации TP53рекомендуется один из следующих вариантов лечения (схемы режимов лечения см. в приложении А3.3):
- Повтор иммунохимиотерапии 1-й линии [48].
- Альтернативный режим иммунохимиотерапии [48,49].
- Ибрутиниб** 420 мг/сут (3 капсулы) внутрь 1 раз в день ежедневно в течение всего курса и далее (после завершения циклов BR) – до прогрессирования или развития неприемлемой токсичности ± BR (#бендамустин** – 90 мг/м 2 в/в кап., дни 2–3 цикла 1; дни 1, 2 циклов 2–6; ритуксимаб** – 375 мг/м 2 в/в кап., день 1 цикла 1; 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1 циклов 2–6. Лечение возобновляется на 29-й день., всего 6 циклов) [50–53].
- Комбинация венетоклакса 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом** и ритуксимаба** 375 мг/м 2 в/в кап. через 1 нед. после достижения дозы венетоклакса 400 мг/сут, далее – 500 мг/м 2 в/в кап. или 1400 мг п/к ежемесячно, всего 6 введений [54].
- Пациентам с ранним (TP53 по возможности рекомендована монотерапия ибрутинибом** в соответствии с зарегистрированной инструкцией [50,51].
- Пациентам с ранним (TP53 в качестве альтернативы ибрутинибу** может быть рекомендована комбинация венетоклакса 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом** и ритуксимаба** 375 мг/м 2 в/в кап. через 1 нед. после достижения дозы венетоклакса 400 мг/сут, далее – 500 мг/м 2 в/в кап. или 1400 мг п/к ежемесячно, всего 6 введений для применения фиксированным курсом длительностью
24 мес. (схемы режимов лечения см. в приложении А3.3) [54].
- Пациентам с ранним (TP53 по возможности рекомендована комбинация венетоклакса 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом** и ритуксимаба** 375 мг/м 2 в/в кап. через 1 нед. после достижения дозы венетоклакса 400 мг/сут, далее – 500 мг/м 2 в/в кап. или 1400 мг п/к ежемесячно, всего 6 введений (схемы режимов лечения см. в приложении А3.3) [54].
- Пациентам с ХЛЛ/ЛМЛ моложе 65 лет без значимой коморбидности, которые в связи с ранним рецидивом или в связи с выявлением при рецидиве делеции 17p и/или мутации TP53 получали ибрутиниб** или комбинацию венетоклакса с ритуксимабом**, при достижении объективного ответа на терапию рецидива рекомендуется рассмотреть возможность аллогенной трансплантации гемопоэтических стволовых клеток в качестве консолидации [45,46].
- Пациентам с ХЛЛ/ЛМЛ, у которых наблюдался рецидив во время приема ибрутиниба**, при наличии возможности рекомендуется комбинация венетоклакса и ритуксимаба** (схемы режимов лечения см. в приложении А3.3) [47,54].
- Пациентам, получающим ритуксимаб** по поводу рецидива либо рефрактерного течения ХЛЛ/ЛМЛ, при сложности осуществления венозного доступа начиная со 2-й дозы может быть рекомендовано применение подкожной формы ритуксимаба** в фиксированной дозе 1600 мг (схемы режимов лечения см. в приложении А3.3) [30].
- Пациентам с ранним рецидивом (TP53, если отсутствует возможность проведения терапии ибрутинибом** или венетоклаксом, рекомендуется консультация в федеральном центре с рассмотрением возможности проведения современной терапии в федеральном центре, или участия пациента в клиническом исследовании, или, в крайнем случае, иммунохимиотерапии в альтернативном режиме [16,29].
Сопутствующая и сопроводительная терапия
- Пациентам c ХЛЛ/ЛМЛ на любом этапе лечения, у которых выявлен уровень иммуноглобулина G рекомендовано при наличии возможности проведение постоянной заместительной терапии внутривенным иммуноглобулином для снижения риска инфекционных осложнений [56].
- Всем пациентам с ХЛЛ/ЛМЛ после установления диагноза рекомендуется при отсутствии противопоказаний проведение вакцинации [57–59]:
Оценка ответа на лечение
- Всем пациентам с ХЛЛ/ЛМЛ рекомендуется оценка терапии по критериям IWCLL 2018 (см. раздел 7.3 данных рекомендаций) при терапии ограниченной длительности (не менее чем через 2 мес. после ее окончания), при непрерывной или поддерживающей терапии (не менее чем через 2 мес. после достижения максимального ответа) [12].
Обезболивание
- Пациентам с ХЛЛ/ЛМЛ при возникновении острого или хронического болевого синдрома рекомендуется провести диагностику причины болевого синдрома и последующую патогенетическую или сипмтоматическую терапию болевого синдрома в соответствии с существующими профильными рекомендациями [60,61].
Медицинская реабилитация
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- Всем пациентам с ХЛЛ/ЛМЛ на всех этапах терапии заболевания, а также после завершения лекарственного лечения рекомендуется комплексная реабилитация, а также при необходимости поддерживающая терапия для улучшения результатов лечения и качества жизни пациента [62].
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Методов профилактики ХЛЛ/ЛМЛ в настоящее время не существует, поскольку неизвестен этиологический фактор или факторы, ведущие к развитию заболевания.
- Всем пациентам с ХЛЛ/ЛМЛ на протяжении всей жизни пациента (как в период лечения, так и вне его) рекомендуется диспансерное наблюдение у гематолога [12,16].
- Пациентам, у которых проводилось/проводится лечение по поводу ХЛЛ/ЛМЛ, рекомендуется проведение регулярных плановых скрининговых обследований из-за повышенного риска развития вторых опухолей [63,64].
Информация
Источники и литература
- Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Национального гематологического общества
- 1. Packham G., Stevenson F. The role of the B-cell receptor in the pathogenesis of chronic lymphocytic leukaemia // Seminars in Cancer Biology. 2010. Vol. 20, № 6. P. 391–399. 2. Vardi A. et al. Immunogenetic studies of chronic lymphocytic leukemia: Revelations and speculations about ontogeny and clinical evolution // Cancer Research. American Association for Cancer Research Inc., 2014. Vol. 74, № 16. P. 4211–4216. 3. Murray F. et al. Stereotyped patterns of somatic hypermutation in subsets of patients with chronic lymphocytic leukemia: Implications for the role of antigen selection in leukemogenesis // Blood. 2008. Vol. 111, № 3. P. 1524–1533. 4. Strati P., Shanafelt T.D. Monoclonal B-cell lymphocytosis and early-stage chronic lymphocytic leukemia: Diagnosis, natural history, and risk stratification // Blood. American Society of Hematology, 2015. Vol. 126, № 4. P. 454–462. 5. Zhang S., Kipps T.J. The Pathogenesis of Chronic Lymphocytic Leukemia // Annu. Rev. Pathol. Mech. Dis. 2014. Vol. 9, № 1. P. 103–118. 6. Burger J.A., Chiorazzi N. B cell receptor signaling in chronic lymphocytic leukemia // Trends in Immunology. 2013. Vol. 34, № 12. P. 592–601. 7. Morton L.M. et al. Lymphoma incidence patterns by WHO subtype in the United States, 1992-2001 // Blood. 2006. Vol. 107, № 1. P. 265–276. 8. Watson L., Wyld P., Catovsky D. Disease burden of chronic lymphocytic leukaemia within the European Union // Eur. J. Haematol. 2008. Vol. 81, № 4. P. 253–258. 9. Jemal A. et al. Cancer statistics, 2007. // CA. Cancer J. Clin. 2007. Vol. 57, № 1. P. 43–66. 10. Dores G.M. et al. Chronic lymphocytic leukaemia and small lymphocytic lymphoma: Overview of the descriptive epidemiology // Br. J. Haematol. 2007. Vol. 139, № 5. P. 809–819. 11. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 12. Hallek M. et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL // Blood. American Society of Hematology, 2018. Vol. 131, № 25. P. 2745–2760. 13. Armitage J.O. Staging Non-Hodgkin Lymphoma // CA. Cancer J. Clin. Wiley, 2005. Vol. 55, № 6. P. 368–376. 14. An international prognostic index for patients with chronic lymphocytic leukaemia (CLL-IPI): a meta-analysis of individual patient data // Lancet Oncol. Lancet Publishing Group, 2016. Vol. 17, № 6. P. 779–790. 15. Swerdlow S.H. et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms // Blood. 2016. 16. Никитин Е.А. et al. Хронический лимфолейкоз. // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 179–200. 17. Morice W.G. et al. Predictive value of blood and bone marrow flow cytometry in B-cell lymphoma classification: Comparative analysis of flow cytometry and tissue biopsy in 252 patients // Mayo Clin. Proc. Elsevier Ltd, 2008. Vol. 83, № 7. P. 776–785. 18. Rawstron A.C. et al. Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia // N. Engl. J. Med. Massachussetts Medical Society, 2008. Vol. 359, № 6. P. 575–583. 19. Molica S., Giannarelli D., Montserrat E. Minimal Residual Disease and Survival Outcomes in Patients With Chronic Lymphocytic Leukemia: A Systematic Review and Meta-analysis. // Clin. Lymphoma. Myeloma Leuk. 2019. Vol. 19, № 7. P. 423–430. 20. Rossi D. et al. Occult hepatitis B virus infection of peripheral blood mononuclear cells among treatment-naïve patients with chronic lymphocytic leukemia // Leuk. Lymphoma. 2009. Vol. 50, № 4. P. 604–611. 21. Conte M.J. et al. Use of positron emission tomography-computed tomography in the management of patients with chronic lymphocytic leukemia/small lymphocytic lymphoma // Leuk. Lymphoma. Informa Healthcare, 2014. Vol. 55, № 9. P. 2079–2084. 22. Parikh S.A., Kay N.E., Shanafelt T.D. How we treat Richter syndrome. // Blood. 2014. Vol. 123, № 11. P. 1647–1657. 23. Hallek M. et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: A randomised, open-label, phase 3 trial // Lancet. Lancet Publishing Group, 2010. Vol. 376, № 9747. P. 1164–1174. 24. Fischer K. et al. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: Updated results of the CLL8 trial // Blood. American Society of Hematology, 2016. Vol. 127, № 2. P. 208–215. 25. Fischer K. et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: A multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group // J. Clin. Oncol. 2012. Vol. 30, № 26. P. 3209–3216. 26. Eichhorst B. et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial // Lancet Oncol. Lancet Publishing Group, 2016. Vol. 17, № 7. P. 928–942. 27. Shanafelt T., Wang V., Kay N. A randomized phase III study of ibrutinib (PCI-32765)-based therapy vs. standard fludarabine, cyclophosphamide, and rituximab (FCR) chemoimmunotherapy in untreated younger patients with chronic lymphocytic leukemia (CLL): a trial of the ECOG-ACRIN Cancer // ASH Annual Meeting. 2018. P. LBA-4. 28. Burger J.A. et al. Randomized trial of ibrutinib vs ibrutinib plus rituximab in patients with chronic lymphocytic leukemia. // Blood. 2019. Vol. 133, № 10. P. 1011–1019. 29. National Comprehensive Cancer Network. NCCN Practice Guidelines in Oncology. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma. 2019. 30. Assouline S. et al. Pharmacokinetics, safety, and efficacy of subcutaneous versus intravenous rituximab plus chemotherapy as treatment for chronic lymphocytic leukaemia (SAWYER): a phase 1b, open-label, randomised controlled non-inferiority trial. // Lancet. Haematol. 2016. Vol. 3, № 3. P. e128-38. 31. Goede V. et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions // N. Engl. J. Med. Massachussetts Medical Society, 2014. Vol. 370, № 12. P. 1101–1110. 32. Michallet A.S. et al. Rituximab plus bendamustine or chlorambucil for chronic lymphocytic leukemia: Primary analysis of the randomized, open-label mable study // Haematologica. Ferrata Storti Foundation, 2018. Vol. 103, № 4. P. 698–706. 33. Burger J.A. et al. Ibrutinib as initial therapy for patients with chronic lymphocytic leukemia // N. Engl. J. Med. Massachussetts Medical Society, 2015. Vol. 373, № 25. P. 2425–2437. 34. Burger J.A. et al. Ibrutinib for First-Line Treatment of Older Patients With Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma (CLL/SLL): A 4-Year Experience From the REASONATE-2 Study // EHA 23 Proceedings. 2018. P. Abstract PF343. 35. Woyach J.A. et al. Ibrutinib Regimens versus Chemoimmunotherapy in Older Patients with Untreated CLL. // N. Engl. J. Med. 2018. Vol. 379, № 26. P. 2517–2528. 36. Nikitin E. Randomised Comparison Of FCR-Lite And ClbR (Chlorambucil Plus Rituximab) Regimens In Elderly Patients With Chronic Lymphocytic Leukemia // EHA 18 Proceedings. 2013. P. Abstract NS1147. 37. Foà R. et al. Chlorambucil plus rituximab with or without maintenance rituximab as first-line treatment for elderly chronic lymphocytic leukemia patients // Am. J. Hematol. Wiley-Liss Inc., 2014. Vol. 89, № 5. P. 480–486. 38. Hillmen P. et al. Rituximab plus chlorambucil as first-line treatment for chronic lymphocytic leukemia: Final analysis of an open-label phase II study // J. Clin. Oncol. American Society of Clinical Oncology, 2014. Vol. 32, № 12. P. 1236–1241. 39. Fischer K. et al. Venetoclax and Obinutuzumab in Patients with CLL and Coexisting Conditions. // N. Engl. J. Med. 2019. Vol. 380, № 23. P. 2225–2236. 40. Jones J.A. et al. Venetoclax for chronic lymphocytic leukaemia progressing after ibrutinib: an interim analysis of a multicentre, open-label, phase 2 trial. // Lancet. Oncol. 2018. Vol. 19, № 1. P. 65–75. 41. Catovsky D., Else M., Richards S. Chlorambucil-still not bad: A reappraisal // Clinical Lymphoma, Myeloma and Leukemia. Elsevier Inc., 2011. Vol. 11, № SUPPL.1. P. S2. 42. Hainsworth J.D. et al. Single-agent rituximab as first-line and maintenance treatment for patients with chronic lymphocytic leukemia or small lymphocytic lymphoma: A phase II trial of the Minnie Pearl Cancer Research Network // J. Clin. Oncol. 2003. Vol. 21, № 9. P. 1746–1751. 43. Michallet A.-S. et al. Ibrutinib in very elderly patients with relapsed/refractory chronic lymphocytic leukemia: A real-world experience of 71 patients treated in France: A study from the French Innovative Leukemia Organization (FILO) group. // Am. J. Hematol. 2017. Vol. 92, № 6. P. E105–E107. 44. Burger J.A. et al. Safety and activity of ibrutinib plus rituximab for patients with high-risk chronic lymphocytic leukaemia: A single-arm, phase 2 study // Lancet Oncol. Lancet Publishing Group, 2014. Vol. 15, № 10. P. 1090–1099. 45. Sorror M.L. et al. Five-year follow-up of patients with advanced chronic lymphocytic leukemia treated with allogeneic hematopoietic cell transplantation after nonmyeloablative conditioning // J. Clin. Oncol. 2008. Vol. 26, № 30. P. 4912–4920. 46. Dreger P. et al. Allogeneic stem cell transplantation provides durable disease control in poor-risk chronic lymphocytic leukemia: Long-term clinical and MRD results of the German CLL Study Group CLL3X trial // Blood. 2010. Vol. 116, № 14. P. 2438–2447. 47. Stilgenbauer S. et al. Venetoclax in relapsed or refractory chronic lymphocytic leukaemia with 17p deletion: a multicentre, open-label, phase 2 study // Lancet Oncol. Lancet Publishing Group, 2016. Vol. 17, № 6. P. 768–778. 48. Tam C.S. et al. Life After FCR: Outcomes of patients with chronic lymphocytic leukemia who progress after frontline treatment with Fludarabine, Cyclophosphamide and Rituximab. // Blood. 2014. P. 3059–3064. 49. Fischer K. et al. Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: A Multicenter Phase II trial of the German Chronic Lymphocytic Leukemia Study Group // J. Clin. Oncol. 2011. Vol. 29, № 26. P. 3559–3566. 50. Byrd J.C. et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. // N. Engl. J. Med. 2014. Vol. 371, № 3. P. 213–223. 51. Moreno C. et al. Ibrutinib in previously treated chronic lymphocytic leukemia: updated efficacy and safety of the RESONATE study with up to four years of follow-up // EHA 22 Proceedings. 2017. P. Abstract S769. 52. Chanan-Khan A. et al. Ibrutinib combined with bendamustine and rituximab compared with placebo, bendamustine, and rituximab for previously treated chronic lymphocytic leukaemia or small lymphocytic lymphoma (HELIOS): A randomised, double-blind, phase 3 study // Lancet Oncol. Lancet Publishing Group, 2016. Vol. 17, № 2. P. 200–211. 53. Hallek M. et al. Three-year follow-up of patients with previously treated chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL) receiving ibrutinib plus bendamustine and rituximab (BR) versus placebo plus BR: an update of the HELIOS study. // Leuk. Lymphoma. 2017. Vol. 58. P. 192–194. 54. Seymour J.F. et al. Venetoclax-Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. // N. Engl. J. Med. 2018. Vol. 378, № 12. P. 1107–1120. 55. Castro J.E. et al. Rituximab in combination with high-dose methylprednisolone for the treatment of chronic lymphocytic leukemia // Leukemia. Nature Publishing Group, 2009. Vol. 23, № 10. P. 1779–1789. 56. Raanani P. et al. Immunoglobulin prophylaxis in chronic lymphocytic leukemia and multiple myeloma: systematic review and meta-analysis. // Leuk. Lymphoma. 2009. Vol. 50, № 5. P. 764–772. 57. Константинова Т.С., Клясова Г.А., Капланов К.Д. Лечение и профилактика инфекционных осложнений у пациентов с лимфопролиферативными заболеваниями. // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 289–311. 58. Rubin L.G. et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. // Clin. Infect. Dis. 2014. Vol. 58, № 3. P. 309–318. 59. Sinisalo M. et al. Response to vaccination against different types of antigens in patients with chronic lymphocytic leukaemia. // Br. J. Haematol. 2001. Vol. 114, № 1. P. 107–110. 60. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p. 61. Абузарова Г.Р. Лечение болевого синдрома у онкологических больных // Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний; под ред. И.В. Поддубной, В.Г. Савченко. 2018. P. 278–288. 62. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies. // Am. J. Phys. Med. Rehabil. 2011. Vol. 90, № 5 Suppl 1. P. S88-94. 63. Reda G. et al. Secondary Malignancies in Chronic Lymphocytic Leukemia: A Single Centre Retrospective Analysis of 514 Cases // Blood. 2015. Vol. 126, № 23. 64. Beiggi S. et al. Increased risk of second malignancies in chronic lymphocytic leukaemia patients as compared with follicular lymphoma patients: a Canadian population-based study. // Br. J. Cancer. 2013. Vol. 109, № 5. P. 1287–1290. 65. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. 1982. Vol. 5, № 6. P. 649–655. 66. Linn B.S., Linn M.W., Gurel L. Cumulative illness rating scale // J. Am. Geriatr. Soc. 1968. Vol. 16, № 5. P. 622–626.
Информация
Список сокращений
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВБП – выживаемость без прогрессирования
ДИ – доверительный интервал
КТ – компьютерная томография
ЛМЛ – лимфома из малых лимфоцитов
МВКЛ – моноклональный В-клеточный лимфоцитоз
МНО – международное нормализованное отношение
МОБ – минимальная остаточная болезнь
МПИ – международный прогностический индекс
ОВ – общая выживаемость
ОР – отношение рисков
УЗИ – ультразвуковое исследование
ХЛЛ –хронический лимфоцитарный лейкоз
Chl-G – режим иммунохимиотерапии, включающий обинутузумаб** и хлорамбуцил** (схемы режимов лечения см. в приложении А3.3)
Chl-R – режим иммунохимиотерапии, включающий ритуксимаб** и хлорамбуцил** (схемы режимов лечения см. в приложении А3.3)
CTC – общие критерии токсичности
FCR – режим иммунохимиотерапии, включающий ритуксимаб**, флударабин** и циклофосфамид** (схемы режимов лечения см. в приложении А3.3)
FCR-Lite – режим иммунохимиотерапии, включающий ритуксимаб**, флударабин** и циклофосфамид** с редукцией доз цитостатических препаратов (схемы режимов лечения см. в приложении А3.3)
FISH – флуоресцентная гибридизаация in situ
IGHV – вариабельные участки тяжелых цепей иммуноглобулинов
IWCLL – Международная рабочая группа по изучению хронического лимфоцитарного лейкоза
RB – режим иммунохимиотерапии, включающий ритуксимаб** и бендамустин (схемы режимов лечения см. в приложении А3.3)
R-CD – режим иммунохимиотерапии, включающий ритуксимаб**, циклофосфамид** и дексаметазон** (схемы режимов лечения см. в приложении А3.3)
R-FCM – режим иммунохимиотерапии, включающий ритуксимаб**, флударабин**, циклофосфамид** и митоксантрон** (схемы режимов лечения см. в приложении А3.3)
R-HDMP – режим иммунохимиотерапии, включающий ритуксимаб** и метилпреднизолон** (схемы режимов лечения см. в приложении А3.3)Термины и определения
ECOG – оценка общего состояния пациента по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) (см. приложение Г1).
В-симптомы – неспецифические симптомы опухолевой интоксикации, включающие лихорадку (температуру тела выше 38°С) более 2 нед. подряд без признаков воспаления, ночные профузные поты, похудание на 10 % массы тела за последние 6 мес.
Лимфома из малых лимфоцитов – это В-клеточная опухоль из малых В-лимфоцитов с иммунофенотипом хронического лимфоцитарного лейкоза, характеризующаяся наличием лимфаденопатии и/или спленомегалии с содержанием В-лимфоцитов в периферической крови ≤5 × 10 9 /л без морфологических признаков поражения костного мозга.
Синдром Рихтера – появление крупноклеточной лимфомы на фоне хронического лимфоцитарного лейкоза.
Ходжкинская трансформация – появление лимфомы Ходжкина на фоне хронического лимфоцитарного лейкоза.
Хронический лимфоцитарный лейкоз – это опухоль из малых В-лимфоцитов, характеризующаяся пролиферацией и накоплением аберрантных лимфоидных клеток в костном мозге, крови, лимфоидных тканях; критерием постановки диагноза является обнаружение абсолютного В-клеточного лимфоцитоза в крови (>5 × 10 9 /л моноклональных В-лимфоцитов). Хронический лимфоцитарный лейкоз и лимфома из малых лимфоцитов представляют собой различные проявления одного и того же заболевания.
Трансформация – развитие диффузной В-клеточной крупноклеточной лимфомы или лимфомы Ходжкина на фоне хронического лимфоцитарного лейкоза или лимфомы из малых лимфоцитов.Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
- в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
- в соответствии с порядком оказания помощи по профилю «гематология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
- на основе настоящих клинических рекомендаций;
- с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-гематологом и иными врачами-специалистами в центре амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/онкологическом кабинете, первичном гематологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у пациента ХЛЛ/ЛМЛ или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический кабинет, первичное гематологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Врач-гематолог амбулаторного или стационарного звена гематологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая распространенность и стадию заболевания.
В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь пациентам с гематологическими заболеваниями для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении ХЛЛ/ЛМЛ или подозрении на него в ходе оказания скорой медицинской помощи пациента переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с гематологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-гематологами в медицинских организациях, оказывающих медицинскую помощь пациентам с ХЛЛ/ЛМЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает профилактику, диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь пациентам с ХЛЛ/ЛМЛ, тактика медицинского обследования и лечения устанавливается врачами-гематологами с привлечением при необходимости других врачей-специалистов, при необходимости – с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «гематология», определяются врачом-гематологом/консилиумом врачей с привлечением при необходимости других врачей-специалистов.Показания к экстренной госпитализации:
1. Развитие тяжелой инфекции (необязательна госпитализация в гематологический стационар).
2. Развитие угрожающих жизни цитопений (глубокой анемии, геморрагического синдрома, нейтропении).
3. Развитие осложнений ХЛЛ, включая синдром Рихтера, симптоматическую лимфаденопатию и органомегалию с риском развития тяжелых осложнений, нейролейкемию, специфический плеврит и хилоторакс с признаками дыхательной недостаточности, паранеопластические и аутоиммунные синдромы, другие осложнения, угрожающие жизни.
4. Развитие осложнений терапии, включая синдром лизиса опухоли, тяжелые инфузионные реакции, миелотоксический агранулоцитоз с лихорадкой и другие осложнения, угрожающие жизни.Показания к плановой госпитализации:
1. Проведение терапии в случаях, требующих круглосуточного наблюдения за пациентом по причине тяжести состояния, обусловленного опухолью, или по причине риска осложнений, связанных с программой лечения или сопутствующими заболеваниями.
2. Обследование пациента, включающее биопсию и инвазивные вмешательства, в случаях, когда оно не может быть проведено амбулаторно.Показания к выписке пациента из медицинской организации:
- Завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
- Отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь, при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях.
- Необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
- Решение врачебной комиссии об отсутствии показаний к пребыванию пациента в стационаре в связи с бесперспективностью лечения и необходимостью оказания только паллиативной помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию составляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами специалистами медицинской организации, в которую планируется перевод.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Стадирование лимфомы из малых лимфоцитов
Стадирование ЛМЛ осуществляется по результатам обследования в соответствии с критериями классификации Ann Arbor (табл. Г1.1) [13].
Таблица 7.1. Стадирование лимфом по Ann Arbor, модификация Cotswold
- Поражение одной лимфатической зоны или структуры[1]
- Поражение 2 или более лимфатических зон по одну сторону диафрагмы;
- локализованное в пределах 1 сегмента поражение
1 экстралимфатического органа или ткани и его регионарных лимфатических узлов с поражением или без поражения других лимфатических областей по ту же сторону диафрагмы
- Поражение лимфатических узлов или структур по обе стороны диафрагмы;
- локализованное в пределах 1 сегмента поражение
1 экстралимфатического органа или ткани и его регионарных лимфатических узлов с поражением других лимфатических областей по обе стороны диафрагмы
- Диссеминированное (многофокусное) поражение 1 или нескольких экстралимфатических органов с поражением или без поражения лимфатических узлов;
- изолированное поражение экстралимфатического органа
с поражением отдаленных (не регионарных) лимфатических узлов; - поражение печени и/или костного мозга
- Отсутствие признаков В-стадии
- температура тела выше 38°С не менее 3 дней подряд без признаков воспаления;
- ночные профузные поты;
- похудание на 10 % массы тела за последние 6 мес.
- локализованное поражение 1 экстралимфатического органа или ткани в пределах 1 сегмента без поражения лимфатических узлов;
- стадия I или II с ограниченным экстранодальным вовлечением прилежащего органа или ткани
Общая выживаемость пациентов в группах по МПИ
Таблица 7.2. Общая выживаемость пациентов в группах по МПИ
Группа риска Балл Число пациентов, абс. (%) 5-летняя ОВ, % Низкая 0–1 340 (29) 93,2 Промежуточная 2–3 464 (39) 79,4 Высокая 4–6 326 (27) 63,6 Очень высокая 7–10 62 (5) 23,3 Оценка ответа на лечение при ХЛЛ
Оценка ответа на лечение проводится в соответствии с обновленными критериями, предложенными Международной рабочей группой по ХЛЛ (IWCLL) в 2018 г. (табл. Г4.1) [12].
Таблица 7.3. Оценка ответа на лечение при хроническом лимфоцитарном лейкозе
Показатель Полная ремиссия Частичная ремиссия Прогрессия А. Параметры, характеризующие массу опухоли Лимфаденопатия отсутствие узлов >1,5 см Уменьшение ≥50 % Увеличение ≥50 % Гепатомегалия Нет Уменьшение ≥50 % Увеличение ≥50 % Спленомегалия Кранио-каудальный размер селезенки Уменьшение ≥50 % от величины, на которую увеличена исходно Увеличение ≥50 % Лимфоциты крови Уменьшение ≥50 % от исходного уровня Увеличение ≥50 % от исходного уровня Костный мозг Нормоклеточный, Уменьшение инфильтрации костного мозга
на 50 %– Конституциональные симптомы Нет Любые Любые А. Параметры, характеризующие функцию костного мозга Тромбоциты >100 × 10 9 /л > 100 × 10 9 /л или повышение ≥50 %
от исходногоСнижение ≥50 %
от исходного по причине ХЛЛГемоглобин >110 г/л
(без трансфузий и эритропоэтинов)>110 г/л или повышение ≥50 %
от исходногоСнижение ≥20 г/л от исходного по причине ХЛЛ Нейтрофилы >1,5 × 10 9 /л >1,5 × 10 9 /л или
повышение >50 % от исходного– Стабилизация заболевания устанавливается в ситуациях, не удовлетворяющих критериям ни частичной ремиссии, ни прогрессии.
Критерии оценки качества медицинской помощи
№ Критерии качества Оценка выполнения 1 Пациенту с подозрением на ХЛЛ/ЛМЛ или выявленным ХЛЛ/ЛМЛ при первичном или повторном приеме, при оценке ремиссии через 2 мес. после завершения терапии, при контрольных обследованиях и при подозрении на рецидив заболевания выполнен развернутый клинический анализ крови с определением уровня гемоглобина, эритроцитов, тромбоцитов, лейкоцитов, подсчетом лейкоцитарной формулы и количества ретикулоцитов Да/Нет 2 Пациенту с подозрением на ХЛЛ с количеством
В-лейкоцитов ≥5000 в 1 мкл выполнено иммунофенотипическое исследование лимфоцитов крови методом проточной цитофлуориметрииДа/Нет 3 Пациенту с подозрением на ЛМЛ без клинического лимфоцитоза в крови либо пациенту с подозрением
на трансформацию выполнена биопсия лимфатического узла (очага поражения)Да/Нет 4 У первичного пациента с ХЛЛ/ЛМЛ с подозрением
на трансформацию получен гистологический препарат костного мозга (выполнена трепанобиопсия костного мозга)Да/Нет 5 Первичному пациенту при установке диагноза ХЛЛ/ЛМЛ либо пациенту с верифицированным ХЛЛ/ЛМЛ перед началом терапии, при оценке ремиссии через 2 мес. после завершения терапии, а также при подозрении на рецидив заболевания выполнена КТ грудной клетки, органов брюшной полости и малого таза (с контрастированием) или рентгенография органов грудной клетки
в 2 проекциях и УЗИ лимфатических узлов и внутренних органовДа/Нет 6 У пациента с ХЛЛ/ЛМЛ, получающего терапию ограниченной длительности, выполнена оценка терапии по критериям IWCLL 2018 не менее чем через 2 мес. после окончания терапии Да/Нет 7 У пациента с ХЛЛ/ЛМЛ, получающего непрерывную
или поддерживающую терапию, выполнена оценка терапии по критериям IWCLL 2018 не менее чем через
2 мес. после достижения максимального ответаДа/Нет [1] К лимфатическим структурам относят лимфатические узлы, селезенку, вилочковую железу, кольцо Вальдейера, червеобразный отросток, пейеровы бляшки.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Бялик Татьяна Евгеньевна, к.м.н., врач-онкогематолог, ассистент кафедры онкологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России.
- Зарицкий Андрей Юрьевич, д.м.н., профессор, директор Института гематологии ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России.
- Исебер Лоик, профессор, гематолог, Онкологический центр Тулузы, Франция.
- Капланов Камиль Даниялович, к.м.н., заведующий гематологическим отделением Волгоградского областного клинического онкологического диспансера, ассистент кафедры онкологии с курсом онкологии и гематологии ФУВ ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России, главный внештатный гематолог Комитета по здравоохранению Администрации Волгоградской области, член Российского общества онкогематологов, член Национального гематологического общества.
- Лопаткина Татьяна Николаевна, к.м.н., врач-терапевт, гастроэнтеролог, доцент кафедры терапии, профессиональных болезней и пульмонологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России.
- Луговская Светлана Алексеевна, д.м.н., профессор кафедры клинической лабораторной диагностики ГБОУ ДПО РМАНПО Минздрава России, член Национального гематологического общества.
- Мухортова Ольга Валентиновна, д.м.н., врач-радилог высшей категории, старший научный сотрудник отдела ядерной диагностики (ПЭТ-центра) на базе ФГБУ «НМИЦ сердечно-сосудистой хирургии им. А.Н. Бакулева» Минздрава России.
- Никитин Евгений Александрович, д.м.н., профессор, заведующий дневным стационаром гематологии, онкологии и химиотерапии городского гематологического центра ГБУЗ «ГКБ им. С.П. Боткина ДЗ г. Москвы», член правления Российского общества онкогематологов, член правления Национального гематологического общества.
- Османов Евгений Александрович, д.м.н., профессор, зав. отделом гематологии и трансплантации костного мозга ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры онкологии ФГАОУ ВО Первый МГМУ имени И.М. Сеченова Минздрава Росси, член правления Национального гематологического общества.
- Поддубная Ирина Владимировна, академик РАН, заслуженный деятель образования РФ, д.м.н., профессор, зав. кафедрой онкологии и паллиативной медицины, проректор по лечебной работе и международному сотрудничеству ГБОУ ДПО РМАНПО Минздрава России, председатель Российского общества онкогематологов.
- Самойлова Ольга Сергеевна, к.м.н., врач-гематолог, заведующая гематологическим отделением Нижегородской областной клинической больницы им. Н.А. Семашко, главный внештатный гематолог Приволжского федерального округа, член Российского общества онкогематологов, член Национального гематологического общества.
- Стадник Елена Александровна, к.м.н., доцент кафедры факультетской терапии ФГБОУ ВО «ПСПбГМУ им. И.П. Павлова» Минздрава России, старший научный сотрудник ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России, член Российского общества онкогематологов.
- Фалалеева Наталья Александровна – д.м.н., зав. отделением противоопухолевого лекарственного лечения МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Ассоциации онкологов России и Российской Ассоциации терапевтических радиационных онкологов.
- Байков Вадим Валентинович – д.м.н., профессор кафедры патологической анатомии, заведующий лабораторией патоморфологии НИИ детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
- Ковригина Алла Михайловна – д.б.н., профессор кафедры патологической анатомии, цитологии и молекулярной патологии Института повышения квалификации ФМБА РФ, заведующая патологоанатомическим отделением «НМИЦ гематологии» Минздрава России, член президиума Российского общества патологоанатомов, член правления Российского общества онкогематологов.
- Невольских Алексей Алексеевич – д.м.н., заместитель директора по лечебной МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России.
- Иванов Сергей Анатольевич – профессор РАН, д.м.н., директор МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России.
- Хайлова Жанна Владимировна – кандидат медицинских наук, заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России.
- Геворкян Тигран Гагикович — заместитель директора НИИ КЭР ФГБУ НМИЦ Онкологии им. Н.Н. Блохина
Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- врачи-гематологи;
- врачи-онкологи;
- студенты медицинских вузов.
Методология сбора доказательств
Методы, использованные для сбора / селекции доказательств: поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором >0,3.Поиск в электронных базах данных.
Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных PubMed и MEDLINE. Глубина поиска составляла 30 лет.Методы, использованные для анализа доказательств:
- обзоры опубликованных метаанализов;
- систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
- консенсус экспертов;
- оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А1–А3).
В настоящих клинических рекомендациях приведены уровни достоверности доказательств и уровни убедительности рекомендаций в соответствии рекомендациями по разработке и актуализации клинических рекомендаций (приказ Минздрава России от 28.02.2019 г. № 103н).
Таблица А1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД Расшифровка 1 Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа 2 Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа 3 Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования 4 Несравнительные исследования, описание клинического случая 5 Имеется лишь обоснование механизма действия или мнение экспертов Таблица А2. Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД Расшифровка 1 Систематический обзор РКИ с применением метаанализа 2 Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа 3 Нерандомизированные сравнительные исследования, в том числе когортные исследования 4 Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» 5 Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов Таблица А3. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР Расшифровка A Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) B Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) C Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) Методология валидизации рекомендаций
Методы валидизации:
• внешняя экспертная оценка;
• внутренняя экспертная оценка.Описание методики валидизации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, насколько качественно интерпретированы доказательства и разработаны рекомендации. Также была проведена экспертная оценка изложения рекомендаций и их доступности для понимания.
Рекомендации обсуждены и одобрены ведущими специалистами профильных федеральных центров РФ и практическими врачами. Проект клинических рекомендаций был рассмотрен на совещаниях рабочей группы в 2017–2018 гг., на форуме экспертов по вопросам диагностики и лечения злокачественных лимфопролиферативных заболеваний «Лимфорум», ежегодной российской конференции с международным участием «Злокачественные лимфомы», а также в рамках IV Конгресса гематологов России.Порядок обновления клинических рекомендаций
Актуализация проводится не реже чем 1 раз в 3 года или при появлении новой информации о диагностике и тактике ведения пациентов, страдающих ХЛЛ/ЛМЛ, но не чаще 1 раза в 6 месяцев. Решение об обновлении принимает Минздрав России на основе предложений медицинских профессиональных некоммерческих организаций. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
Приложение А3.1. Значение маркеров вируса гепатита В при ХЛЛ
Клетки ХЛЛ могут быть дополнительным резервуаром для вируса гепатита В. Латентная инфекция, вызванная HBV, выявляется у пациентов с ХЛЛ чаще. Значение маркеров HBV-инфекции и предполагаемые действия представлены в табл. 3.1.
Таблица А3.1. Значение маркеров вирусного гепатита B
Расшифровка HBs-Ag Анти-HBc Анти-HBs ДНК HBV Действия Не контактировал с HBV – – – – Провести вакцинацию.
Противопоказаний
к анти-CD20 нетВакцинация проведена – – + – Противопоказаний
к анти-CD20 нетРеконвалесцент – + + – Противопоказаний
к анти-CD20 нетВозможное латентное носительство HBV – + – +/- Контроль ДНК HBV каждые 2 мес. во время терапии анти-CD20, назначение противовирусной терапии при появлении HBsAg или ДНК HBV Неактивное носительство HBsAg + ± – ± Назначение противовирусных препаратов во время терапии анти-CD20+ + год после окончания Хронический гепатит B + * * ± Отказаться от анти-CD20 или противовирусная терапия до терапии, весь период лечения + 1 год после окончания* * При необходимости назначения анти-CD20 показан постоянный прием энтекавира** 0,5 мг/сут. Энтекавир** назначают на весь период лечения/поддерживающей терапии и не менее 1 года после завершения иммуносупрессивной терапии при неоднократных отрицательных результатах тестирования на ДНК вируса гепатита B в крови. Оптимальная продолжительность терапии энтекавиром** после завершения терапии ритуксимабом** не определена. Если пациенту с ХЛЛ специфическая терапия не показана, в профилактическом назначении энтекавира** нет необходимости. Ламивудин не должен применяться у пациентов с ХЛЛ, поскольку речь всегда идет о длительном приеме противовирусных препаратов. К концу 2-го года приема ламивудина к этому препарату устойчиво более 40 % штаммов HBV, к концу 4-го года приема – 70 % штаммов HBV. При развитии устойчивости к энтекавиру** показан переход на тенофовир**.
Приложение А3.2. Показания к началу лечения ХЛЛ/ЛМЛ
Терапия ХЛЛ/ЛМЛ должна начинаться при наличии как минимум 1 из следующих показаний по критериям IWCLL 2018 [12]:
- Стадия С по J.L. Binet.
- Один или более симптомов интоксикации:
- потеря >10 % массы тела за 6 мес. (если пациент не принимал меры для похудания);
- слабость (общее состояние по ECOG ≥2, нетрудоспособность);
- субфебрильная лихорадка в течение ≥2 нед. без признаков инфекции;
- ночные поты, сохраняющиеся более 1 мес., без признаков инфекции.
- Нарастающая анемия и/или тромбоцитопения, обусловленная инфильтрацией костного мозга.
- Аутоиммунная анемия и/или тромбоцитопения, резистентная к преднизолону.
- Большие размеры селезенки (>6 см ниже реберной дуги), явное увеличение органа.
- Массивная (≥10 см в максимальном диаметре) и/или нарастающая лимфаденопатия.
- Время удвоения числа лимфоцитов менее 6 мес.
- Экстранодальное поражение, симптомное или влияющее на функцию пораженного органа.
Приложение А3.3. Режимы лекарственного лечения ХЛЛ
Монотерапия
Монотерапия хлорамбуцилом** – курсовой формат- Хлорамбуцил** – 10 мг/м 2 внутрь в 1–7-й дни.
Лечение возобновляется на 29-й день.
Монотерапия хлорамбуцилом** – постоянный формат
- Хлорамбуцил** – 0,07–0,20 мг/кг внутрь ежедневно в течение 2–4 нед. с последующим подбором дозы.
Монотерапия #бендамустином**
- #Бендамустин** – 90 мг/м 2 в/в в 1-й, 2-й дни.
Лечение возобновляется на 29-й день.
Монотерапия ибрутинибом**
- Ибрутиниб** – 420 мг/сут (3 капсулы) внутрь 1 раз в день до прогрессирования или развития непереносимой токсичности.
Монотерапия венетоклаксом
- Венетоклакс – 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), до прогрессирования или развития непереносимой токсичности.
Полихимиотерапия
FCR внутривенный- Ритуксимаб** – 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1.
- #Флударабин** – 25 мг/м 2 в/в кап., дни 1–3.
- #Циклофосфамид** – 250 мг/м 2 в/в кап., дни 1–3.
Лечение возобновляется на 29-й день.
FCR пероральный
- Ритуксимаб** – 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1.
- #Флударабин** – 40 мг/м 2 внутрь, дни 1–3.
- #Циклофосфамид** – 250 мг/м 2 внутрь, дни 1–3.
Лечение возобновляется на 29-й день.
FCR—Lite
- Ритуксимаб** – 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, дни 1, 5.
- #Флударабин** – 20 мг/м 2 внутрь, дни 1–3.
- #Циклофосфамид** – 150 мг/м 2 внутрь, дни 1–3.
Лечение возобновляется на 29-й день.
RB
- Ритуксимаб** – 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1.
- #Бендамустин** – 90 мг/м 2 в/в кап., дни 1, 2.
Лечение возобновляется на 29-й день.
Chl—R
- Ритуксимаб** – 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1.
- Хлорамбуцил** – 10 мг/м 2 внутрь, дни 1–7.
Лечение возобновляется на 29-й день.
Chl—G
- Обинутузумаб** – 1000 мг в/в, день 1 (100 мг в течение 4 часов), 2 (900 мг), 8, 15 (цикл 1), день 1 (циклы 2–6).
- Хлорамбуцил** – 0,5 мг/кг внутрь, дни 1, 15.
Лечение возобновляется на 29-й день.
R—HDMP
- #Ритуксимаб** – 375 мг/м 2 в/в кап., дни 1, 8, 15, 22.
- Метилпреднизолон** – 1 г/м 2 в/в кап., дни 1–3.
Лечение возобновляется на 29-й день.
Проводят 3 курса.R—CD
- Ритуксимаб** – 1 цикл: 375 мг/м 2 в/в кап., день 1, последующие циклы: 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1.
- Циклофосфамид** – 750 мг/м 2 в/в кап., день 1.
- Дексаметазон** – 12 мг в/в или внутрь, дни 1–7.
Лечение возобновляется на 29-й день.
Ибрутиниб** + ритуксимаб**
- Ибрутиниб** – 420 мг/сут (3 капсулы) внутрь 1 раз в день, ежедневно.
- #Ритуксимаб** – 50 мг/м 2 в/в кап., день 1 цикла 2; 375 мг/м 2 в/в кап., день 2 цикла 2; 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1 циклов 3–7.
Лечение возобновляется на 29-й день, всего 7 циклов.
Ибрутиниб** + BR
- Ибрутиниб** – 420 мг/сут (3 капсулы) внутрь 1 раз в день ежедневно в течение всего курса и далее (после завершения циклов BR) – до прогрессирования или развития неприемлемой токсичности.
- #Бендамустин** – 90 мг/м 2 в/в кап., дни 2–3 цикла 1; дни 1, 2 циклов 2–6.
- Ритуксимаб** – 375 мг/м 2 в/в кап., день 1 цикла 1; 500 мг/м 2 в/в кап. или 1400 мг п/к, день 1 циклов 2–6.
Лечение возобновляется на 29-й день., всего 6 циклов.
Венетоклакс + ритуксимаб**
- Венетоклакс – 20 мг/сут (нед. 1), 50 мг/сут (нед. 2), 100 мг/сут (нед. 3), 200 мг/сут (нед. 4), 400 мг/сут (нед. 5 и далее), прием в течение 24 мес. начиная с 1-го дня 1-го цикла лечения ритуксимабом**.
- Ритуксимаб** – 375 мг/м 2 в/в кап. через 1 нед. после достижения дозы венетоклакса 400 мг/сут, далее – 500 мг/м 2 в/в кап. или 1400 мг п/к ежемесячно, всего 6 введений.
Венетоклакс + обинутузумаб**
- Обинутузумаб** – 100 мг, день 1 цикла 1; 900 мг день 2 цикла 1; 1000 мг день 8 цикла 1; 1000 мг день 15 цикла 1; 1000 мг день 1 цикла 2; 1000 мг день 1 циклов 3–6.
- #Венетоклакс – 20 мг/сут, дни 22–28 цикла 1; 50 мг/сут дни 1–7 цикла 2; 100 мг/сут дни 8–14 цикла 2; 200 мг/сут дни 15–21 цикла 2; 400 мг/сут дни 22–28 цикла 2, далее 400 мг/сут в течение 12 мес.
Приложение Б. Алгоритмы действий врача

Приложение Б1. Алгоритм выбора первой линии терапии пациента с ХЛЛ/ЛМЛ
* Монотерапия венетоклаксом показана пациентам, которым не может быть назначен ибрутиниб.

Приложение Б2. Алгоритм выбора терапии рецидива ХЛЛ/ЛМЛ
Приложение В. Информация для пациентов
Хронический лимфоцитарный лейкоз (ХЛЛ) представляет собой онкологическое заболевание, поражающее клетки крови и костного мозга. При хроническом ХЛЛ костный мозг вырабатывает патологически измененные, не способные выполнять свои функции лимфоциты. Они накапливаются в крови и различных органах и вытесняют нормальные клетки крови. Слово «хронический» в названии указывает, что это заболевание протекает доброкачественно.
Лимфомой из малых лимфоцитов (ЛМЛ) называется особое проявление хронического ХЛЛ, при котором патологические лимфоциты накапливаются не в крови или костном мозге, а в лимфатических узлах.Еще 10 лет назад считалось, что ХЛЛ/ЛМЛ заболевают в основном пожилые люди. Однако по мере улучшения диагностики оказалось, что это заболевание может возникать и у молодых людей (40–50 лет), причем в этом возрасте оно протекает менее благоприятно.
Врач может заподозрить ХЛЛ/ЛМЛ, опираясь на Ваши жалобы и обнаружив соответствующие симптомы при осмотре. В этом случае будет необходимо пройти ряд обследований, включая анализ крови и костного мозга. При ХЛЛ самый важный анализ – это анализ крови, без него диагноз не ставится. В анализе крови выявляется увеличение числа лимфоцитов. Диагноз обязательно подтверждается специальным исследованием – иммунофенотипированием лимфоцитов. Могут понадобиться и другие уточняющие диагноз исследования. При ЛМЛ диагноз ставится по результатам гистологического и иммуногистохимического исследования пораженного лимфатического узла.К сожалению, на сегодняшний день ХЛЛ/ЛМЛ неизлечим. Однако у некоторых пациентов необходимость в лечении не возникает никогда – ХЛЛ/ЛМЛ может оставаться в стабильном состоянии в течение многих лет и даже десятилетий. Было проведено много исследований, в которых сравнивалось выжидательное наблюдение и раннее начало терапии (сразу после установления диагноза). Оказалось, что лечение на ранних этапах никакого преимущества не дает, но вызывает токсические эффекты. Поэтому тактика ведения ХЛЛ/ЛМЛ выстраивается с учетом течения этой болезни – лечение применяют по мере необходимости, поскольку оно само по себе небезопасно, и тактика выжидательного наблюдения остается стандартом для многих пациентов.
Если имеются четкие признаки прогрессирования заболевания – устойчивый рост лимфоцитоза, увеличение лимфатических узлов, селезенки, появление анемии и тромбоцитопении, врач предложит определенный курс лечения.Выбирая лечение, доктор учитывает:
• состояние болезни (клиническую картину и прогностические факторы);
• состояние пациента (возраст, сопутствующие заболевания);
• какое лечение проводилось раньше и когда наступил рецидив.
В результате у большинства пациентов заболевание удается эффективно контролировать современными лекарствами.Приложение Г. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки общего состояния пациента ECOG
Клиническая оценка общего состояния пациента с ХЛЛ/ЛМЛ проводится по шкале, разработанной Восточной объединенной онкологической группой (Eastern Cooperative Oncology Group) [65].
Оригинальное название: The ECOG Scale of Performance StatusИсточник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. 1982. Vol. 5, № 6. P. 649–65 [65]
Тип: шкала оценки
Назначение: клиническая оценка общего состояния пациента
Содержание и интерпретация:
Статус (баллы) Описание общего состояния пациента 0 Пациент полностью активен, способен выполнять все, как и до заболевания 1 Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) 2 Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно – в вертикальном положении. 3 Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования 4 Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели 5 Смерть Приложение Г2. Шкала оценки коморбидности CIRS
Клиническая оценка коморбидности пациента с ХЛЛ/ЛМЛ может проводиться по Кумуляционной шкале коморбидности [66].
Оригинальное название: Cumulative Illness Rating ScaleИсточник: Linn, B. et al. Cumulative Illness Rating Scale. Journal of the American Geriatrics Society [66].
Тип: шкала оценки
Назначение: клиническая оценка коморбидности
Содержание и интерпретация:
Баллы 0 1 2 3 4 Болезни сердца Болезни сосудов (кровеносных и лимфатических) Болезни крови (костного мозга, селезенки и периферической крови Болезни органов дыхательной системы (трахеи, бронхов и легких) Болезни органов чувств (глаз, носа, ушей, глотки и гортани) Болезни органов верхних отделов пищеварительной системы (пищевода, желудка, двенадцатиперстной кишки, поджелудочной железы (не включая СД) и желчного пузыря) Болезни органов нижних отделов пищеварительной системы (тонкого и толстого кишечника) Болезни печени Болезни почек Болезни органов мочеполовой системы (мочеточников, мочевого пузыря, мочеиспускательного канала, предстательной железы и половых органов) Болезни органов опорно-двигательной системы (мышц, суставов, костей) и кожных покровов Болезни органов центральной и периферической нервной системы (головного мозга, спинного мозга и нервов) Болезни органов эндокринной системы и нарушения метаболизма (включая сахарный диабет) Психические нарушения Сумма баллов Оценка органов и систем:
0 баллов: отсутствие заболеваний в этой системе органов или наличие патологии, которая не мешает нормальной жизнедеятельности, не влияет на прогноз и не требует лечения.
1 балл: лёгкие отклонения от нормы или перенесенные в прошлом заболевания.
2 балла: заболевание, при котором необходимо назначение медикаментозной терапии.
3 балла: заболевание, ставшее причиной инвалидности.
4 балла: жизнеугрожающее заболевание, требующее проведения неотложной терапии.Источник https://www.euroonco.ru/onkogematologiya/hronicheskij-limfolejkoz
Источник https://lapino2.ru/napravleniya/onkogematologiya/khronicheskiy-limfoleykoz/
Источник https://diseases.medelement.com/disease/%D1%85%D1%80%D0%BE%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9-%D0%BB%D0%B8%D0%BC%D1%84%D0%BE%D0%BB%D0%B5%D0%B9%D0%BA%D0%BE%D0%B7-%D0%BB%D0%B8%D0%BC%D1%84%D0%BE%D0%BC%D0%B0-%D0%B8%D0%B7-%D0%BC%D0%B0%D0%BB%D1%8B%D1%85-%D0%BB%D0%B8%D0%BC%D1%84%D0%BE%D1%86%D0%B8%D1%82%D0%BE%D0%B2-%D0%BA%D1%80-%D1%80%D1%84-2020/16519