Клинические особенности течения подострого тиреоидита и современные методы его лечения
Несмотря на значительные достижения в области тиреоидологии, на протяжении последних лет отмечается неуклонный рост числа больных, страдающих различными заболеваниями щитовидной железы (ЩЖ), в том числе подострым тиреоидитом (ПТ). Распространенность подострого тиреоидита в общей популяции, по оценкам различных авторов, варьирует в широких пределах и составляет от 1 до 15 % [1]. По данным T.F. Nikolai (1991), 1 случай подострого тиреоидита приходится на 5 случаев диффузного токсического зоба или 15–20 случаев аутоиммунного тиреоидита (АИТ). Среди всех обращений больных по поводу различных заболеваний ЩЖ около 5% приходится на пациентов, страдающих подострым тиреоидитом.
Анализ накопленных данных свидетельствует о наличии ряда нерешенных задач в отношении ведения больных с подострым тиреоидитом. Имеются сведения о тяжелых, рецидивирующих формах заболевания, а также формах со стертой клинической картиной, которые в 0,3–1,7 % случаев являются причиной ошибочной резекции ЩЖ [2].
До настоящего времени основным методом лечения подострого тиреоидита остается использование синтетических аналогов глюкокортикоидных гормонов. Препараты этой группы обладают выраженным противовоспалительным действием, быстро купируют боль и явления интоксикации. Их противовоспалительный эффект проявляется в стабилизации биологических мембран, подавлении активности фибробластов и синтеза цитокинов, уменьшении проницаемости капилляров [3].
Некоторыми исследователями показано, что подобная терапия не предотвращает развития дисфункции ЩЖ, и у 5–15 % больных может развиваться гипотиреоз, что связано с развитием соединительной ткани в очаге воспаления. У 8–9 % больных, чаще при рецидивирующей форме подострого тиреоидита, транзиторный гипотиреоз трансформируется в постоянный, требующий проведения заместительной терапии [4].
По мнению большинства авторов, больные с легкой формой заболевания должны использовать только нестероидные противовоспалительные препараты, а синтетические аналоги глюкокортикоидных гормонов более эффективны для устранения болевого синдрома и лихорадки при более тяжелом течении подострого тиреоидита [5].
В связи с тем что подострый тиреоидит склонен к рецидивированию и длительность применения синтетических аналогов глюкокортикоидных гормонов может существенно увеличиваться, вследствие чего могут возникать побочные явления, до сих пор продолжается поиск других методов лечения.
В последние годы для лечения подострого тиреоидита все более широкое распространение получают методы местного воздействия, способствующие более быстрому купированию воспалительного процесса в ЩЖ. В работах некоторых авторов показана высокая биологическая активность низкоэнергетического лазерного излучения, в основе терапевтических эффектов которого лежит трофикостимулирующее, противовоспалительное, десенсибилизирующее, болеутоляющее, противоотечное действие, а также стимуляция иммунитета и естественной резистентности организма, обменных и регенеративных процессов.
Цель работы — изучить клинические особенности течения подострого тиреоидита и провести сравнительный анализ различных методов его лечения в зависимости от тяжести заболевания.
Материалы и методы исследования
Для решения поставленных в работе задач были обследованы 120 больных подострым тиреоидитом (ПТ): 100 женщин и 20 мужчин в возрасте от 20 до 70 лет, средний возраст составил 43,7 ± 1,7 года. Диагноз верифицировался на основании данных клинического, гормонального и ультразвукового обследования больных.
У части пациентов были получены анамнестические данные, указывающие на наличие патологического процесса в ЩЖ в прошлом. У 2 человек в анамнезе имелось указание на перенесенный ПТ, у 1 пациента в анамнезе был узловой нетоксический зоб.
Отягощенная наследственность в отношении заболеваний ЩЖ имела место у 55 больных (45,8 %). У 50 пациентов (41,7 %) наследственность была отягощена по эутиреоидному зобу и АИТ. В 3 случаях в семье больных ПТ были обнаружены злокачественные заболевания ЩЖ, в 2 случаях выявлен диффузный токсический зоб (ДТЗ).
Тяжесть течения ПТ мы оценивали по следующим критериям. У больных с легким течением заболевания отмечались умеренные боли в одной из долей ЩЖ, незначительная слабость, повышение температуры тела до 37,0°С, увеличение скорости оседания эритроцитов (СОЭ) не более чем до 35 мм в час.
У больных со среднетяжелой формой ПТ наблюдались выраженные боли, чаще в одной из долей ЩЖ, с иррадиацией в ухо на стороне поражения, общая слабость, периодические артралгии и миалгии, повышение температуры тела до 38,0 °С, увеличение СОЭ до 50 мм в час.
При тяжелом течении ПТ больные предъявляли жалобы на интенсивные боли, чаще в обеих долях ЩЖ, с иррадиацией в нижнюю челюсть и уши. Боли усиливались при глотании, иногда наблюдалась дисфагия. Отмечались генерализованные миалгии и артралгии, выраженная слабость, увеличение СОЭ более 50 мм в час, повышение температуры тела выше 38,0 °С. У ряда больных выявлялись симптомы легкого тиреотоксикоза.
В зависимости от тяжести заболевания больные были разделены на 4 группы.
В 1-ю группу вошел 31 человек (3 мужчин и 28 женщин, средний возраст составил 43,70 ± 1,73 года) со средней и тяжелой формой заболевания. ПТ средней степени тяжести был у 14 пациентов (45,2 %), тяжелый ПТ — у 17 пациентов (54,8 %). 2 пациента с тяжелым течением заболевания страдали гипертонической болезнью 2-й ст., 2 больных — гиперацидным гастритом в стадии ремиссии, 1 больной — эрозивным гастритом в стадии ремиссии, 1 больной — хроническим гепатитом в неактивной стадии, 1 больной — бронхиальной астмой в фазе стойкой ремиссии, 2 больных — компенсированным сахарным диабетом (СД) 2-го типа. Наличие у пациентов данных сопутствующих заболеваний ограничивало назначение им синтетических аналогов глюкокортикоидных гормонов по традиционной схеме. 22 пациента 1-й группы не имели сопутствующей патологии.
2-ю группу составили 32 человека (9 мужчин и 23 женщины, средний возраст — 42,50 ± 1,26 года) с легкой степенью ПТ. У 4 больных имелся компенсированный сахарный диабет 2-го типа, у 3 пациентов — язвенная болезнь двенадцатиперстной кишки в стадии ремиссии, у 2 пациенток — постменопаузальный остеопороз. У 23 пациентов 2-й группы сопутствующей патологии не было.
У 26 человек (5 мужчин и 21 женщина в возрасте 47,8± 1,1 года) 3-й группы был ПТ средней степени тяжести. В эту группу включались лица без сопутствующей патологии.
4-ю группу составил 31 человек (3 мужчин и 28 женщин, средний возраст — 46,20 ± 1,49 года) со средней и тяжелой формой ПТ без сопутствующей патологии. Среднетяжелая форма ПТ была у 18 (57,7 %) пациентов, тяжелая форма заболевания — у 13 (42,3 %) пациентов.
Соотношение больных со средней и тяжелой степенью тяжести ПТ в 1-й и 4-й группах было сопоставимо.
Для лечения больных была использована методика, разработанная д.м.н., профессором Э.Г. Гаспарян (СПбМАПО), к.м.н., доцентом З.В. Крючковой (СПбМАПО), к.м.н. Аговым Б.С. (СПбГМА им.И.И.Мечникова), — «Способ лечения подострого тиреоидита» (патент № 2056871, 27.03.1996). Проводилось воздействие на патологический очаг в ЩЖ гелиево-неоновым лазером с плотностью мощности 0,25ватт, временем экспозиции 2–3 минуты, длиной шага 0,632нм. Длительность курса лечения во всех группах пациентов составила 20 дней. При необходимости проводились повторные курсы лечения.
Больным 1-й группы со среднетяжелым и тяжелым течением ПТ проводили лечение малыми дозами синтетических аналогов глюкокортикоидных гормонов (преднизолон по 10 мг в сутки) в сочетании с курсом ЛТ на область ЩЖ с последующим постепенным снижением дозы глюкокортикоидов до полной отмены.
Больные 2-й группы с легкой степенью тяжести ПТ получали 2 курса ЛТ на область ЩЖ по 20 процедур с 10-дневным перерывом.
У больных 3-й группы со средней степенью тяжести ПТ прием нестероидных противовоспалительных препаратов (индометацин по 75 мг в сутки) сочетали с курсом ЛТ на область ЩЖ.
Больным 4-й группы со среднетяжелым и тяжелым течением ПТ проводилось традиционное лечение с использованием синтетических аналогов глюкокортикоидных гормонов (преднизолон по 20–30 мг в сутки) с последующим постепенным снижением дозы глюкокортикоидов до полной отмены.
Всем больным проводили общеклиническое обследование, включающее в себя пальпацию ЩЖ (степень увеличения ЩЖ оценивалась по классификации ВОЗ, 1994г.), аускультацию сердца и сосудов, ультразвуковое исследование (УЗИ) ЩЖ в режиме реального времени при помощи датчика 7,5–10 мГц, определение в сыворотке крови натощак уровней трийодтиронина (Т3), тироксина (Т4), тиреотропного гормона (ТТГ), антител к тиреоглобулину (АТ-ТГ) до лечения, а также через 4 и 12 месяцев наблюдения.
Гормональные показатели системы гипофиз — ЩЖ сопоставляли со средними показателями контрольной группы. Контрольную группу составили здоровые лица (2 мужчин и 18 женщин, средний возраст — 41,2 ± 1,77 года) с неотягощенной наследственностью по заболеваниям ЩЖ.
Статистическая обработка данных осуществлялась с помощью программы Statistica 5.5 на персональном компьютере. Для сравнения показателей между группами использовался критерий Стьюдента. Сравнение частот качественных показателей между группами проводилось с помощью критерия c2. Сравнение количественных показателей в одной и той же группе в динамике осуществлялось с помощью критерия Вилкоксона.
Результаты исследования и их обсуждение
Средний возраст больных в группах статистически значимо не отличался.
У 55,8 % больных был продромальный период, который характеризовался генерализованными миалгиями, артралгиями, субфебрилитетом и слабостью после перенесенной вирусной или бактериальной инфекции. У 22,5% пациентов заболевание характеризовалось острым началом без продромального периода.
Болевой синдром наблюдался у всех больных, но выраженность и локализация боли в ЩЖ были различными. 77 пациентов (64,2 %) предъявляли жалобы на боли в области передней поверхности шеи, преимущественно с одной стороны, нередко с иррадиацией в нижнюю челюсть, в ухо на стороне поражения, 43 пациента (35,8 %) отмечали боли в области обеих долей ЩЖ с характерной иррадиацией, усиливающиеся при глотании, поворотах головы.
При пальпаторном обследовании у 89 больных (74,2%) определялась неровная, плотная, болезненная ЩЖ. У 31 человека (25,8 %) поверхность ЩЖ была неровная, плотная, с болезненными узлами без четких контуров. При пальпации у всех пациентов наблюдалось увеличение размеров ЩЖ. 99 пациентов (82,5 %) имели 2-ю степень зоба, 21 пациент (17,5 %) — 1-ю степень зоба.
Для уточнения характера патологических изменений в ЩЖ, выявленных при физикальном обследовании, использовалось УЗИ. Согласно международным нормативам, при использовании УЗИ у взрослых лиц мы диагностировали зоб, если объем железы у женщин превышал 18 мл, у мужчин — 25 мл. Средние значения объема ЩЖ в 4 группах больных не имели статистически значимых различий. В то же время средний объем ЩЖ у больных 4-й группы превышал аналогичный показатель у больных других групп. Средний объем ЩЖ в 4-й группе был 47,6±2,3 мл по сравнению с 44,44 ± 1,60 мл, 36,71±1,80мл и 41,03 ± 1,8 мл в 1, 2 и 3-й группах соответственно (p > 0,05 для всех сравнений).
По результатам УЗИ в исследуемой когорте больных у 71 пациента (59,2 %) были выявлены гипоэхогенные участки в ткани ЩЖ. Эхоструктура ткани железы не имела признаков, характерных для АИТ. При сравнении частоты выявления гипоэхогенных участков в ткани ЩЖ по группам больных статистически значимых различий обнаружено не было.
У всех обследованных больных с ПТ в начале заболевания наблюдалось повышение температуры тела до субфебрильных цифр, при этом у пациентов 2-й и 3-й групп показатели средней температуры тела были ниже, чем у пациентов 1-й и 4-й групп, хотя статистически значимых различий между группами мы не выявили.
Во всех группах обследованных больных с ПТ в начале заболевания отмечались умеренное увеличение частоты сердечных сокращений (ЧСС) и повышение систолического артериального давления (АД), однако значимых различий между группами не было получено.
Патогномоничным для ПТ является повышение скорости оседания эритроцитов до 50–60 мм в час при отсутствии лейкоцитоза. Нами выявлена диссоциация повышенной СОЭ и нормального содержания лейкоцитов у всех больных, при этом средние значения СОЭ у больных 1-й и 4-й групп превышали данный показатель у больных 2-й и 3-й групп.
По данным некоторых авторов, острая фаза ПТ приблизительно у 50 % больных сопровождается развитием деструктивного тиреотоксикоза, длительность которого составляет обычно 3–6 недель. В нашем исследовании частота тиреотоксикоза составила 15,8 % у больных 1-й и 4-й групп.

По данным разных исследователей, общая продолжительность лечения легкой формы ПТ с использованием нестероидных противовоспалительных препаратов (НПВП), а также тяжелой формы заболевания с применением синтетических аналогов глюкокортикоидных гормонов составляет в среднем 3 месяца.
По мнению большинства авторов, прогноз заболевания благоприятный и почти в 95 % случаев оно заканчивается полным выздоровлением. Гипотиреоз, требующий проведения заместительной терапии, развивается у 8–9% больных и чаще при рецидивирующей форме ПТ.
В нашем исследовании в результате проведенной терапии у пациентов всех групп ЩЖ уменьшилась в объеме, отмечалось исчезновение местных и общих признаков воспаления, клинических симптомов нарушения функции ЩЖ, в большинстве случаев нормализовалось АД. К концу курса лечения все больные находились в эутиреоидном состоянии.
Субъективное улучшение состояния у больных 1-й группы со среднетяжелой и тяжелой формой ПТ, получавших комбинированную терапию синтетическими аналогами глюкокортикоидов (преднизолон 10–12,5 мг в сутки) в сочетании с ЛТ на область ЩЖ, наблюдалось на 3-й день лечения. Болевой синдром полностью исчезал на 7–8-й день лечения. Через 5–7 дней наблюдалась нормализация СОЭ. Через 10–14 дней после начала лечения проводили постепенное снижение дозы преднизолона: первоначально по 2,5 мг, затем по 1,25 мг 1 раз в 5–7 дней до полной отмены. Продолжительность курса лечения составила 45–50 дней. У 29 пациентов (93,5 %) к концу курса терапии структура ЩЖ практически не отличалась от нормы. У 2 пациентов наблюдалось замедленное купирование болевого синдрома, что потребовало увеличения дозы преднизолона с 10 до 15 мг в сутки и дополнительного назначения 10 процедур ЛТ. После проведенного курса лечения у 2 пациентов отмечалось обострение хронического гастрита, потребовавшее назначения антацидных препаратов и Н2-гистаминоблокаторов.
Больные 2-й группы с легкой степенью тяжести ПТ получали курс ЛТ на область ЩЖ в виде монотерапии. На 5–6-й день лечения у 25 пациентов (78,1 %) отмечалась нормализация температуры тела, уменьшение болезненности ЩЖ при пальпации. На 10-й день лечения 30 пациентов (93,8 %) отмечали улучшение общего состояния, исчезновение боли в ЩЖ. Через 7–10 дней в клиническом анализе крови наблюдалась нормализация СОЭ. Продолжительность курса лечения составила 20 дней. Через 10 дней всем больным 2-й группы проводили повторный 20-дневный курс ЛТ на область ЩЖ. Побочных эффектов выявлено не было.
Больным 3-й группы со средней степенью тяжести ПТ проводилась ЛТ на область ЩЖ в сочетании с пероральным приемом нестероидных противовоспалительных препаратов (индометацин по 75 мг в сутки). У 20 больных (76,9 %) на 6-й день лечения наблюдалось улучшение общего самочувствия, уменьшение местных признаков воспаления. Полное исчезновение болевого синдрома произошло на 8–10-й день лечения. Через 7–10 дней в клиническом анализе крови наблюдалась нормализация СОЭ. Продолжительность курса лечения составила 45–50 дней. 6 пациентам 3-й группы из-за отсутствия положительного эффекта к концу первой недели лечения потребовалось отменить индометацин и назначить преднизолон в дозе 10 мг в сутки (с последующей его постепенной отменой) и дополнительно провести 10 сеансов ЛТ на область ЩЖ. После проведенного курса лечения отмечалась положительная динамика: устранение местных симптомов воспаления и улучшение общего состояния. Побочных эффектов не было.
Больным 4-й группы со среднетяжелым и тяжелым течением ПТ проводилось лечение преднизолоном по общепринятой методике. Средняя доза преднизолона составила 20–30 мг в сутки. Субъективное улучшение состояния пациентов наблюдалось на 2–3-й день лечения. Снижение температуры тела, уменьшение проявлений основных симптомов тиреотоксикоза наступало на 4–5-й день лечения. У всех пациентов этой группы болевой синдром полностью исчезал через 24–72 часа (тест Крайля), через 5–7 дней наблюдалась нормализация уровня СОЭ. Через 1–3 недели от начала лечения дозу преднизолона снижали на 5 мг, далее на 2,5 мг в неделю до полной отмены. Общая продолжительность курса лечения составила 70–95 дней. Побочных эффектов отмечено не было.
Следует отметить, что гелиево-неоновое лазерное облучение в комбинации с пероральным приемом синтетических аналогов глюкокортикоидных гормонов у больных со среднетяжелым и тяжелым течением ПТ позволило снизить дозу глюкокортикоидных гормонов, сократить сроки лечения, уменьшить количество побочных эффектов.
Рядом авторов показано, что наступившая под влиянием терапии эутиреоидная фаза заболевания продолжается несколько недель, у 30–50 % больных она трансформируется в стадию транзиторного гипотиреоза, постепенно переходящую в фазу эутиреоидного состояния. Фаза выздоровления обычно наступает значительно позже. Нормализация функциональных показателей ЩЖ, а также ее морфологической структуры, по данным УЗИ, наступает только к 4–6-му месяцу.
После завершения курса лечения клиническое наблюдение за больными проводили каждый месяц. Повторную оценку содержания периферических гормонов ЩЖ (Т3 и Т4), уровня ТТГ и АТ-ТГ в сыворотке крови, УЗИ ЩЖ проводили через 4 месяца и через 1 год после начала заболевания.
Через 4 месяца наблюдения у всех пациентов сохранялось эутиреоидное состояние. Общее количество пациентов, предъявляющих различные жалобы, составило 55 чел. (45,8 %). 9 пациентов (7,5 %) предъявляли жалобы на боли в области ЩЖ, что свидетельствовало о рецидиве ПТ. 12 пациентов (10 %) жаловались на периодические головные боли, у 19 пациентов (15,8 %) отмечалась прибавка веса, у 20 пациентов (16,7 %) — общая слабость. Это были преимущественно пациенты из 1-й и 4-й групп.
Во всех группах больных частота выявления гипоэхогенных участков в ткани ЩЖ была статистически значимо меньше (р < 0,001), чем до лечения. У больных 4-й группы частота выявления гипоэхогенной структуры ЩЖ была выше, чем у больных других групп.
Через 4 месяца наблюдения уровни Т3, Т4, ТТГ и АТ-ТГ в сыворотке крови нормализовались у всех пациентов. Статистически значимых изменений средних уровней этих показателей по сравнению с исходными не было выявлено.
У 14 больных (45,2 %) из 4-й группы наблюдались различные побочные эффекты, связанные с приемом синтетических аналогов глюкокортикоидных гормонов по традиционной схеме. У 1 больного развился эрозивный гастрит, у 2 больных — артериальная гипертензия, у 11 больных — ожирение 1-й степени. Частота побочных эффектов у больных 4-й группы была достоверно выше (p<0,001), чем у больных других групп.
По данным различных авторов, частота рецидивов ПТ с обострением всех симптомов, увеличивавших общую продолжительность заболевания до 1 года и более, может колебаться от 11 до 47 %. В нашем исследовании рецидивы заболевания, которые проявлялись болевым синдромом в области ЩЖ, повышением температуры тела до субфебрильных цифр и увеличением СОЭ, были отмечены в 7,5 % случаев. Рецидивы заболевания были только у больных с тяжелой формой заболевания через 4 месяца наблюдения: у 4 пациентов из 1-й группы и 5 пациентов из 4-й группы. У всех больных рецидивы ПТ были средней степени тяжести, что подтверждалось клиническими и лабораторными данными. При выявлении рецидива ПТ проводилось лечение синтетическими аналогами глюкокортикоидов (преднизолон) в малых дозах (15 мг в сутки) в сочетании с ЛТ на область ЩЖ в течение 20 дней с последующим снижением дозы глюкокортикоидных гормонов.
Через 1 год после ПТ у 88 пациентов (73,3 %) общее состояние оставалось удовлетворительным, у 32 пациентов (26,7 %) были выявлены различные жалобы. Наибольшее количество жалоб предъявляли пациенты 4-й группы, получавшие 1 год назад по поводу ПТ синтетические аналоги глюкокортикоидных гормонов по традиционной схеме. У 6 больных наблюдались головные боли, у 9 пациентов — прибавка веса, у 9 пациентов — общая слабость. Необходимо отметить, что общее количество больных, предъявлявших различные жалобы, сократилось с 45,8 % через 4 месяца наблюдения до 26,7 % через 1 год.
К концу 1-го года наблюдения во всех группах больных сохранялась положительная динамика средних показателей ЧСС, систолического и диастолического АД, которые достоверно не отличались от показателей, полученных через 4 месяца после начала заболевания. Подобная закономерность наблюдалась у пациентов всех групп в отношении температуры тела, СОЭ и среднего объема ЩЖ.
По данным клинического и гормонального обследования через 1 год наблюдения у всех больных сохранялось эутиреоидное состояние.
Рецидивов заболевания через 1 год наблюдения не было отмечено ни в одной группе больных.
Таким образом, рецидивы ПТ были отмечены только через 4 месяца наблюдения у 9 (7,5 %) больных с тяжелыми формами ПТ: у 4 больных из 1-й группы и у 5 больных из 4-й группы. После проведенного лечения аналогами глюкокортикоидных гормонов в малых дозах (15 мг в день) в комбинации с курсом ЛТ на область ЩЖ (20 процедур) с дальнейшим снижением дозы препаратов повторные рецидивы через 1 год наблюдения отмечены не были.
Использование ЛТ при ПТ позволяет сократить средние сроки лечения до 45–50 дней. Этот метод лечения может использоваться как монотерпия при легких формах заболевания. При лечении среднетяжелых и тяжелых форм ПТ облучение ЩЖ гелиево-неоновым лазером используется как дополнительный метод в комбинации с нестероидными противовоспалительными препаратами или синтетическими аналогами глюкокортикоидных гормонов. Комбинированная терапия, кроме сокращения сроков лечения с 3 месяцев до 50 дней, позволяет использовать более низкие дозы глюкокортикоидных гормонов, что особенно актуально у больных с сопутствующей патологией. При более коротких сроках приема глюкокортикоидных гормонов уменьшается количество побочных эффектов. Количество рецидивов ПТ было одинаково в группах больных, получавших традиционную терапию и комбинированное лечение.
Выводы
1. В зависимости от особенностей клинического течения подострого тиреоидита у больных выделено 3 степени тяжести заболевания: легкая, средняя и тяжелая. Легкий тиреотоксикоз был диагностирован у 15,8 % больных с тяжелым течением подострого тиреоидита.
2. При легком течении подострого тиреоидита в качестве самостоятельного метода у больных целесообразно применять лечение гелиево-неоновым лазером на область щитовидной железы.
3. Гелиево-неоновое лазерное облучение в комбинации с пероральным приемом нестероидных противовоспалительных препаратов или синтетических аналогов глюкокортикоидных гормонов у больных подострым тиреоидитом со среднетяжелым и тяжелым течением заболевания позволяет снизить дозу используемых препаратов, сократить сроки лечения и уменьшить количество побочных эффектов.
4. Через 1 год после проведенного курса облучения гелиево-неоновым лазером на область щитовидной железы в качестве монотерапии, а также в сочетании с лечением нестероидными противовоспалительными препаратами или малыми дозами глюкортикоидных гормонов у больных подострым тиреоидитом отмечено сохранение эутиреоидного состояния, отсутствие рецидивов заболевания
Литература1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Фундаментальная и клиническая тироидология. — М.: ОАО «Издательство «Медицина», 2007. — 816 с.2. Международный опыт изучения заболеваний щитовидной железы (по материалам журнала «Thyroid International») / Перевод, комментарии и редакция В.В. Фадеева. — М.: РКИ Соверо Пресс, 2004. — 296 с.3. Ворохобина Н.В., Аль-Джадри М.Я., Крючкова З.В., Волкова Е.А., Кузьмина В.А. Клинические особенности подострого тиреоидита и методы его лечения // Казанский медицинский журнал. — 2007. — Т. 88, № 6. — С. 544-547.4. Подзолков А.В., Фадеев В.В. Гипотиреоз, субклинический гипотиреоз, высоконормальный уровень ТТГ // Клиническая и экспериментальная эндокринология. — 2009. — т. 5, № 2. — С.4-9.5. Александрова Г.Ф., Трошина Е.А., Абдулхабирова Ф.М. Особенности течения и терапии гипотиреоза у пациентов с ишемической болезнью сердца // Лечащий врач. — 2008. — №6.— С. 34-38.
Подострый тиреоидит

Подострый тиреоидит (тиреоидит де Кервена, гранулематозный тиреоидит) — воспалительное повреждение ткани щитовидной железы, сопровождающееся проходящим гипертиреозом с тиреотоксикозом, вероятностью перехода в гипотиреоз, местной и общей реакцией организма. Встречается у лиц обоего пола (чаще у женщин; от 4:1 до 6:1, по данным разных исследований) и всех возрастов (больше после 30-40 лет).
Возникает сезонно (особенно с июля по сентябрь), после инфекции верхних дыхательных путей. Вирусный источник подострого тиреоидита не подтверждён. Подострое воспаление развивается с одной или с двух сторон щитовидной железы, сопровождается болезненными и другими дискомфортными ощущениями в шее, преобладая со стороны поражения железы, а также болями в мышцах, общим недомоганием и усталостью.
Прогноз при правильном лечении благоприятный, восстановительный. Длительность заболевания — от нескольких недель до нескольких месяцев (в некоторых случаях, при отсутствии адекватного лечения, — годы). В сопоставлении с прочими заболеваниями щитовидной железы, подострый тиреоидит возникает относительно редко.
О причинах и механизме развития подострого тиреоидита
Многие источники повторяют мнение о вирусной и аутоиммунной этиологии подострого тиреоидита. Тем не менее, прямых и абсолютных доказательств аутоиммунной и вирусной провокации воспаления в щитовидной железе нет.
Изучение в 2008 г. истории развития подострого тиреоидита у 852 пациентов показало Nishihara E. и соавторам, что «в анамнезе у пациентов не было явной связи с вирусной инфекцией» [1]. Специалисты выразили мнение, что инфекция и аутоиммунный процесс лишь сопровождают воспаление, не оказывая патологического действия.
Rachel Desailloud и Didier Hober (2016) провели изучение большого количества исследований других специалистов, анализировавших так или иначе роль вирусов в развитии подострого тиреоидита. Никаких абсолютных доказательств авторы не выявили. По их мнению: «…Интерпретация вирусологических данных должна быть осторожной. Наличие антител, направленных к вирусу, не доказывает, что этот патоген ответственен за болезнь, особенно, когда агент распространен в общей популяции. С другой стороны, отсутствие вирусных маркеров при наступлении заболевания не опровергает вирусную гипотезу» [2]. Авторы указывают на то, что присутствие вирусов и антител в организме при заболевании — факт сопровождения тиреоидита, но не провокации его.
Различают подострый тиреоидит в результате механической травмы щитовидной железы (очень активной пальпации железы, удара в переднюю область шеи и т.п.) и послеродовый тиреоидит.
По мнению Клиники щитовидной железы доктора А.В. Ушакова, в появлении и развитии подострого тиреоидита абсолютное значение играет раздражающее действие периферической вегетативной нервной системы (пВНС) на щитовидную железу. Именно возбуждение в нервных центрах пВНС может развиваться при любых инфекционных (в т.ч. вирусных) и иных воспалительных заболеваниях верхних дыхательных путей, а также преобладать с одной стороны (правой или левой), в т.ч. поражая не всю долю железы, а её конкретный крупный сегмент, иннервируемый определенной группой нервных клеток.
Очень значительное нервное влияние на участок щитовидной железы приводит к интенсивному перенапряжению и разрушению структуры ткани в месте такого действия. От величины и продолжительности поступления в железу сильных нервных раздражений зависит проявление болезни и её длительность.
Вероятность развития подострого тиреоидита у близких родственников (т.е. генетическая предрасположенность) связана с предрасположенностью к значимому возбуждению групп нервных клеток, прямо связанных с щитовидной железой.
Диагностика подострого тиреоидита
Определение подострого тиреоидита опирается на оценку симптомов и лабораторных данных. Уточняет диагноз ультразвуковое исследование (УЗИ).
В начале болезни анализ крови демонстрирует явления гипертиреоза, вызываемые интенсивным распадом участка ткани в одной из долей щитовидной железы. При этом (в начале болезни) определяется значимое уменьшение ТТГ (менее 0,1 мЕд/л) с увеличением Тиреоглобулина, Т4св. и Т3св. Этот гипертиреоидный период болезни сопровождается признаками тиреотоксикоза, выраженность которых соответствует избытку Т3св. Позже, по мере расхода и выведения щитовидных гормонов из крови, анализ крови показывает явления эутиреоза (ТТГ в норме), переходящего в сторону гипотиреоза (увеличение ТТГ более нормы), а затем вновь — эутиреоз. Все эти состояния гормонального обмена индивидуально проявлены и имеют разную продолжительность для каждого индивидуума.
Важным лабораторным ориентиром в диагностике подострого воспаления щитовидной железы служит оценка скорости оседания эритроцитов (СОЭ). Этот показатель превышает норму, находясь в пределах 40-60 мм/ч (реже до 80-100 мм/ч). Сочетание симптомов боли в области щитовидной железы и увеличение СОЭ указывают на высокую вероятность подострого тиреоидита. Уверенность в диагнозе дают гормональный анализ крови вместе с УЗИ щитовидной железы.
Изменения лимфоцитарной формулы обычно не наблюдается. Тем не менее, некоторые исследователи наблюдали умеренный лейкоцитоз со смещением лейкоформулы влево. Такое обстоятельство может определяться при сопровождении подострого тиреоидита инфекционной патологией, протекающей параллельно с воспалением в щитовидной железе. Например, при инфекционном паротите.
Изыскания диагностической пользы от анализа отношений эозинофилов/моноцитов (3) и Т3св./Т4св. [4, 5] для отличия диффузного токсического зоба (ДТЗ; болезни Грейвса) от подострого тиреоидита оказались мало полезны, т.к. около 40% случаев двух вариантов заболеваний, сопровождающихся тиреотоксикозом очень похожи по особенностям гормонального обмена и, соответственно, данным анализа крови. Симптомы (боль в шее), увеличение СОЭ и УЗИ щитовидной железы — недорогие и точные ориентиры для абсолютной диагностики подострого воспаления щитовидной железы.
Применение сцинтиграфии щитовидной железы, безусловно, помогает оценить выраженность захвата радиофармпрепарата (РФП) в участке поражения, и, таким образом, различить участок гиперпродукции гормонов (при ДТЗ, болезни Грейвсе) от выделения гормонов при разрушении ткани (при подостром тиреоидите). Тем не менее, применение сцинтиграфии для дифференциальной диагностики в большинстве случаев тиреоидита не показано.
При этом заболевании также нет абсолютных показаний к пункционной биопсии, которая применялась в научных целях и служила ранее (до широкого применения УЗИ) для различия с другими заболеваниями железы. Безусловно, цитологическое исследование биоптата из участка воспаления имеет характерные особенности [6], но это исследование может помочь в случае дифференциальной диагностики с узловым и злокачественным процессами щитовидной железы при затруднении в зрительной оценке при УЗИ.
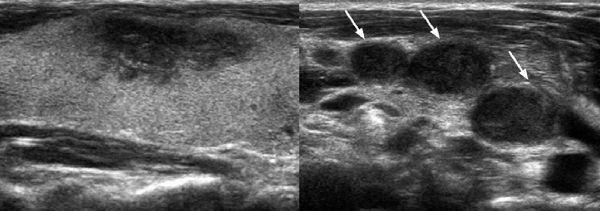
Ультразвуковая диагностика подострого тиреоидита
Состояние ткани щитовидной железы при её подостром воспалении имеет типичную ультразвуковую картину. При УЗИ в серой шкале участок с воспалением и повреждением ткани выглядит как гипоэхогенный (т.е. темный) участок (рисунки 1 и 2). В допплеровском режиме (ЦДК или ЭДК) в участке поражения кровоток не заметен (в связи с разрушением ткани и проникновением клеток иммунной системы — лимфоцитов). Пиковая систолическая скорость кровотока (ПССК) в верхних щитовидных артериях меньше 50 см/с [7]. Диффузное увеличение доли или всей ЩЖ встречается не всегда.
В Клинике щитовидной железы доктора А.В. Ушакова определены закономерные УЗ-признаки подострого тиреоидита при УЗИ, указывающие на связь с пВНС:
1. Участок поражения обычно занимает крупный или средний сегмент(ы) доли ЩЖ. Поэтому располагается преимущественно продольно.
2. Относительно характерно одностороннее развитие воспаления (в правой или левой доле ЩЖ).
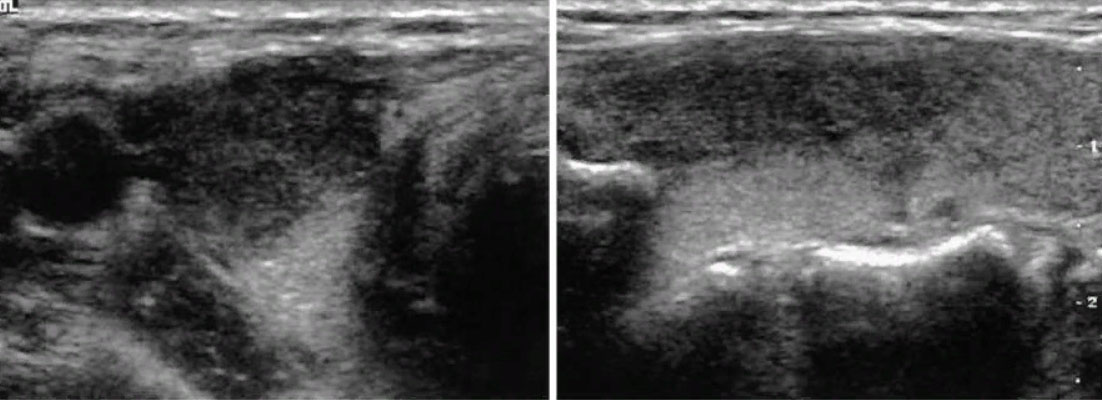
Рисунок 1. Подострый тиреоидит. Виден гипоэхогенный участок в правой доле щитовидной железы, занимающий продольное положение, соответственно крупному сегменту доли (краниально-вентральному) [8].
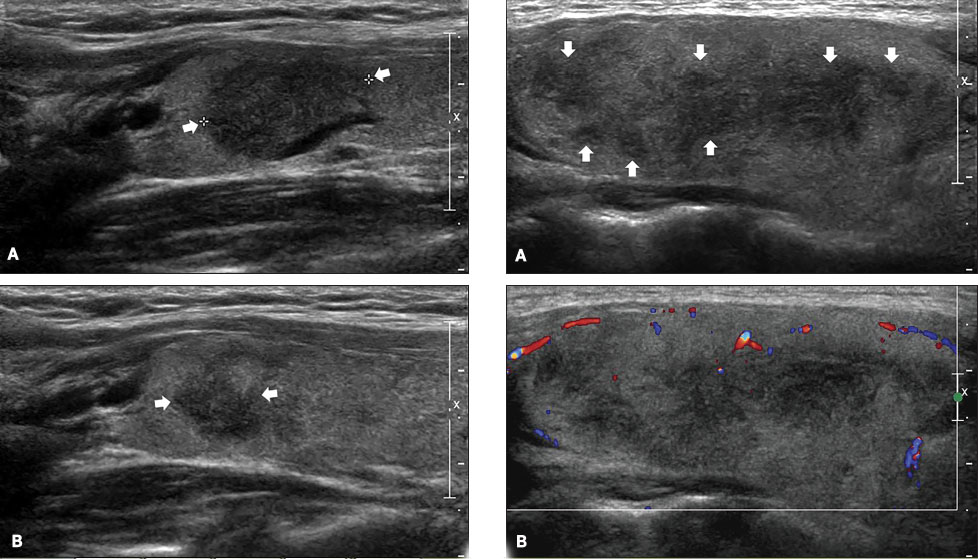
Рисунок 2. Подострый тиреоидит. Два пациента (справа и слева). В долях щитовидной железы (ЩЖ) видны гипоэхогенные (темные) участки — места воспалительного разрушения в средних сегментах долей (каждый сегмент показан стрелками).
Слева: А. До лечения в доле заметен большой сегмент ЩЖ с очень значительной гипоэхогенностью (признак разрушения ткани ЩЖ, с проникновением и последующим развитием иммунных клеток — лимфоцитов).
В. Через 11 дней после лечения видно, как уменьшился сегмент и стал менее гипоэхогенным (лимфоцитами были удалены разрушенные и изменённые элементы ткани). Определяются близлежащие средние сегменты, окружённые гипоэхогенными контурами (сосудами).
Справа: А. Разной величины средние сегменты доли ЩЖ с зонами разрушения.
В. В допплеровском режиме ЦДК кровоток в пораженных сегментах ЩЖ не определяется [9].
Представленные примеры ультразвуковых проявлений подострого тиреоидита в ткани ЩЖ ориентируют в главном. Видно, что поражаются отдельные части (сегменты) железы. Это указывает на отсутствие повсеместного поражения железы вирусом или инфекцией (с током крови), и нацеливает на основу болезни — раздражающее влияние на участки долей со стороны групп очень значительно возбужденных нервных клеток пВНС (каждым сегментом в железе руководит определённая группа нервных клеток пВНС).
Симптомы подострого тиреоидита
Основное клиническое проявление — это сильная боль, которая обычно локализуется в передней части шеи и может распространяться к челюсти, в область уха или грудную клетку. Кроме того, часто присутствуют болезненность щитовидной железы при пальпации и небольшой диффузный зоб (увеличение объёма щитовидной железы). В начале болезни боли могут преобладать с одной из сторон, переходить с одной стороны шеи на другую, уменьшаться и усиливаться.
Общие начальные симптомы подострого тиреоидита включают мало выраженную лихорадку, усталость, слабые тиреотоксические явления. Температура тела увеличивается до субфебрильных значений (37-37,9°С) 38°С или более. Могут определяться слабость, недомогание, потливость, раздражительность. В зависимости от выраженности воспаления в железе и прочих клинически индивидуальных обстоятельств и лечебных условий, продолжение первой фазы болезни может занимать от нескольких дней или недели до 1,5 месяца.
Следующая фаза может быть связана с явлением гипотиреоза. Она сопровождается нормализацией температуры, уменьшением дискомфорта и прекращением боли в шее, мышечной слабостью.
При неадекватном лечении возможны обострения, с возобновлением боли и прочих симптомов.
Лечение подострого тиреоидита
В острую фазу заболевания показано назначение препаратов, уменьшающих перенапряжение сердечно-сосудистой системы от избытка гормонов щитовидной железы. С этой целью могут применяться бета-блокаторы. Доза этих препаратов зависит от выраженности гипертиреоза и тиреотоксикоза. Чем больше превышает норму Т4св., Т3св. и чем больше частота пульса, тем больше доза.
Ошибочно при подостром тиреоидите назначать тиреостатические препараты (Тирозол, Пропицил, Мерказолил). Дело в том, что при воспалительном разрушении участка щитовидной железы содержащиеся в нём гормоны сразу попадают в кровь, вызывая тиреотоксикоз. На щитовидные гормоны в крови тиреостатические препараты не влияют. Эти средства способны лишь затормозить образование гормонов внутри неповрежденной железы.
С момента определения субклинического диагноза и до ликвидации активного воспаления (включая его признаки – симптомы боли и дискомфорта в шее, увеличение СОЭ) показано применение нестероидных противовоспалительных препаратов (НПВС). Уместны инъекции и свечи. Применение таблетированных форм этих средств должно быть кратковременным и индивидуально осторожным (следует избегать раздражения слизистой желудка и пр.).
Основное влияние НПВС не сводится к подавлению боли, а несёт прямое седативное влияние на периферическую вегетативную нервную систему (пВНС), раздражающую определенные участки (сегменты) щитовидной железы. Важен выбор препарата и индивидуальный контроль результата лечения.
Важным компонентом являются физиотерпевтические мероприятия, нацеленные на центры пВНС. Особое дополняющее лечебное действие оказывают местные медикаментозные блокады нервной системы.
Ошибочным является шаблонное назначение всем подряд стероидного препарата Преднизолон. Особенно в максимальной дозе и многонедельно. Применение прямой гормональной помощи показано в случаях со значительно выраженным и продолжающимся тиреоидитом, при условии отсутствия восстановления при адекватно проведенном комплексе негормонального лечения.
Даже улучшение, достигнутое длительным и высокодозированным применением Преднизолона, может перейти в обострение, если в лечении не применяется достаточное влияние на основу болезни – центры активизации пВНС, связанные с щитовидной железой.
При отсутствии достоверных признаков злокачественности (при сопутствующем злокачественном узле) показаний к операции при подостром тиреоидите нет.
Литература
1. Nishihara E, Ohye H, Amino N, Takata K, Arishima T, Kudo T, Ito M, Kubota S, Fukata S, Miyauchi A. Clinical characteristics of 852 patients with subacute thyroiditis before treatment. Intern Med. 2008; 47:725–729.
2. Rachel Desailloud and Didier Hober Viruses and thyroiditis: an update Virol J. 2009; 6: 5.
3. Izumi Y, Hidaka Y, Tada H, Takano T, Kashiwai T, Tatsumi KI, Ichihara K, Amino N. Simple and practical parameters for differentiation between destruction-induced thyrotoxicosis and Graves’ thyrotoxicosis. Clin Endocrinol (Oxf). 2002 Jul;57(1):51-8.
4. Chutintorn Sriphrapradang, Adikan Bhasipol Differentiating Graves’ disease from subacute thyroiditis using ratio of serum free triiodothyronine to free thyroxine Ann Med Surg (Lond) 2016 Sep; 10: 69–72.
5. Xinxin Chen, Yulin Zhou, Mengxi Zhou, Qinglei Yin, Shu Wang Diagnostic Values of Free Triiodothyronine and Free Thyroxine and the Ratio of Free Triiodothyronine to Free Thyroxine in Thyrotoxicosis Int J Endocrinol. 2018; 2018: 4836736.
6. Rachna Lamichaney, Mingma Sherpa, Deepak Das, Chumila Thinley Bhutia, Sabina Laishram Fine-Needle Aspiration of De Quervain’s Thyroiditis (Subacute Granulomatous Thyroiditis): A Cytological Review of 20 Cases J Clin Diagn Res. 2017 Aug; 11(8): EC09–EC11.
7. Xiaolong Zhao, Lili Chen, Ling Li, Yao Wang, Yong Wang, Linuo Zhou, Fangfang Zeng, Yiming Li, Renming Hu, Hong Liu Peak Systolic Velocity of Superior Thyroid Artery for the Differential Diagnosis of Thyrotoxicosis PLoS One. 2012; 7(11): e50051.
8. Sun Young Park, Eun-Kyung Kim, Min Jung Kim, Byung Moon Kim, Ki Keun Oh, Soon Won Hong, Cheong Soo Park Ultrasonographic Characteristics of Subacute Granulomatous Thyroiditis Korean J Radiol. 2006 Oct-Dec; 7(4): 229–234.
9. Yoo Jin Lee, Dong Wook Kim Sonographic Characteristics and Interval Changes of Subacute Thyroiditis J Ultrasound Med 2016; 35:1653–1659.
10. Assim A. Alfadda, Reem M. Sallam, Ghadi E. Elawad, Hisham AlDhukair, Mossaed M. Alyahya Subacute Thyroiditis: Clinical Presentation and Long Term Outcome Int J Endocrinol. 2014; 2014: 794943.
11. S. A. Peter Painful subacute thyroiditis (de Quervain’s thyroiditis). J Natl Med Assoc. 1992 Oct; 84(10): 877–879.
Подострый тиреоидит (тиреоидит де Кервена) — симптомы и лечение
Что такое подострый тиреоидит (тиреоидит де Кервена)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Плотниковой Яны Яковлевны, эндокринолога со стажем в 10 лет.
Над статьей доктора Плотниковой Яны Яковлевны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Подострый тиреоидит (тиреоидит де Кервена) — это воспалительное заболевание щитовидной железы, вызванное вирусной инфекцией.
Данное заболевание было описано в 1904 году швейцарским хирургом Фрицем де Кервеном [1] . Подострый тиреоидит встречается у людей в возрасте от 30 до 60 лет. Чаще болеют женщины, что связано с наследственным фактором. Если мама или бабушка женщины имели патологию щитовидной железы, риск заболевания повышается в несколько раз. Помимо наследственности важную роль играют перенесённые ранее стрессы, как физические, так и эмоциональные, экология и в целом образ жизни женщины. Мужчины редко наследуют данную патологию от матери. На долю подострого тиреоидита приходится от 1 до 15 % случаев среди многочисленных заболеваний щитовидной железы [13] .
Заболеваемость чаще регистрируется у лиц с носительством антигена HLA-Bw35, что говорит о восприимчивости к вирусным заболеваниям. Антиген HLA-Bw35 был открыт в 50-х годах ХХ века. Это один из человеческих лейкоцитарных антигенов, он входит в систему тканевой совместимости человека (англ. HLA, Human Leukocyte Antigens), которую также называют главным комплексом гистосовместимости (ГКГС).
Эта система представляет собой комплекс генов, выполняющих различные биологические функции (самая важная — иммунная). В первую очередь они обеспечивают генетический контроль иммунного ответа и взаимодействие между собой клеток, которые реализуют этот ответ. Система HLA является одной из наиболее изученных среди всех сложных генетических систем человека, поскольку именно она может помочь решить такие важные проблемы медицины, как трансплантация органов и тканей, борьба с онкологическими и аутоиммунными заболеваниями [8] .
Причиной подострого тиреоидита чаще всего являются вирусные заболевания:
- ;
- ОРВИ; ; ; ; ;
- эпидемический паротит.
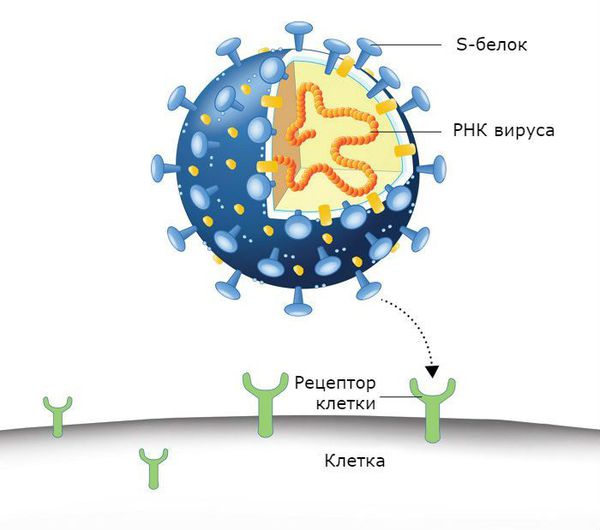
Новый тип коронавируса — SARS-CoV-2 (COVID-19) также может стать причиной заболевания. Семейство коронавирусов включает в себя 40 видов РНК-содержащих вирусов, которые поражают человека и животных. Название связано со строением вируса: у него есть шиповидные отростки, напоминающие солнечную корону. Данный вирус обладает специфическим механизмом проникновения через мембрану клетки. Белок «короны» (S-белок) имитирует фермент, необходимый клетке для жизнедеятельности, поэтому вирусные частицы без труда связываются с трансмембранными рецепторами клеток. Рецептор захватывает фальшивую молекулу с «короны», вирус продавливает её в клетку, после чего впрыскивается РНК вируса.
Возбудитель болезни COVID-19 очень похож на возбудителя атипичной пневмонии — тяжёлого острого респираторного синдрома (ТОРС, англ. SARS). Теоретически новый вирус может привести к болезням репродуктивной системы мужчин, а также может вызывать повреждения тонкой кишки, почек, сердца и щитовидной железы.
Щитовидная железа при SARS претерпевает значительные нарушения фолликулярных и парафолликулярных клеток. В острой фазе заболевания вирус снижает уровень гормонов щитовидной железы — тироксина (тетрайодтиронина — T4) и трийодтиронина (Т3) в крови, также снижается уровень тиреотропного гормона (ТТГ). У немногих людей, перенесших SARS, может развиться гипотиреоз (недостаток гормонов щитовидной железы, вызванный снижением функции железы). Люди с патологией щитовидной железы не имеют дополнительных рисков инфицирования. К реальным рискам приводит отказ от приёма тиреоидной терапии (левотироксин натрия), что способствует декомпенсации гипотиреоза. В этом случае организм уже не может самостоятельно справиться с болезнью, в результате чего возникают различные нарушения.
Однако не у всех людей после перенесённых вышеуказанных заболеваний появляется воспаление щитовидной железы. Тиреоидит возникает из-за нарушений в работе иммунной системы при возможном участии инфекции, а также из-за неправильного образа жизни и вредных привычек пациента. Заболевание проявляется агрессией иммунной системы к ткани щитовидной железы, когда ткань железы ошибочно распознается иммунитетом как чужеродная и опасная. В результате такой реакции в щитовидную железу стягиваются иммунные клетки, вырабатываются антитела против ткани железы (они обозначаются как АТ-ТГ и АТ-ТПО, их можно увидеть в анализе крови). Начинается процесс воспаления и разрушения клеток железы собственным иммунитетом. При этом возможно снижение или (реже) повышение функции щитовидной железы (гипотиреоз или гипертиреоз).
Ещё одной причиной подострого тиреоидита может стать бесконтрольный приём препаратов, содержащих гормоны и йод, например йодида калия, левотироксина натрия. Йод необходим организму человека, поскольку он входит в состав гормонов щитовидной железы T4 и Т3. Йод принимает участие в регуляции белкового, жирового, водно-электролитного, энергетического обмена, помогает поддерживать нормальную температуру тела, участвует в метаболизме витаминов, а также в процессе роста и развития организма, включая нервно-психическое развитие. Кроме того, йод повышает потребление кислорода тканями. Организм не может синтезировать йод самостоятельно, мы получаем его исключительно с продуктами питания и с приёмом препаратов, например йодида калия. Суточная потребность составляет 100-200 мкг в зависимости от возраста и состояния здоровья.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы подострого тиреоидита
При подостром тиреодите примерно через 4-6 недель после перенесённой вирусной инфекции (ОРВИ, гриппа, кори, эпидемического паротита) у пациента появляется общая слабость, разбитость, потливость, быстрая утомляемость от незначительной нагрузки, раздражительность. Пациента беспокоят периодические головные боли, боли в мышцах, ломота в теле на фоне повышение температуры тела от 37,1 до 38 °С, снижение веса. Также больной отмечает появление внезапной, острой боли на передней поверхности шеи справа или слева. Как правило, боль иррадиирует (отдаёт) в ухо или нижнюю челюсть с той же стороны, при глотании или поворотах головы становится сильнее.
Болезненность возникает из-за отёка и растяжения капсулы щитовидной железы. При этом учащается сердцебиение, повышается артериальное давление. Женщин беспокоят гормональные расстройства в виде задержки менструаций. На УЗИ молочных желёз может выявиться фиброзно-кистозная мастопатия [10] .
В возникновении и развитии мастопатии ведущая роль отводится изменениям функции гипоталамо-гипофизарной системы. Она объединяет структуру гипофиза и гипоталамуса, выполняет функции нервной и эндокринной систем. Гипоталамо-гипофизарная система является основным звеном в цепи нервной регуляции эндокринной функции организма.
В различных эпидемиологических исследованиях у больных с мастопатией выявляется большая, чем в популяции, частота встречаемости патологии щитовидной железы — до 50 % и более. Обнаружено, что снижение функции щитовидной железы повышает риск развития мастопатии в 3,8 раза [11] .
По мере того, как заболевание прогрессирует, боль нередко появляется и с другой стороны шеи. Зачастую болевые ощущения настолько сильны, что невозможно провести пальпацию щитовидной железы. Визуально железа увеличена в объёме и отёчна за счёт воспаления капсулы [9] [10] .
Патогенез подострого тиреоидита
В работе щитовидной железы важную роль играет тиреотропный гормон гипофиза (ТТГ). ТТГ воздействует на рецепторы, находящиеся на поверхности эпителиальных клеток щитовидной железы и тем самым стимулирует синтез гормонов тироксина (Т4) и трийодтиронина (Т3) в тиреоцитах (фолликулярных клетках щитовидной железы). Таким образом гипофиз регулирует работу щитовидной железы.
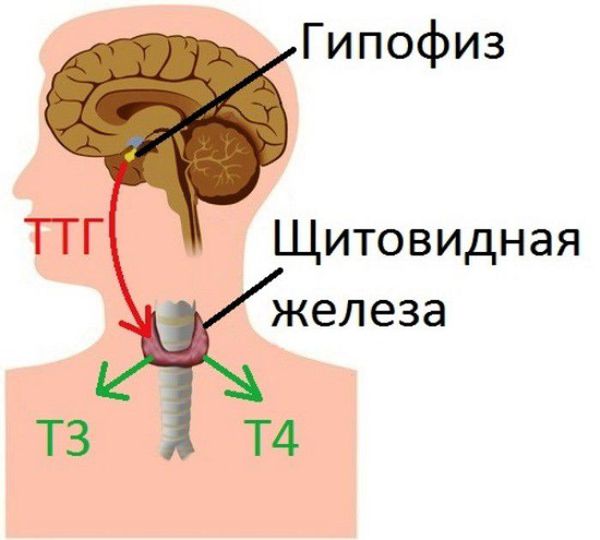
Предполагается, что при подостром тиреоидите вирусные агенты проникают внутрь тиреоцитов, вызывая в последующем синтез атипичных белковых структур. Иммунная система считает атипичные белки чужеродными агентами, вырабатывает антитела к рецепторам ТТГ и разрушает их, в результате чего и развивается воспалительный процесс. Когда рецепторы ТТГ повреждены, щитовидная железа перестает «слышать» команды, поступающие из гипофиза.
Поражённые тиреоциты подвергаются деструктивным изменениям, а на их месте формируются гранулёмы (очаги воспаления в виде узелков). Фолликулы щитовидной железы разрываются, и в кровь поступает большое количество тиреоидных гормонов, развивается тиреотоксикоз (повышенный уровень тиреоидных гормонов). Примерно через 1-2 месяца запасы гормонов истощаются, и тиреотоксикоз сменяется гипотиреозом [6] [7] . При выздоровлении на месте гранулём образуется рубцовая ткань, после этого щитовидная железа постепенно начинает работать в полном объёме.
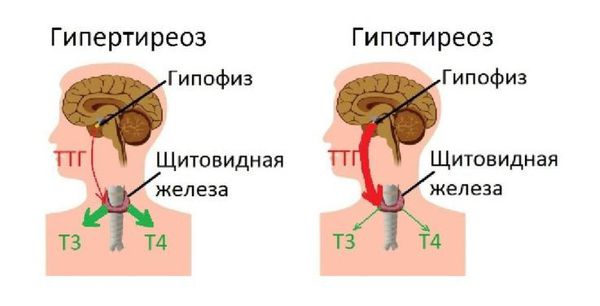
Гипотиреоз может быть следствием разрушения стимулирующих рецепторов к ТТГ, а тиреотоксикоз — следствием разрушения тормозных рецепторов. Другой вариант гипотиреоза при воспалении щитовидной железы — аутоиммунное разрушение большого количества клеток, вырабатывающих гормоны Т3 и Т4 . При УЗИ в таких случаях видны выраженные диффузные и/или узловые изменения в ткани железы.
Классификация и стадии развития подострого тиреоидита
Стадии развития подострого тиреоидита
1. Тиреотоксическая стадия продолжается от трёх до шести недель. Из разрушенных фолликулов железы в кровь выбрасывается большое количество гормонов щитовидной железы, а именно Т3 (трийодтиронин) и Т4 (тетрайодтиронин), что способствует развитию тиреотоксикоза. В то же время снижается поглощение йода щитовидной железой. Концентрация гормонов в анализе крови выглядит следующим образом:
- уровень свободного тетрайодтиронина (FT4) и трийодтиронина (FT3) повышен ↑;
- уровень тиреотропного гормона (ТТГ) снижен ↓.
На данном этапе пациента могут беспокоить раздражительность, плаксивость, учащённое сердцебиение, похудание, повышение температуры тела до 38 °С, .
При осмотре пациента врач отмечает, что щитовидная железа увеличена в объёме и резко болезненна при пальпации. В отдельных участках железа уплотняется, она подвижна при глотании и не спаяна с окружающими тканями, кожа над железой гиперемирована (имеется покраснение). Подчелюстные и шейные лимфатические узлы не увеличены.
2. Эутиреоидная стадия длится от одной до трёх недель. В течение этого периода запасы тиреоидных гормонов Т3 и Т4 постепенно истощаются, их концентрация в крови снижается до нормы. Поглощение йода железой по-прежнему снижено. Концентрация гормонов в крови: ТТГ, FT4, FT3 — в норме (норма зависит от диапазона лабораторных показателей).
3. Гипотиреоидная стадия продолжается от двух до шести месяцев. Из-за снижения количества функционально активных тиреоцитов, концентрация ТТГ увеличивается. В то же время усиливается процесс заживления фолликулярной ткани. К завершению этой стадии поглощение йода щитовидной железой восстанавливается. Концентрация гормонов: ↓ FT4, ↓ FT3, ↑ ТТГ.
4. Стадия выздоровления наступает через полтора-два месяца. Уровень гормонов щитовидной железы возвращается в пределы физиологической нормы. Поглощение йода находится в пределах нормы. Данная стадия характеризуется восстановлением клеток железы и нормализацией её функции . Энергообмен и работа всех органов и систем также восстанавливаются [6] [7] .
По морфологическим критериям выделяют три стадии воспаления:
- Ранняя стадия характеризуется кровенаполнением железы, гиперплазией (утолщением оболочки) и гипертрофией (увеличением объёма и массы) эпителиальных клеток.
- В промежуточной стадии происходит разрыв основной мембраны фолликулов, что приводит к выходу коллоида ( вещества, из которого производятся тиреоидные гормоны) и структурных элементов в перифолликулярное пространство (пространство около фолликула). Затем происходит инфильтрация (пропитывание) коллоида клетками иммунной системы — лейкоцитами, лимфоцитами, макрофагами. Вокруг остатков коллоида появляются гранулёмы (воспаление).
- Конечная стадия характеризуется развивающимся фиброзом (разрастанием соединительной ткани ) и процессом рубцевания или восстановления органа.
Критерии тяжести течения подострого тиреоидита
- При лёгкой степени тяжести пациент отмечает умеренные боли в одной из долей щитовидной железы, незначительную слабость, повышение температуры до 37 °С. В общем анализе крови СОЭ (скорость оседания эритроцитов) будет повышена до 35 мм/час.
- При средней степени тяжести боль в щитовидной железе носит выраженный характер с иррадиацией в ухо на стороне воспаления. Периодически беспокоят артралгии и миалгии (боли в суставах и мышцах). Температура тела повышается до 38 °С. В общем анализе крови СОЭ повышается до 50 мм/час.
- При тяжёлой степени боль в щитовидной железе носит интенсивный характер, локализуется чаще в обеих долях с иррадиацией в уши и нижнюю челюсть. Болевые ощущения усиливаются при глотании. Температура тела повышается выше 38 °С. В общем анализе крови СОЭ более 50 мм/час. У многих пациентов появляются признаки тиреотоксикоза.
Исходя из стадий развития и степеней тяжести формируется лечение пациента.
Осложнения подострого тиреоидита
Подострый тиреоидит, как правило, заканчивается полным выздоровлением и восстановлением утраченных функций. Однако у некоторых пациентов имеется склонность к рецидиву заболевания. Причиной могут быть хронические инфекции полости рта и носа.
Без лечения подострый тиреоидит может привести к необратимому снижению функции щитовидной железы. В этом случае снижаются обменные процессы в организме, увеличивается вес, замедляются мыслительные процессы, речь, понижается артериальное давление, уряжается пульс, человек испытывает сонливость и зябкость в конечностях, у женщин нарушается менструальный цикл, у мужчин снижается половая активность.
Одним из опасных осложнений подострого тиреоидита, является возникновение гноя в щитовидной железе, который может развиться при отсутствия своевременного и адекватного лечения. Гнойный тиреоидит вызывают челюстно-лицевые инфекции, возбудителями которых являются стафилококки, стрептококки, пневмококки и др. В группе риска лица с нелеченым кариесом, пульпитом, гингивитом, стоматитом и т. д. Гнойный тиреоидит составляет не более 1 % от всех случаев тиреоидитов [12] .
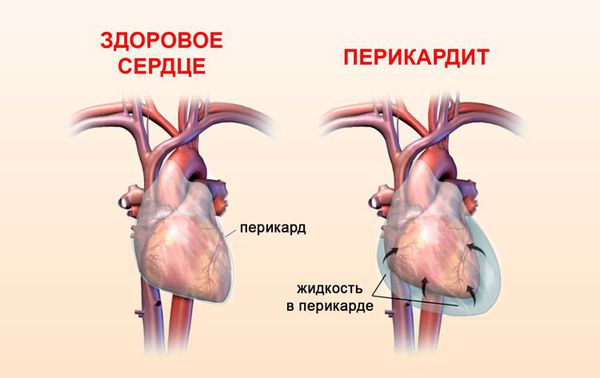
Гной может попасть в околосердечное пространство, вызвав тем самым гнойный перикардит — инфекционно-воспалительное поражение серозной оболочки сердца, сопровождающееся накоплением гнойной жидкости в околосердечной сумке. Как следствие могут возникнуть серьёзные последствия (тромбозы, сепсис) [1] [2] [3] [4] [5] .
Диагностика подострого тиреоидита
Чтобы установить диагноз подострого тиреоидита, специалисту необходимо выяснить жалобы пациента, собрать анамнез, провести полный осмотр с измерением температуры тела и артериального давления, назначить лабораторные и инструментальные обследования.
Анамнеза заболевания
Как правило, пациент сообщает врачу о ранее перенесённой вирусной инфекции, после которой появились характерные симптомы (повышение температуры тела до 38-39 °С, дрожь в теле, похудание несмотря на повышенный аппетит и др.). Эти жалобы являются начальными признаками тиреотоксикоза.
Физикальное обследование
После сбора анамнеза врачу необходимо осмотреть и пропальпировать (прощупать) щитовидную железу. Учитывая её резкую болезненность, сделать это нужно очень осторожно, чтобы не причинить пациенту боли и дискомфорта.
Пальпаторно щитовидная железа увеличена в объёме, имеет плотную консистенцию, резко болезненна. Боль бывает локальной (местной) или диффузной (по всей области шеи), это зависит от степени вовлечения железы в воспалительный процесс . Кожа над железой гиперемирована, но лимфоузлы не увеличены.
Инструментальные исследования
Ультразвуковое исследование в случае подострого тиреоидита показывает увеличение размеров щитовидной железы. Для женщин верхней границей нормы принято считать объём щитовидной железы 18 см 3 , для мужчин — 25 см 3 .
Ещё одним ультразвуковым признаком является наличие нечётко ограниченных зон пониженной эхогенности (показатель низкой плотности ткани железы) в виде «облака» с одной или обеих сторон, что указывает на наличие воспалительного процесса. Иногда встречается миграция этих зон.
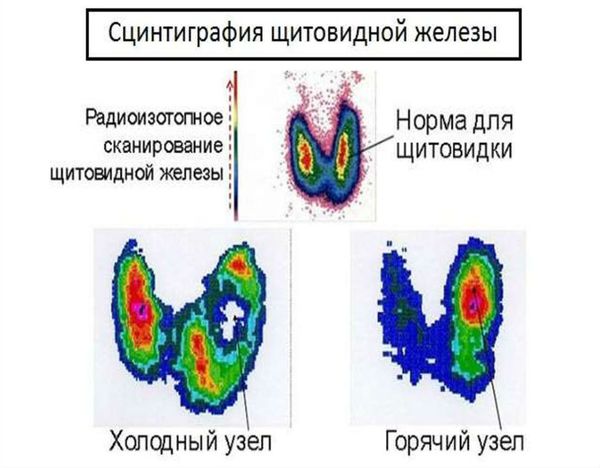
Сцинтиграфия щитовидной железы — это функциональная визуализация щитовидной железы. Пациенту внутривенно водят радиоактивный изотоп технеция-99m (99mTc), который захватывается щитовидной железой подобно йоду. Специальный прибор фиксирует радиоизлучение, испускаемое радиофармпрепаратом, затем преобразует его в двумерное изображение. Зона воспаления выглядит «холодной», т. е. окрашивается в синий цвет, что указывает на снижение или отсутствие захвата радиофармпрепарата щитовидной железой. Эти участки щитовидной железы утратили свою функцию.
Также с помощью этого метода осуществляется визуализация узлов и определение их функциональной автономии. Т. е. проводится диагностика нефункционирующих («холодных») узлов, в том числе при подозрении на злокачественное новообразование, и гиперфункционирующих («горячих») узлов, включая токсическую аденому.
Тонкоигольная аспирационная пункционная биопсия щитовидной железы (ТАПБ). Тонкой одноразовой иглой, надетой на одноразовый шприц, под контролем УЗИ делается пункция (прокол) узла щитовидной железы и аспирируется (засасывается) содержимое узла. Чаще всего производится 3-4 укола в разные участки узла для получения достаточного количества биологического материала. Далее содержимое узла наносится на предметные стёкла. Проводится предварительная оценка полученного материала, если последнего недостаточно, сразу же производится повторный забор.
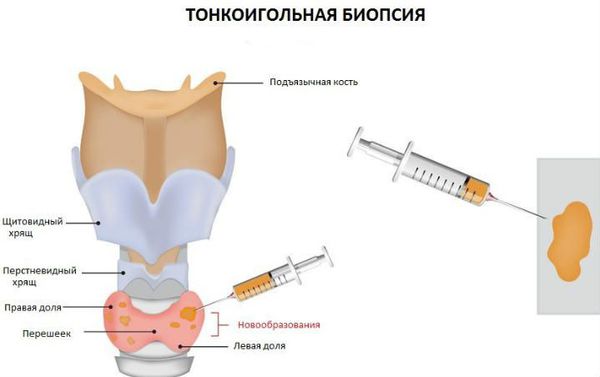
Признаком подострого тиреоидита является наличие доминирующих нейтрофилов и характерных гигантских клеток (полинуклеарных макрофагов), а также эпителиоидных клеток (мононуклеарных фагоцитов), что говорит об иммунном ответе на воспаление [2] [4] .
Лабораторная диагностика
Лабораторная диагностика включает в себя сдачу общего, биохимического анализа крови и оценку гормонального профиля.
Общий анализ крови:
- резкое ускорение СОЭ — до 50 мм/ч;
- лимфоцитоз (увеличение количества лимфоцитов);
- содержание лейкоцитов и лейкоцитарная формула в норме;
- нормохромная и нормоцитарная анемия (анемия, при которой отмечаются нормальный цвет и форма эритроцитов).
Биохимический анализ крови:
- повышение уровня белка фибриногена (отвечает за свёртываемость крови) вследствие воспаления в организме;
- незначительное повышение щелочной фосфатазы и других печёночных ферментов.
Контроль гормонального профиля:
- снижение уровня ТТГ;
- повышение связанных Т4 и Т3 (в тиреотоксическую стадию);
- может выявляться повышение в сыворотке крови уровня антител к ткани щитовидной железы (АТ-ТГ и АТ-ТПО). Эти антитела обнаруживаются в течение нескольких недель после появления симптоматики (через несколько месяцев антитела исчезают). Они свидетельствуют о воспалительном процессе в железе [1][4] .
Диагностические критерии подострого тиреоидита
Основные критерии подострого тиреоидита:
- Щитовидная железа увеличена в объёме, при пальпации есть болезненность либо чувствительность.
- Повышение СОЭ в общем анализе крови более 10-12 мм/час.
- Значительное снижение поглощения йода щитовидной железой.
- Преходящий (временный) гипертиреоз (↓ТТГ, ↑Т3, ↑Т4).
- Типичная для подострого тиреоидита УЗИ картина.
- Типичная для подострого тиреоидита ТАПБ картина.
- Отсутствие либо низкая концентрация антитиреоидных антител [4] .
Диагноз «подострый тиреоидит» ставится в том случае, если подходят оба основных критерия и любые два дополнительных критерия:
Дифференциальная диагностика
Дифференциальная диагностика — это способ диагностики, исключающий не подходящие по каким-либо фактам или симптомам заболевания, что в конечном счёте должно свести диагноз к единственно вероятной болезни. Дифференциальную диагностику подострого тиреоидита проводят со следующими заболеаниями:
- острый гнойный тиреоидит;
- кровоизлияние в кисту щитовидной железы; (ДТЗ); , гипертиреоидная фаза;
- недифференцированный рак щитовидной железы;
- флегмона шеи;
- средний отит;
- острый фарингит;
- синдром височно-нижнечелюстного сустава; ( воспаление слизистой оболочки пищевода) ;
- десневой или парадонтальный абсцесс [2] .
Исключить другие заболевания часто помогает проба с преднизолоном (тест Крайля). Пациенту назначается 30 мг преднизолона внутрь на 2 дня. Если это подострый тиреоидит, то болевой синдром купируется и самочувствие значительно улучшается, СОЭ в общем анализе крови снижается [2] .
Лечение подострого тиреоидита
Цели лечения подострого тиреоидита:
- купировать болевой синдром, тем самым улучшить качество жизни пациента;
- купировать воспалительную реакцию (нормализовать температуру тела и показатели общего анализа крови);
- восстановить нормальную работу щитовидной железы.
Для успешного лечения подострого тиреоидита применяют разные группы лекарственных препаратов.
Нестероидные противовоспалительные средства (НПВС) предназначены для купирования воспаления и боли. Препараты назначаются по индивидуальной схеме, выбранной лечащим врачом. При исчезновении болевого синдрома, снижении температуры тела, нормализации СОЭ дозу постепенно снижают вплоть до полной отмены лекарства.
Глюкокортикоиды (ГКС) обладают противовоспалительным, иммунодепрессивным (искусственно подавляют иммунитет), противоаллергическим, противошоковым эффектами. В случае подострого тиреоидита в большинстве случаев назначается преднизолон в дозе 30-40 мг внутрь после еды 1 раз в сутки. Препарат нужно принимать до ликвидации клинических проявлений, примерно в течение 14-21 дней, затем дозу препарата уменьшают на 5 мг 1 раз в неделю. Если дозу препарата снижать быстрее (более чем на 5 мг в неделю), то болевой синдром, как правило, усиливается. Общая продолжительность лечения составляет 2-3 месяца.
Бета-адреноблокаторы назначаются для устранения симптомов тиреотоксикоза, а именно учащённого сердцебиения (тахикардии). Применяют препарат пропранолол в дозе 20-40 мг 3-4 раза в сутки до ликвидации клинических проявлений (учащённого сердцебиения).
Тиреоидные препараты. При развитии первичного гипотиреоза (когда поражается сама щитовидная железа) при многократных тяжёлых рецидивах необходимо назначить заместительную гормональную терапию левотироксином натрия (Л-Тироксин). Дозировка препарата подбирается врачом индивидуально с учётом показателей гормонального профиля.
Препараты йода. В первую тиреотоксическую стадию развития заболевания принимать препараты йода не следует, чтобы не усугубить самочувствие пациента и не усилить работу щитовидной железы. В стадию гипотиреоза и восстановления функции щитовидной железы можно принимать небольшие дозы йода (примерно 100 мкг/день), продолжительность приёма устанавливается врачом индивидуально [3] [4] .
Прогноз. Профилактика
Как правило, подострый тиреоидит заканчивается полным выздоровлением через 1,5-2 месяца после начала терапии. Если лечение не проводится, заболевание длится до 4-6 месяцев [3] . У некоторых больных с хроническими очагами инфекции в полости рта и носа возможно появление рецидивов. В случае развития стойкого гипотиреоза (повышение уровня ТТГ, Т3 и Т4 могут быть в пределах нормы) показана пожизненная заместительная терапия тиреоидными гормонами (левотироксином натрия).
Первичная профилактика отсутствует. Чтобы не допустить возникновения подострого тиреоидита, важно своевременно лечить вирусные заболевания [1] [10]
Источник https://www.eurolab-portal.ru/encyclopedia/565/43576/
Источник https://dr-md.ru/sagt.html
Источник https://probolezny.ru/tireoidit-de-kervena/