Анапластическая крупноклеточная лимфома. Cимптомы и прогноз лечения
Крупноклеточная анапластическая лимфома – это агрессивная и редкая онкопатология, которая поражает лимфатические узлы и неузловые места. Ее чаще всего выявляют у детей и молодых людей, преимущественно представителей сильного пола. Патология относится Т-клеточным неходжкинским лимфомам и занимает около 10% от общего числа данного заболевания. Первой линией борьбы с недугом является полихимиотерапия, на которую дают ответ примерно 90% пациентов. Подробнее о анапластической лимфоме, симптоматике болезни, методах лечения и прогнозах выживаемости – читайте в нашей статье.
Слушать статью:
Что такое анапластическая крупноклеточная лимфома?
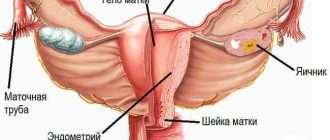
Анапластическая крупноклеточная лимфома (ALK) – рак лимфатической системы организма человека. Это – разновидность Т-клеточных неходжкинских лимфом. Болезнь чаще всего диагностируют у подростков и молодых людей. Второй пик заболеваемости приходится на возраст 60-70 лет. Преимущественно болеют лица мужского пола.
Т-клетки крови – основные “бойцы” иммунной системы. Они борются с бактериями, вирусами и прочими “врагами” организма, а также уничтожают собственные больные клетки тела. Онкологический процесс в Т-клетках подрывает иммунитет человека и снижает способность противостоять инфекциям.

Крупноклеточная анапластическая лимфома относится к группе CD30-положительных лимфопролиферативных патологий. Согласно классификации Всемирной организации здравоохранения, заболевание делится на 3 подтипа: позитивную анапластическую крупноклеточную лимфому (ALK +), отрицательную анапластическую лимфому (ALK -) и крупноклеточную анапластическую лимфому, связанную с установкой грудных имплантатов.
Первый вариант болезни больше встречается в детском и молодом возрасте, второй – у людей старше 40 лет, а третий – у женщин, проведших маммопластику. Все формы лимфомы разнятся клинически и прогностически.
Позитивная форма ALK отличаются от отрицательной наличием хромосомных перестроек гена в 2P23. Эти опухоли имеют более благоприятный прогноз, чем другие формы крупноклеточных анапластических лимфом. ALK, связанные с грудными имплантатами, представляют собою медленно прогрессирующую онкопатологию. Встречается крайне редко – в 2-4% случаев. Появление недуга может быть спровоцировано воспалительной реакцией на имплант.
Читать: Где лучше пройти лечение лимфомы за границей и сколько это стоит?
Симптомы анапластической крупноклеточной лимфомы
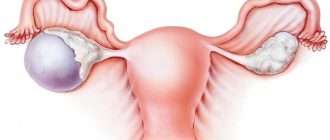
Общим признаком для всех подтипов анапластической лимфомы является увеличение и болезненность лимфатических узлов. Особенно поражаются лимфоузлы на шее и в подмышечной впадине. Также у пациентов отмечается потеря аппетита, лихорадка, кашель и одышка. Больные жалуются на повышенную усталость, зуд кожи, потерю веса и ночную потливость.
ALK может метастазировать в другие органы и системы организма. Излюбленные места распространения злокачественного процесса:
костная ткань,
костный мозг,
подкожно-жировая клетчатка,
ЖКТ,
легкие,
селезенка,
мягкие ткани,
печень.
Основные различия в клинической картине между ALK-отрицательными и ALK-позитивными лимфомами – области метастазирования заболевания. Для первой группы характерно распространение злокачественного процесса на кожу, печень и желудочно-кишечный тракт, а для второй – на кости, мягкие ткани, селезенку и костный мозг. При этом отрицательные лимфомы метастазируют чаще, чем позитивные.
Какие методы применяют для диагностики анапластической лимфомы?
Большинство случаев крупноклеточных анапластических лимфом выявляют на 3 или 4 стадии. Это связано с тем, что недуг долгое время никак не проявляет себя или маскируется под другие заболевания. Например, увеличенные лимфоузлы на шее, кашель и слабость могут принять за признаки обычной ОРВИ. Поэтому качественная и тщательная диагностика является залогом правильно подобранной тактики онкотерапии и успеха лечения.
Диагностика ALK включает в себя физический осмотр, гематологические и биохимические исследования, КТ всего тела или ПЭТ-КТ. Пациентам с метастазами в мозге и неврологической симптоматикой назначают МРТ, КТ и цитологическое исследование спинномозговой жидкости. Если лимфома затронула грудь, мягкие ткани, слюнные железы – проводят ультрасонографию.
При распространении патологии на костную ткань выполняют рентген и, если возможно, биопсию. У больных с поражением ЖКТ рекомендуется эндоскопическое обследование. Точное подтверждение диагноза возможно после биопсии с последующим микроскопическим исследованием образца лимфоидной ткани или костного мозга.
Для записи на диагностику лимфомы за границей, обращайтесь к врачам-координаторам MediGlobus. Наши специалисты подберут для Вас подходящую под Ваши требования, клинику.
Как лечат анапластическую крупноклеточную лимфому за рубежом?
Первой линией борьбы с анапластической крупноклеточной лимфомой является полихимиотерапия – лечение больных с помощью комплекса химиотерапевтических препаратов. Для взрослых пациентов с данным недугом назначают схемы CHOP или MACOP-B.
ТCHOP – прием 4-х противоопухолевых препаратов. Среди них: Циклофосфамид, Доксорубицин, Онковин и Преднизон. Они вводятся с интервалом 2-3 недели. Для достижения максимального терапевтического эффекта необходимо 6-8 циклов химиии.
MACOP-B – прием 6-ти химиотерапевтических препаратов. Среди них: Метотрексат, Доксорубицин, Циклофосфамид, Винкристин, Преднизон и Блеомицин. Для достижения наилучших терапевтических результатов нужно примерно 6 циклов химии.
Дети и подростки с анапластическими лимфомами обычно получают лечение в соответствии с протоколами лимфобластного лейкоза. Оно подразумевает 3 этапа борьбы с недугом.
Первоначально пациенты получают индукционную химиотерапию в течение 4-8 недель. Это необходимо для максимального уменьшения количества раковых клеток и достижения ремиссии. Закрепляют результаты при помощи консолидирующей химии несколькими препаратами. Заключительный этап длится от нескольких недель до 2 лет. В данный период пациенту назначают высокие дозы химии.
При крупноклеточной анапластической лимфоме также могут применять лучевую, таргетную или иммунную терапии. В запущенных случаях или частых рецидивах болезни рекомендуют пересадку костного мозга. Успешность ТКМ за рубежом превышает 92%.

Ведущие специалисты по лечению анапластической лимфомы за границей
Профессор Енер Коч
Топовый специалист Турции по лечению рака крови и лимфатической системы у взрослых. Доктор практикует в стамбульской клинике Медикана. Он является основателем Центра пересадки костного мозга. Под его руководством проведено около 2,000 ТКМ. Опыт его работы превышает 38 лет.
Профессор Битюль Тавил
Именитый турецкий онкогематолог с 24-летним опытом работы. Она принимает пациентов в клиниках Медистейт и Мемориал Аташехир. Доктор Бетюль Тавил занимается медикаментозным лечением лейкозов, Ходжкинских и неходжкинских лимфом, гемофилии, а также талассемии у детей.
Профессор Хосе Рифон Рока
Ведущий специалист Испании в области гематологии и онкогематологии. Доктор практикует в униклинике Наварры. Он занимает должность заведующего отделением пересадки костного мозга. Опыт работы доктора превышает 25 лет.
Профессор Арнон Наглер
Онкогематолог израильской больницы Хаима Шибы. Доктор занимается медикаментозным лечением лейкозов и лимфом. Он заведует Институтом онкогематологии, где проводит трансплантацию костного мозга.
Чтобы записаться к одному из лучших зарубежных специалистов по лечению анапластической лимфомы, оставляйте заявку на нашем сайте. Мы поможем с выбором доктора и организуем очную или дистанционную консультацию с ним в кратчайшие сроки.
Прогноз лечения анапластической крупноклеточной лимфомы
Прогнозы при анапластической лимфоме варьируют исходя из типа онкопатологии, распространения злокачественного процесса, ответа на лечение, возраста и состояния здоровья пациента. Общий показатель 5-летней выживаемости для больных с позитивными ALK составляет 70-86%, а для отрицательной формы онкопатологии – всего 30-49%.
Где за границей доступно лечение анапластической лимфомы?
Клиника Медистейт
Читать о клинике →

Больница Медикана
Читать о клинике →

Университетский госпитал Коч
Читать о клинике →

Клиника Лив Вадистанбул
Читать о клинике →

Клиника Текнон
Читать о клинике →

Медицинская сеть Кирон Салюд
Читать о клинике →

Госпиталь Хаима Шибы
Читать о клинике →

Клиника Ихилов
Читать о клинике →

Резюме
Анапластическая крупноклеточная лимфома – злокачественное заболевание лимфатической системы. Основным признаком болезни является увеличение и болезненность лимфатических узлов. Также у пациентов отмечается повышенная утомляемость, снижение аппетита, потеря веса, лихорадка, ночная потливость, кашель и одышка.
Первой линией лечения при анапластической лимфоме считается комбинированная химиотерапия. Также пациентам назначают облучение, таргетные или иммунные препараты. При тяжелых случаях онкопатологии показана трансплантация костного мозга.
Общий показатель 5-летней выживаемости при позитивной форме ALK составляет 70-86%, а при отрицательной – всего 30-49%.
Ведущие специалисты по борьбе с анапластической лимфомой за границей практикуют в турецких, испанских и израильских медицинских центрах. Среди них выделяются: Бетюль Тавил, Енер Коч, Хосе Рифон Рока и Арнон Наглер.
Для диагностики и онкотерапии данного заболевания пациенты чаще всего обращаются в следующие клиники: Коч, Медистейт, Медикана, Лив, Текнон, Шиба, Ихилов и университетскую больницу Наварры.
Чтобы записаться на лечение ALK за границей, жмите на кнопку ниже и заполняйте форму обратной связи. Наши координаторы перезвонят Вам и помогут с решением всех вопросов, касающихся медицинской поездки.
Мутации в гене ALK
Ген ALK кодирует белок, который называется рецепторной тирозинкиназой ALK. Его название — это англоязычная аббревиатура, которая расшифровывается как Anaplastic Lymphoma Kinase — киназа анапластической лимфомы. Этот ген был так назван, потому что изменения в нем, возникшие в результате хромосомной перестройки, были впервые обнаружены в 1994 году у пациентов с анапластической крупноклеточной лимфомой — злокачественной опухолью из лимфоидной ткани.
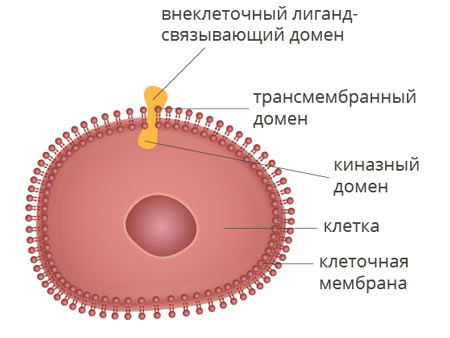
ALK — это онкоген, то есть ген, изменения в котором способствуют развитию злокачественной опухоли. В норме он играет важную роль в развитии нервной системы. Его активность высока у эмбрионов. После рождения она снижается, а у взрослых людей становится минимальной.
Какие функции выполняет ген ALK?
Рецепторная тирозинкиназа ALK — это фермент, белок с молекулярной массой 220 килодальтон. Он встроен в клеточную мембрану и передает сигналы в клетку извне. За счет этого активируются определенные биохимические процессы. Этот белок состоит из трех доменов (подструктур):
- Внеклеточный лиганд-связывающий домен находится снаружи. Он связывается с лигандами — определенными сигнальными молекулами. Это своего рода молекулярная антенна, которая принимает сигналы извне.
- Гидрофобный трансмембранный домен встроен в клеточную мембрану.
- Внутриклеточный киназный домен. Это фермент, который при активации вызывает в клетке те или иные эффекты.
После активации белка две молекулы киназы соединяются — происходит реакция димеризации. Затем происходит реакция фосфорилирования — к киназе присоединяется фосфатная группа, и она активируется. После этого фосфатная группа передается на другие белки внутри клетки, и происходит их активация. Запускается каскад биохимических реакций, который приводит к определенным эффектам. В передаче сигнала задействуются молекулярные пути RAS/MAPK и PI3K/ERK — они же участвуют в передаче сигналов другого белка — рецептора эпидермального фактора роста (EGFR). Ген, кодирующий этот белок, тоже является онкогеном, мутации в нем обнаруживаются при некоторых злокачественных опухолях.
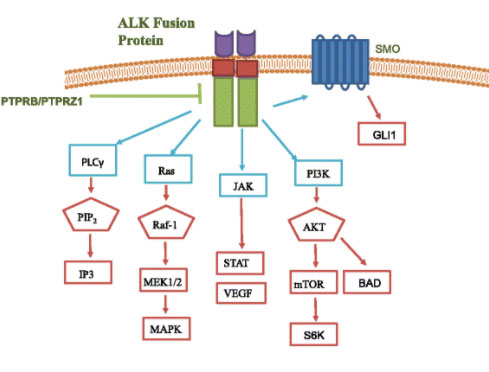
Сигнальный путь ALK. Обозначены молекулы, которые в нем участвуют. Эффекты: рост клеток, инвазия (вторжение в окружающие ткани), миграция, подавление апоптоза (клеточной смерти), ангиогенез (рост кровеносных сосудов).
В норме рецепторная киназа ALK играет важную роль в развитии и функционировании нервной системы, межклеточных коммуникациях — «общении» между отдельными клетками. В опухолевых клетках она чрезмерно активируется в результате различных генетических изменений.
Как происходят мутации, и чем это грозит?
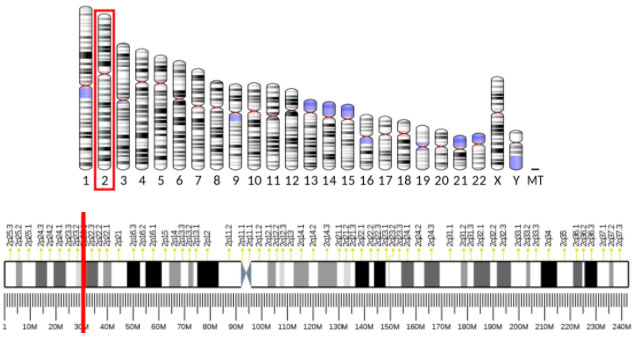
Ген ALK находится в коротком плече второй хромосомы, его локализация обозначается как 2p23:
Определенные генетические изменения приводят к активации сигнального пути ALK и молекул, регулирующих клеточное деление. В настоящее время известно 826 генетических дефектов, в которых задействован ген ALK. 45 из них являются связанными с определенными патологиями или находятся «под подозрением». Патологическая активация пути ALK может происходить разными способами:
- Хромосомные перестройки с образованием химерных генов — когда из двух генов образуется новый. В частности, ALK может образовывать химерные гены с генами MSN, TPM4, CLTC, KIF5B, SQSTM1, NPM1, TFG, ATIC, RANPB2, EML4.
- Увеличение копий ALK.
- Мутации, при которых меняется последовательность «букв» генетического кода внутри гена ALK.
При онкологических заболеваниях в гене ALK встречаются как соматические, так и наследственные мутации.
Соматические мутации происходят в течение жизни только в некоторых клетках тела в результате воздействия определенных негативных факторов. Во время очередного деления клетки в хромосомах или структуре ДНК могут возникнуть ошибки. В результате нормальная клетка становится злокачественной.
Наследственные мутации передаются от родителей, происходят в половых клетках. В дальнейшем они присутствуют во всех клетках тела. У такого человека повышен риск развития определенных типов злокачественных опухолей, и он может передать генетический дефект потомству.
С какими онкологическими заболеваниями связаны мутации в гене ALK?
В настоящее время известно, что изменения в этом гене встречаются не только при анапластической крупноклеточной лимфоме, но и при ряде других злокачественных опухолей: нейробластоме, немелкоклеточном раке легкого, почечно-клеточном раке, плоскоклеточном раке пищевода.
Мутации ALK при немелкоклеточном раке легкого
Генетические перестройки с участием ALK встречаются в 3–7% случаев при немелкоклеточном раке легкого. Причем, чаще всего эти мутации обнаруживаются у определенных категорий пациентов:
- люди, которые не являются курильщиками или курят редко, немного;
- больные молодого возраста;
- пациенты со злокачественными опухолями легких, которые по результатам гистологического исследования относят к аденокарциномам;
- женщины;
- известно, что мутации ALK практически никогда не встречаются вместе с мутациями EGFR и KRAS.
Например, в 13% случаев при аденокарциномах легкого присутствует транслокация (перемещение участка одной хромосомы на другую) и/или химерный ген EML4-ALK. Ген EML4 кодирует белок, подобный ассоциированному с микротрубочками иглокожих белку. Такая связь приводит к чрезмерной активации ALK.
В каких случаях назначают анализ на мутации ALK при раке легкого, и для чего это нужно?
В соответствии с рекомендациями Международной ассоциации по изучению рака легких (IASLC) и Европейского общества медицинской онкологии (ESMO), у всех пациентов с аденокарциномой легких на поздних стадиях необходимо проводить анализы на мутации ALK. Обычно их назначают вместе с анализом на мутации EGFR или после него, если он показал отрицательный результат.
Исследование на мутации ALK помогает разобраться, будет ли эффективно лечение таргетными препаратами — ингибиторами рецепторной тирозинкиназы ALK: кризотинибом (Ксалкори), церитинибом (Зикадия), алектинибом (Алеценза). Эти препараты помогают более успешно бороться с запущенным ALK-положительным немелкоклеточным раком легкого, повысить выживаемость.
Мутации в гене ALK при нейробластоме
Нейробластомами называют злокачественные опухоли из незрелых нервных клеток, нейробластов. Они могут развиваться в разных частях тела: головном мозге, нервной ткани шеи, грудной клетки, брюшной полости, таза, надпочечников. Чаще всего нейробластомы диагностируют у детей младше 5 лет. На данный момент известно по крайней мере 16 видов генетических дефектов с вовлечением гена ALK, которые встречаются у таких пациентов. Эти мутации могут быть как соматическими, при спорадических случаях заболевания, так и наследственными, связанными с наследственной формой нейробластомы.
Одна из наиболее распространенных мутаций ALK при нейробластоме — замена аминокислоты аргинина на глутамин в положении 1275. Она обозначается как Arg1275Gln или R1275Q и бывает как наследственной, так и соматической.
В некоторых случаях встречается увеличение копий гена ALK — амплификация. За счет этого он становится чрезмерно активным. Сигнальный путь постоянно находится во «включенном» состоянии, и ему больше не требуется стимуляции извне.
Мутации в гене ALK при анапластической крупноклеточной лимфоме
Анапластическая крупноклеточная лимфома (АККЛ) — редкая агрессивная разновидность неходжкинских периферических T-клеточных лимфом, злокачественных опухолей из лимфоидной ткани. Слово «T-клеточная» в названии говорит о том, что нарушение произошло в T-лимфоцитах, а «периферическая» — то, что эти клетки циркулируют в периферической крови. АККЛ составляет 3% от всех лимфом у взрослых и 10–20% у детей. Мутации в гене ALK при этом заболевании играют настолько важную роль, что они даже легли в основу его классификации на два подтипа: выделяют ALK-положительные и ALK-отрицательные АККЛ.
Наибольшее значение при анапластических крупноклеточных лимфомах имеют хромосомные изменения с образованием химерных генов. В 70–80% случаев при ALK-положительных АККЛ определяется химерный ген, образованный генами ALK и NPM. Последний кодирует нуклеофозмин — белок, который участвует в регуляции деления клеток, репарации («починки») ДНК, транскрипции (синтеза РНК на матрице ДНК) и стабильности генома. За счет соединения двух генов активность ALK сильно повышается.
В остальных 20–30% случаев формирование химерного антигена происходит с другими генами, такими как ALO17, TFG, MSN, TPM3, TPM4, ATIC, MYH9, CLTC.
Как выявляют мутации в гене ALK?
Генетические нарушения с вовлечением гена ALK можно выявить разными способами:
- Флуоресцентная гибридизация in situ (FISH) на данный момент является золотым стандартом. Во время этого анализа используют ДНК-зонды с флуоресцентными метками, которые связываются с измененными участками ДНК и помогают их обнаружить.
- Иммуногистохимический анализ, или иммуногистохимия (ИГХ) помогает обнаружить измененную тирозинкиназу ALK. Во время этого исследования изучают не ген, а белок. ИГХ допустимо использовать как альтернативу методу FISH. — современная технология, которая позволяет «прочитать» ДНК и обнаружить разные мутации. Обычно ее применяют при неоперабельном, метастатическом раке, когда не помогает ни одна схема лечения в рамках существующих протоколов. С помощью NGS можно обнаружить многие генетические дефекты, делающие опухолевые клетки чувствительными к тем или иным препаратам, и подобрать персонализированную терапию.
- Полимеразная цепная реакция. С помощью этого метода нужный участок ДНК многократно размножают «в пробирке» с помощью ферментов, после чего его можно легко обнаружить.
В «Евроонко» доступны все эти анализы. Мы сотрудничаем с ведущими российскими и зарубежными лабораториями, благодаря чему можем обеспечить максимально оперативную и точную диагностику. В нашей клинике применяются все оригинальные противоопухолевые препараты последних поколений, зарегистрированные на территории России, они всегда в наличии. Мы можем немедленно приступить к лечению в соответствии с современными международными протоколами, при необходимости подобрать для пациента персонализированную терапию.
Анапластическая крупноклеточная лимфома

Лимфомы представляют собой гетерогенную группу заболеваний, происходящих из клеток ретикулоэндотелиальной и лимфатической систем. Существует два основных вида лимфом:
- лимфома Ходжкина (лимфогранулематоз)
- неходжкинские лимфомы.
На 2017 г. в России было зарегистрировано
- 3117 случаев возникновения лимфогранулематоза
- 9883 случаев — неходжкинских лимфом, что составляет соответственно 0,51 и 1,6% от общей онкологической заболеваемости.
Лимфома Ходжкина встречается преимущественно у молодых пациентов, прогрессирует медленно и чаще всего хорошо поддается лечению.
Большинство неходжкинских лимфом состоит из В-лимфоцитов.
По степени злокачественности и темпам прогрессирования опухоли, а также в зависимости от ответа на стандартное лечение их можно условно разделить на
- вялотекущие и
- агрессивные.
К вялотекущим В-клеточным лимфомам относятся лимфомы
- из клеток маргинальной зоны,
- фолликулярная,
- лимфоплазмоцитарная и
- лимфоцитарная.
Наиболее распространенными вариантами агрессивных лимфом являются
- диффузная В-крупноклеточная,
- мантийноклеточная,
- первичная медиастинальная лимфомы,
- лимфома Беркитта.
Т-клеточные лимфомы встречаются реже, характеризуются большим клиническим разнообразием и имеют в большинстве случаев агрессивное течение.
Применительно к пластической хирургии первое упоминание о лимфоме у пациенток после аугментации молочной железы было представлено 20 лет назад, когда была описана потенциальная связь между образованием лимфомы и имплантатами молочных желез [2], однако только недавно заболевание вызвало волну беспокойства среди врачей, общественности и средств массовой информации.
Анапластическая крупноклеточная Т-лимфома относится к подгруппе анапластических крупноклеточных лимфом (Anaplastic large cell lymphomas — ALCL), составляющей 2% от всех недавно диагностированных неходжкинских лимфом в мире, также туда входят еще три основных варианта, описанных в литературе: две различные формы системной ALCL
- анапластическая киназа-позитивная (Anaplastic lymphoma kinase+ — ALK+) и
- киназа-негативная (ALK−) лимфома, а также
- первичная кожная ALCL, которую следует отличать от поражения кожи при системной ALCL.
По данным литературы, ранние стадии имплантат-ассоциированной лимфомы (Breast Implant-Associated ALCL — BIA-ALCL) сходны с лимфопролиферативным расстройством, возникающим при выпоте вокруг текстурированного имплантата молочной железы, и могут прогрессировать до инвазивной лимфомы с инфильтрацией фиброзной капсулы, образованием опухолевых масс и регионарными/отдаленными метастазами.
Современное состояние проблемы
В августе 2012 г. Американское общество пластических хирургов (American Society of Plastic Surgeons — ASPS), Фонд пластической хирургии (Plastic Surgery Foundation — PSF) и Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (Food and Drug Administration —FDA) подписали соглашение о совместных исследованиях и разработках, направленное на развитие инфраструктуры, в которой были бы централизованно собраны все случаи BIA-ALCL. Результатом этой совместной работы стал Реестр пациентов и результаты лечения имплантат-ассоциированной анапластической крупноклеточной лимфомы, этиология и эпидемиология (Patient Registry and Outcomes For breast Implants and anaplastic large cell Lymphoma etiology and Epidemiology — PROFILE).
В 2016 г. Национальная комплексная сеть по борьбе с раком (National Comprehensive Cancer Net- work — NCCN) разработала принципы диагностики и лечения BIA-ALCL. Руководство NCCN по BIA-ALCL было впоследствии признано FDA, а также национальными обществами пластической хирургии.
По оценкам разных авторов, заболеваемость BIA-ALCL варьирует от 0,1 до 0,3 на 100 000 женщин с грудными имплантатами в год. При этом 1 из 500 000 женщин с текстурированными грудными имплантатами рискует заболеть через 1 год после вмешательства.
Недавние исследования в Австралии и Новой Зеландии выявили резкий рост заболеваемости BIA- ALCL. В общей сложности 56 случаев BIA-ALCL были подтверждены к 2017 г., еще 26 новых случаев были диагностированы в период с января 2017 г. по апрель 2018 г. Заболеваемость была впоследствии пересмотрена с 1 на 300 000 до 1 на 1000—10 000 женщин с имплантатами.
В январе 2018 г. было зафиксировано 414 сообщений о случаях BIA-ALCL, из них 9 с летальным исходом. К февралю 2018 г. было зарегистрировано 518 больных BIA-ALCL в 25 странах, в том числе 194 в США. Согласно данным от апреля 2018 г., во всем мире число больных возросло до 570, включая 16 смертей.
По состоянию на 1 декабря 2018 г. реестр PROFILE включал сведения о более чем 250 пациентах с BIA-ALCL, а ASPS отследило в общей сложности более 573 случаев, в том числе 33 с летальным исходом.
Самые последние данные о количестве диагностированных случаев представлены в настоящее время на сайте ASPS. На 3 сентября 2019 г. зарегистрировано 779 пациентов по всему миру.
Анализ случаев возникновения BIA-ALCL, проведенный G. Brody и соавт., выявил существенную вариабельность заболеваемости во всем мире — с самой низкой относительной заболеваемостью в еврозоне, Китае и Бразилии. В настоящее время наибольший зарегистрированный уровень заболеваемости наблюдается в Австралии и Новой Зеландии (1/2832 в зависимости от типа имплантата). В скандинавских странах до недавнего времени практически не было сообщений о случаях BIA- ALCL. Интересно, что, по данным производителей, 70—80% имплантатов, продаваемых в Европе, текстурированы. Следовательно, можно предположить, что, как и в случае большинства опухолевых заболеваний, генетическая предрасположенность и этническая принадлежность при BIA-ALCL могут играть важную роль.
Согласно обзору мировой литературы, наибольшая заболеваемость присуща странам, в которых существуют государственные регистры пациентов с BIA-ALCL, например США, Австралии, Франции, Италии и Великобритании. Видимо, это связано преимущественно с тем, что происходит стандартизированный сбор данных обо всех имплантатах, а также случаях их удаления или замены. С другой стороны, наличие регистров косвенно указывает на высокий уровень осведомленности медицинского сообщества этих стран о проблеме BIA-ALCL. Возможно, до настоящего времени не существует реального представления о распространенности BIA-ALCL среди женщин с имплантатами молочных желез.
Следуя рекомендациям FDA США, в 2011 г. производители имплантатов добавили предупреждение о риске возникновения BIA-ALCL на вкладыши упаковок грудных имплантатов. Всем пациентам, которым планируется эндопротезирование молочных желез, необходимо подписать информированное добровольное согласие, которое преследует три основные цели:
- информирование пациентов о существовании этого редкого заболевания;
- объяснение пациенту распространенных симптомов, таких как появление опухолевых масс в молочных железах и возникновение перипротезного выпота;
- настойчивую рекомендацию пациентам срочно обратиться к врачу в случае появления этих симптомов.
Этиология заболевания
В свете последних исследований предполагается, что наиболее вероятно риск заболевания BIA-ALCL напрямую связан с текстурой поверхности имплантата молочной железы и наиболее высок у генетически предрасположенных женщин. Текстурированные имплантаты подвержены образованию на их поверхности биопленок, представляющих собой сообщества бактерий, которые образуются на поверхности раздела фаз, например твердое вещество/ жидкость. Бактерии биопленки примечательны тем, что окружены слизисто-полимерным матриксом из продуцируемых ими внеклеточных веществ и чрезвычайно устойчивы к воздействию ультрафиолетового излучения, дегидратации и вирусам, антибиотикам и факторам иммунной защиты.
M. Kadin и соавт. выдвинули гипотезу, что BIA-ALCL связан с хронической бактериальной стимуляцией Th1/Th17- антигенуправляемых T-клеток памяти в тканях перипротезной капсулы и, как следствие, устойчивой пролиферацией T-клеток с последующими генетическими событиями в патогенезе BIA-ALCL. H. Hu и соавт. сравнили капсулы имплантатов пациентов с BIA-ALCL и капсулярной контрактурой, обнаружив более высокую бактериальную нагрузку и значительно отличающийся микробиом в образцах BIA- ALCL. Авторами было выявлено большое количество бактерий Ralstonia pickettii (распространенный грамотрицательный загрязнитель питьевой воды), которые, возможно, играют не последнюю роль в этиологии заболевания, что еще предстоит выяснить.
Первоначальное понимание патогенеза и молекулярных факторов BIA-ALCL было получено с помощью проточной иммуногистохимической (ИГХ) цитометрии и функциональных экспериментов при описании иммунофенотипов клеточных линий, полученных из опухолей пациентов. Клетки BIA-ALCL демонстрировали положительное окрашивание на CD30 (белок клеточной мембраны), которое при наличии анапластической цитоморфологии и соответствующей клинической картины следует считать отличительной чертой BIA-ALCL. В норме пул CD30+ T-клеток составляет от 0,1 до 5% всех циркулирующих T-клеток, а при воспалительных состояниях организма их концентрация может существенно повышаться.
Повышенная экспрессия CD30 может быть индуцирована как на Т-клетках, так и на В-клетках в результате вирусной инфекции. Описано, что CD30+-лимфоциты способны временно увеличиваться с фонового уровня 0,1 до 95%. Другими Т-клеточными антигенами, экспрессируемыми в злокачественных клетках, являются CD3, CD4/8, CD5 и CD7. В большинстве случаев BIA- ALCL-опухолевые клетки при проведении ИГХ-исследования положительно окрашиваются на множественную миелому 1 (MUM1) (интерферон-регу-ляторный фактор 4).
Геномная характеристика BIA-ALCL показывает сходные молекулярные аномалии с ALK-негативной системной анапластической крупноклеточной лимфомой (sALCL), включая активацию JAK/STAT и дисрегуляцию MYC/TP53, однако клинически заболевание протекает гораздо менее агрессивно. Другие исследования также отметили случаи возникновения BIA-ALCL у женщин с приобретенными JAK/STAT-мутациями зародышевой линии и, кроме того, связь заболевания с синдромом Ли—Фраумени, который возникает при наличии мутации онкогена p53. В таких случаях реконструкция молочной железы с использованием текстурированных грудных имплантатов у женщин после мастэктомии по поводу рака молочной железы совершенно нецелесообразна.
Влияние текстуры имплантата на риск возникновения заболевания
Текстура поверхности имплантата варьирует в зависимости от производителя и обычно может классифицироваться как
- макротекстурированная — полиуретан и Biocell («Allergan plc», Ирландия),
- с промежуточной текстурой («TRUE Texture»; «Sientra», США)
- с микротекстурированием (Siltex, «Mentor Worldwide», США).
Агрессивные макротекстурированные имплантаты (полиуретан и Biocell) демонстрируют более высокое количество перипротезных бактерий, чем микротекстурированные (Siltex и Poly Implant Prothèse), и, как следствие, более высокий T-клеточный ответ. Это логично, учитывая, что более агрессивное текстурирование обеспечивает пространство для роста бактерий.
По данным некоторых исследователей, риск развития BIA-ALCL примерно в 16,5 раза выше для Biocell и в 23,4 раза — для имплантатов из полиуретана («Silimed», Бразилия) по сравнению с Siltex- текстурой, если принять ее за единицу (табл. 1).

Макротекстурированные (или с большой площадью поверхности) имплантаты Biocell («Allergan, Inc.», США) производят с помощью «технологии потери соли», при которой оболочка имплантата прижимается к слою соли. В отличие от них микротекстурированные имплантаты Siltex (или текстурированные с низкой площадью поверхности) («Mentor Worldwide», США) изготавливают посредством обратного негативного импринтинга с текстурированной пеной, при этом получается менее агрессивная форма текстурирования .
Компания «Allergan» в 2019 г. полностью отозвала с рынка линейку макротекстурированных имплантатов Biocell. Однако окончательные выводы о роли конкретного вида имплантата в заболеваемости BIA- ALCL делать пока рано.
Диагностика заболевания
По данным регистра PROFILE, на основании анализа 89 полностью документированных случаев, наиболее частым симптомом BIA-ALCL является
- перипротезная серома — у 73 (85,9%) пациентов.
- капсулярная контрактура имела место у 28 (32,9%) больных, чаще всего III или IV степени.
- пальпируемые опухолевые массы в молочной железе были обнаружены только в 13 (15,7%) случаях.
- боль, повреждения кожи и покраснение встречались реже, но все же присутствовали.
Системные симптомы включали
- лихорадку,
- ночную потливость,
- потерю массы тела,
- поражения кожи вне области молочных желез.
У 2 (2%) пациентов на момент постановки диагноза симптомы отсутствовали.
У 2/3 пациентов с BIA-ALCL развивалась поздняя серома — в среднем через 8—10 лет после протезирования. Следовательно, любая серома, возникающая более чем через 1 год после протезирования, не поддающаяся объяснению инфекцией или травмой, должна рассматриваться как возможный признак заболевания. У 1/3 пациентов наблюдали опухолевые массы, которые указывали на более агрессивное клиническое течение.
По данным других источников литературы, у 8—24% пациентов определялась пальпируемая опухолевая масса, у 4—12% — лимфопатия. Реже (1 года), а также болевого синдрома, пальпируемых образований в молочной железе, отека или асимметрии груди.
B. Adrada и соавт. рассмотрели 44 cлучая BIA-ALCL с использованием различных методов визуализации. Они сообщили о чувствительности и специфичности при выявлении выпота с помощью
- ультразвука в 84 и 75% случаев соответственно,
- компьютерной томографии (КТ) в 55 и 83%,
- магнитно- резонансной томографии (МРТ) в 82 и 33%,
- позитронно-эмиссионной томографии (ПЭТ)/КТ в 38 и 83%.
Чувствительность и специфичность при определении опухолевой массы методом
- УЗИ — 46 и 100%,
- КТ — 50 и 100%,
- МРТ — 82 и 33%,
- ПЭТ/КТ — 64 и 88%.
Было обнаружено, что чувствительность метода маммографии является низкой для визуализации как выпота, так и опухолевых масс и, следовательно, не считается приемлемым методом визуализации при диагностике BIA-ALCL. Исходя из этих данных, УЗИ используется в качестве скринингового метода, тогда как ПЭТ/КТ применяется после установления диагноза, для обследования перед операцией.
Первый этап диагностики должен включать УЗИ для забора перипротезной жидкости, тонкоигольной биопсии опухолевых масс и увеличенных региональных лимфатических узлов. За вовлечением в процесс подмышечных (93%) лимфатических узлов чаще всего следует увеличение внутренних грудных и надключичных лимфоузлов, тогда как поражение нерегиональных групп лимфатических узлов встречается очень редко.
Аспирация тонкой иглой является оптимальной для забора проб перипротезной жидкости. Во время аспирации для аккуратного смещения и защиты имплантата можно применять УЗИ. Для диагностики заболевания следует собрать как можно больше жидкости (минимум 50 мл). Перипротезная жидкость при BIA-ALCL обычно более вязкая, чем доброкачественная серома, из-за более высокого содержания белка и клеточности.
Образцы жидкости не требуют хранения в каких-либо специализированных средах и должны быть доставлены в лабораторию в течение 48 ч. Хотя клетки могут лизироваться, если их оставить на длительный период, диагностические белковые маркеры в опухолевых клетках не разрушаются, вследствие чего диагностика возможна по фиксированным клеточным блокам спустя годы.
Оценка тонкоигольной аспирации затрудняется после серии предыдущих пункций, поскольку титр опухолевых клеток в пунктате может быть искусственно снижен. Наличие опухолевой массы требует проведения биопсии. Образцы необходимо отправлять на морфологическое цитологическое исследование с использованием цитометрии и ИГХ для количественного определения Т-клеток в образце и определения экспрессии CD30. ИГХ-исследование CD30 является основополагающей частью диагностических тестов, однако само по себе непатогномонично, поскольку экспрессия CD30 неспецифична. Антиген CD30 может экспрессироваться на доброкачественных воспалительных клетках. Редкие CD30+-лимфоциты с нормальной морфологией считаются нормальными и не требуют дальнейшего исследования.
После установления диагноза BIA-ALCL врачу настоятельно рекомендуется провести консилиум по конкретному пациенту для определения тактики лечения. Пациентам с агрессивной локальной инвазией или метастазированием в лимфатические узлы рекомендуется выполнить биопсию костного мозга, чтобы исключить вариант системной ALCL.
Всем пациентам с подтвержденной BIA-ALCL следует назначить предоперационное сканирование с помощью метода ПЭТ/КТ, который является оптимальным при визуализации ассоциированных капсулярных масс, инвазии грудной стенки, регионарной лимфаденопатии и/или метастазирования в отдаленные органы. От полученных данных будут зависеть стратегия резекции и сроки операции.
Стадирование заболевания
В ранних публикациях предполагалось, что BIA- ALCL является бинарным заболеванием, представленным либо ограниченным выпотом, либо инвазивной массой. В настоящее время BIA-ALCL классифицируется как лимфома при любом проявлении заболевания (опухолевые массы или серома). Несмотря на то что BIA-ALCL развивается очень медленно и редко имеет генерализованную симптоматику, она является злокачественным заболеванием на любой стадии.
Неходжкинская лимфома традиционно диагностируется с использованием системы стадирования Ann Arbor в модификации Lugano.

Относительно BIA-ALCL установлено, что стадия болезни IE ограничена только поражением молочной железы или капсулы имплантата, а стадия IIE включает поражение молочной железы и ипсилатеральных подмышечных лимфатических узлов. При применении этой классификации почти все пациенты с BIA-ALCL имеют заболевание начальной стадии: либо IE (от 83 до 96%), либо IIE (от 3,6 до 18,8%).
Из-за ограниченности системы стадирования Ann Arbor, которая не учитывает инвазию капсулы, NCCN в настоящее время использует недавно предложенную систему стадирования центра M. Anderson (M. Anderson Cancer Center) — TNM. Согласно этой системе, BIA-ALCL представляет собой заболевание, подразделяющееся на стадии
- IA (35,6%),
- IB (11,5%),
- IC (13,8%),
- IIA (25,3%),
- IIB (4,6%),
- III (9,2%),
- IV (0—9%).


По результатам исследования M. Clemens и соавт. с участием 87 пациентов с BIA-ALCL, общая выживаемость через 3 года после операции составила 94%, через 5 лет — 91%. В рамках этого исследования стадирование по TNM более точно предсказывало выживаемость и частоту рецидивирования BIA- ALCL, чем система стадирования А (p=0,01).
Лечение
NCCN определила стандарт медицинской помощи пациентам с BIA-ALCL, который включает хирургическое лечение, в том числе
- удаление имплантатов,
- полную капсулэктомию,
- резекцию любых ассоциированных опухолевых масс и вовлеченных лимфатических узлов в пределах здоровых тканей.
Пациенты с подтвержденной BIA-ALCL в идеале должны быть направлены к онкологу перед любым хирургическим вмешательством. Дополнительное лечение пациентов, у которых отмечается прогрессирование заболевания после операции либо при поражении лимфатических узлов или экстралимфатических органов, а также в случае неоперабельной опухоли, включает комбинированную химиотерапию на основе антрациклина или как альтернативу применение целевой иммунотерапии препаратом брентуксимаб-ведотин.
В исследовании M. Clemens и соавт., включающем 87 пациентов с BIA-ALCL, о котором было упомянуто выше,
- только хирургическое вмешательство получали 40% больных;
- хирургическое лечение и лучевую терапию — 9%;
- хирургическое лечение и химиотерапию —19%;
- хирургическое лечение, химиотерапию и лучевую терапию — 30%;
- только химиотерапию —2%.
Как наличие опухолевых масс во время постановки диагноза, так и экстракапсулярное распространение заболевания было связано с повышенным риском рецидива и смерти пациента. При среднем сроке наблюдения 45 мес у 28% пациентов был обнаружен местный рецидив. В настоящее время в Австралии, Бразилии, Франции, Великобритании, Нидерландах, Новой Зеландии и Швеции в общей сложности 33 пациента умерли от BIA-ALCL.
Причиной, приводящей к развитию тяжелых состояний и связанных с ними летальных исходов, чаще всего являются несвоевременная диагностика и/или химиотерапевтическое лечение заболевания с неадекватным объемом резекции или вовсе без хирургического вмешательства.
Отсюда следует чрезвычайно важный вывод, что для лечения BIA-ALCL необходимы своевременная диагностика и полное хирургическое иссечение капсулы и опухолевых масс с чистыми краями резекции. Только хирургическое вмешательство увеличивает общую и безрецидивную выживаемость по сравнению с терапевтическими методами лечения.
Было отмечено, что BIA-ALCL может проявлять гиперпрогрессию — это онкологический феномен, означающий очень быстрое развитие опухоли при неполном удалении. С другой стороны, в настоящее время нет показаний для радикальной мастэктомии или расширенной лимфодиссекции. Поскольку капсула имплантата может дрени- роваться в несколько региональных бассейнов лимфатических узлов, биопсия сторожевых лимфатических узлов не имеет смысла.
Ряд авторов рекомендуют выполнять эксцизионную биопсию любого подозрительного лимфатического узла. Приблизительно у 2—4% пациентов заболевание развивается билатерально, поэтому хирурги могут рассмотреть возможность удаления контралатерального имплантата и капсулы. Полная резекция опухолевых тканей обеспечивает долговременную безрецидивную выживаемость.
Если злокачественные клетки локализованы исключительно в капсуле (Lugano I—IIЕ, M. Anderson Cancer Center IA—IIA), можно лечить заболевание исключительно хирургическим путем. По сравнению со стадией I частота рецидивирования при стадии II в 2,6 раза выше, при стадии III в 2,7 раза. Частота рецидивирования после полного хирургического удаления составляет 14,3% для пациентов со стадией T4 и 0% для пациентов со стадиями T1—T3.
Локальный рецидив наиболее вероятен после неполной резекции или частичной капсулэктомии. Неоперабельная опухоль или неполностью иссеченная капсула, вероятнее всего, потребуют адъювантного лечения. Остается неясным, какое влияние на местное рецидивирование оказывает непреднамеренная утечка серомы во время капсулэктомии.
Пациентам с неполной капсулэктомией, положительным краем резекции или неоперабельной опухолевой массой и инвазией в грудную стенку рекомендуется местная лучевая терапия от 24 до 36 Гр. Системная терапия оправдана у пациентов со стадиями II—IV по классификации Lugano или стадиями IIB—IV по классификации TNM. Онкологи могут использовать либо стандартный подход, как при лечении системной ALCL (рекомендации NCCN для терапии первой линии периферической Т-клеточной лимфомы), а именно комбинированную химиотерапию на основе антрациклина (циклофосфамид, винкристин, доксорубицин и преднизон), либо как альтернативу комбинацию с ведотином брентуксимабом.
При лечении BIA-ALCL в исследованиях была продемонстрирована хорошая эффективность брентуксимаба-ведотина, а комбинация химиотерапии антрациклином и брентуксимабом- ведотином в исследовании ECHELON II показала наилучшие результаты в отношении выживаемости. На основании результатов исследования ECHELON II добавление брентуксимаба в схему химиотерапии при лечении периферических Т-клеточных лимфом в настоящее время считается предпочтительным. Брентуксимаб-ведотин также может использоваться в качестве неоадъювантной химиотерапии для снижения инвазии в грудную стенку.
Замена имплантатов на гладкие может быть рассмотрена в зависимости от предпочтений пациента. Из-за вероятной генетической предрасположенности замена имплантатов на текстурированные нецелесообразна.
После операции пациентам необходимо находиться под наблюдением онколога, который может отслеживать рецидивирование заболевания и оценивать необходимость дополнительной терапии. Пациенты должны проходить осмотр каждые 3—6 мес в течение 2 лет, а затем в соответствии с клиническими показаниями. В качестве метода визуализации на послеоперационном этапе можно использовать КТ или ПЭТ КТ (наличие очагов повышенной метаболической активности) каждые 6 мес в течение 2 лет.
Обсуждение
Опираясь на данные о росте заболеваемости BIA- ALCL, можно сделать два вывода.
- Первый состоит в том, что с увеличением всеобщей осведомленности растет и количество диагностированных случаев. Пластические хирурги и сами пациенты стали более настороженно относиться к любым симптомам, подозрительным на BIA-ALCL.
- Второй вывод касается создания регистров. Именно благодаря всемирным и государственным регистрам учета заболеваемости удалось объединить и обработать информацию о пациентах, причинах BIA-ALCL, прогнозах и лечении. Учитывая редкость заболевания, каждый диагностированный случай имеет особую ценность и должен быть донесен до научного сообщества и проанализирован.
Во Франции, Сингапуре, Канаде и некоторых других странах власти уже приостановили действие лицензий на макротекстурированные грудные имплантаты. В США же, согласно заявлению заместителя первого комиссара FDA Эми Абернети, решено пока ограничиться добавлением предупреждения о риске BIA-ALCL на вкладыши текстурированных имплантатов. Более радикальные действия будут предприняты лишь после получения полной информации о заболевании.
Интересно, что описано 4 случая, когда диагноз BIA-ALCL был поставлен пациенту с гладкой оболочкой имплантата, однако у всех 4 пациентов в анамнезе было проведено эндопротезирование молочных желез с использованием текстурированного имплантата. В исследовании PROFILE при анализе данных 89 пациентов среднее время от эндопротезирования до диагностики заболевания составило 9,0 года.
Согласно последним данным, демонстрирующим возможный патогенетический механизм стимуляции Т-клеток при хроническом воспалительном процессе у генетически предрасположенных женщин, эксперты рекомендуют серьезно рассмотреть 14 пунктов, предложенных A. Deva и соавт.:
- Используйте внутривенную антибиотикопрофилактику во время операции.
- Избегайте периареолярных/трансаксиллярных разрезов.
- Используйте асептическую защиту для сосков, чтобы предотвратить попадание бактерий в карман.
- Выполняйте атравматическую диссекцию, чтобы минимизировать деваскуляризацию тканей.
- Проведите тщательный проспективный гемостаз.
- Избегайте расслоения паренхимы молочной железы.
- Используйте двухплоскостной карман.
- Выполните орошение кармана раствором бетадина в комбинации с антибиотиком.
- Выполните действия по минимизации загрязнения кожи.
- Минимизируйте время вскрытия имплантата и замены имплантата или сайзера.
- Замените хирургические перчатки перед установкой имплантата и используйте новые или очищенные инструменты и простыни.
- Избегайте использования послеоперационных дренажей, которые могут быть потенциальным местом проникновения бактерий.
- Используйте многослойное ушивание раны.
- Используйте послеоперационную антибиотикопрофилактику.
Двенадцатый пункт является спорным, поскольку врастание фиброзной ткани в поры текстурированного имплантата может снизить вероятность образования биопленок и размножения бактерий, а этот процесс ускоряется при создании отрицательного давления в перипротезном кармане. Отрицательное давление может обеспечить только активная дренажная система. Кроме того, было продемонстрировано, что кровь может увеличить образование эндопротезных биопленок. Этим подчеркивается необходимость ликвидации жидкости вокруг имплантата с помощью дренажной системы.
Заключение
Анапластическая крупноклеточная имплантат-ассоциированная Т-клеточная лимфома, или BIA-ALCL, является медленнопрогрессирующим злокачественным заболеванием, которое связано с хроническим воспалением вокруг оболочки текстурированного имплантата и клональной активацией Т-лимфоцитов. Этот вид лимфомы всегда является киназа-негативным (ALK−) и имеет иммуногистохимический маркер СD30, который присущ большинству неходжкинских лимфом и должен рассматриваться в соответствии с анамнезом заболевания и полной клинической картиной. Сочетание этих факторов должно быть ориентиром для патоморфологов.
Технически диагностика BIA-ALCL не составляет проблем, однако крайне затруднена в связи с низкой осведомленностью врачей об этом заболевании. Во всем мире уже разработаны информированные добровольные согласия для пациентов, главной целью которых является повышение онконастороженности пациентов и врачей для наиболее ранней диагностики заболевания. На ранних стадиях BIA-ALCL имеет благоприятный прогноз и зачастую требует исключительно хирургического лечения.
Несомненно, это заболевание требует дальнейшего изучения. Особенно интересны генетические предпосылки возникновения BIA-ALCL.
На сегодняшний день главной задачей является повышение уровня осведомленности врачей и пациентов о BIA-ALCL, возможно, полный отказ от макротекстурированных имплантатов, а также профилактика бактериального загрязнения при установне эндопротеза.
Авторы заявляют об отсутствии конфликта интересов. The authors declare no conflicts of interest.
Источник https://mediglobus.com/ru/anaplastic-large-cell-lymphoma-symptoms-and-treatment-prognosis/
Источник https://www.euroonco.ru/terms-from-a-z/mutatsii-v-gene-alk
Источник https://markushin.ru/uvelichenie-grudi/anaplasticheskaya-krupnokletochnaya-limfoma