Медные люди: что важно знать о болезни Вильсона-Коновалова
Откуда берется медь в нашем организме и зачем она нужна? Из-за чего возникает болезнь, при которой медь не выводится из тела самостоятельно, и почему она опасна? Как живут люди, у которых меди слишком много, и чем медицина может им помочь?
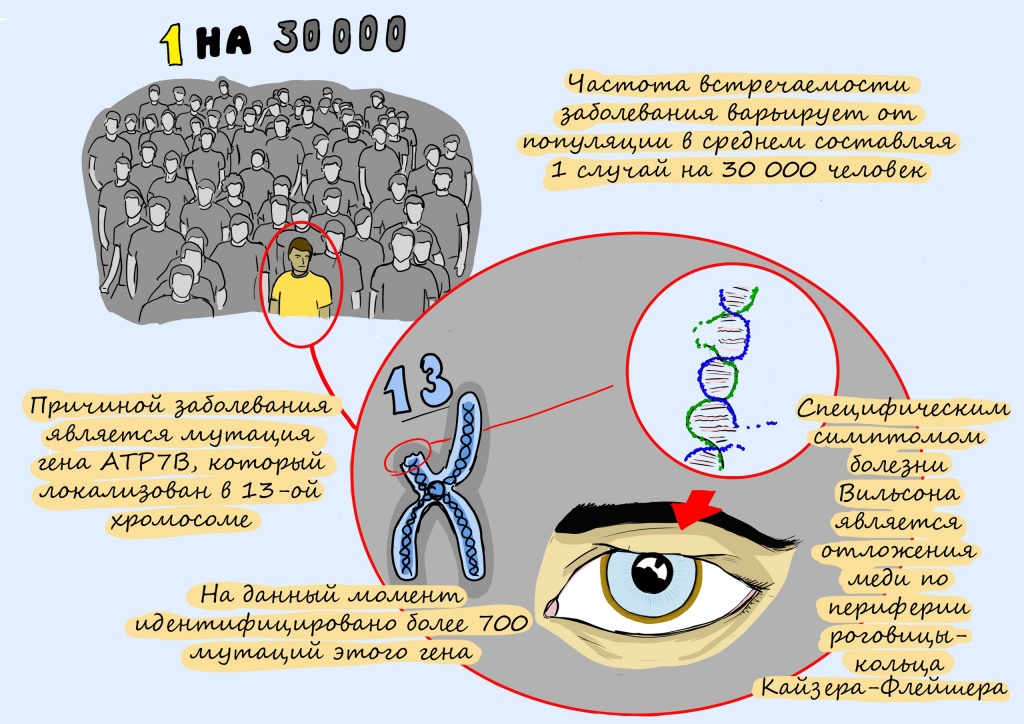
Вместе с информационно-просветительским гуманитарным проектом «12 месяцев» мы запускаем серию материалов о редких (орфанных) генетических заболеваниях и жизни людей с ними. Читайте в ноябре рассказ о болезни Вильсона-Коновалова, которая встречается у одного из 30 тысяч человек, а также историю «медного пациента» — 38-летней Олеси Фрерихс, которая узнала о заболевании на 7 месяце беременности.
- Вероятность встретить редкого пациента у обычного врача ничтожно мала — в России редким (орфанным)считаетсязаболевание, которое обнаруживается у одного из 10 тысяч человек. В академических аудиториях им не уделяют должного внимания, а в повседневной профессиональной практике это приводит к диагностическим ошибкам, упущенному времени и поломанным судьбам.
- Информационно-просветительский гуманитарный проект «12 месяцев» — цикл материалов о редких (орфанных) заболеваниях и жизни людей с ними — реализуют студенты и ординаторы кафедры патологической анатомии Северо-Западного государственного медицинского университета имени И. И. Мечникова (Санкт-Петербург). Они изучают генетические методы диагностики и лечения, учатся разбираться в сложных вопросах медицины и рассказывать о них, находить общий язык с редкими пациентами и их родителями, работать в мультидисциплинарной команде.
Как связаны медь, гены и болезнь Вильсона-Коновалова?
Ежедневно наш организм получает с пищей не только белки, жиры, углеводы и витамины — в него поступает множество ионов металлов и других микроэлементов, необходимых для его правильного функционирования. Например, медь, которая содержится в печени и мясе, какао и бобовых, злаках и орехах.
Несмотря на небольшую суточную потребность — всего 1,5-2,5 мг, медь участвует в обмене энергии, метаболизме железа, защите клеточных мембран — то есть практически во всех физиологических процессах в нашем теле.
Обмен меди, как и многие другие индивидуальные особенности организма генетически запрограммированы, то есть заложены в нас при рождении. Гены — это всего лишь инструкции для синтеза белков в рибосомах. Один ген — один белок, все достаточно просто. А вот какую функцию будет выполнять этот белок — зависит от его структуры.
Некоторые белки участвуют в метаболизме меди. У всех людей всасывание меди происходит в желудке и двенадцатиперстной кишке. Дальше медь транспортируется в печень, где соединяется с различными белками, затем ее часть выводится в связанном состоянии в кровь и уже после — в мочу и кал.
Чтобы меди в организме было всегда ровно столько, сколько нужно, метаболизм регулирует и выравнивает скорости ее поступления и выведения наружу.
Ключевую роль в этом уравнении играет белок-транспортер меди под названием ATP7. Он работает исправно, если в его гене, в инструкции по его сборке, нет опечаток — или мутаций, как их называют биологи. Известно уже более 800 таких опечаток в гене АТР7.
Именно из-за этих мутаций у некоторых людей белок ATP7 не работает вовсе или его функция заметно снижена. В этом случае излишки меди не выводятся из организма, а накапливаются в органах. Но много — не всегда значит хорошо. Избыток металла не дает пациентам с неработающим белком ATP7 повышенную крепкость организма, а напротив — повреждает клеточные структуры. От избытка меди прежде всего страдает головной мозг и печень.
Такую болезнь, вызванную накоплением меди в организме из-за мутации белка ATP7, называют болезнью Вильсона — по имени Сэмюэля Уилсона (Вильсона) — британского невролога, подробно описавшего симптомы заболевания в 1912 году.
В России более распространено другое название — болезнь Вильсона-Коновалова: в 1960 году советский невропатолог Николай Коновалов существенно расширил понимание болезни. Еще реже можно встретить тройное название — Вильсона-Вестфаля-Коновалова (немецкий патолог Карл Фридрих Вестфаль описал болезнь еще в 1883 году). Сами пациенты называют себя вильсонятами.
В этом ролике — краткая история открытий на пути к познанию природы этой болезни и способов помочь пациентам.
Когда появляются симптомы и какими они могут быть?
Первые симптомы болезни Вильсона-Коновалова обычно появляются на втором или третьем десятке лет жизни в виде неврологических нарушений, например, нечеткости речи, нарушении глотания, автоматических жевательных движений, и нарушений показателей работы печени.
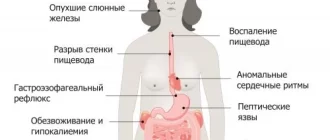
Болезнь умеет маскироваться: она может начаться как диспепсия (боль в верхнем отделе живота) или нарушение двигательной функции и речи. И даже самый запоминающийся ее признак — медное кольцо вокруг роговицы можно обнаружить только у половины больных.
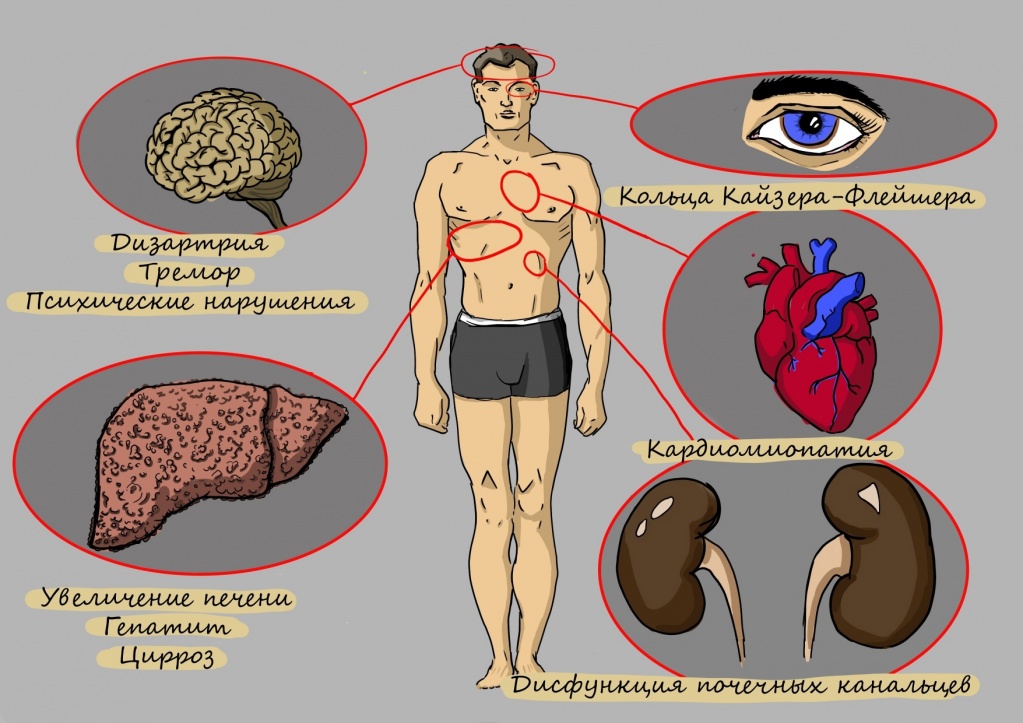
В теле не остается ни одного органа, равнодушного к нарушению обмена меди.
Но точная диагностика этого заболевания обычно представляет собой большую проблему. Биохимическое исследование показателей обмена меди в крови считается информативным, однако достоверно подтвердить мутацию можно только при помощи генетического анализа.
Чем медицина может помочь «медным людям»?
Главный на сегодняшний день способ лечения болезни Вильсона-Коновалова был предложен еще больше полувека назад — это регулярное применение препаратов, которые связывают медь и выводят ее из организма. Важным для «вильсонят» остается соблюдение строгой диеты и, при необходимости, пересадка печени.
Прерывание терапии или неправильное лечение может привести к смерти в течение нескольких месяцев. При этом медикаментозная, лекарственная терапия эффективна не для всех пациентов — побочные эффекты препаратов могут даже утяжелять состояние некоторых людей. Поэтому наука продолжает искать ответ — чем же помочь «вильсонятам»?
Не так давно исследователи научились исправлять «опечатки» в генах. В том числе — и в ATP7. Не всегда это получается хорошо, тем не менее, генная терапия может навсегда избавить пациентов с болезнью Вильсона-Коновалова от пожизненного приема препаратов и строгой диеты.
Как исследователи пытались научиться делать такую «операцию» на генах? Первые способы замены поврежденного участка гена на здоровый, в частности, применение олигонуклеотидов — коротких фрагментов ДНК или РНК, получаемых путем химического синтеза, даже у мышей приводили к едва заметному улучшению — его точно не хватило бы для помощи человеку.
Разочарования исследователей продлились до тех пор, пока они не научились «протезировать» больной ген. Для этого копию гена без поломки помещают в структуру искусственного вируса, чтобы эта неизмененная копия гена легко проникла в клетку. Освободившись от белковой оболочки, как от скафандра, ген начинает работать — и клетка наполняется правильно работающими переносчиками для меди.
Такая генная терапия представляет собой перспективную альтернативу классическому лекарственному лечению.
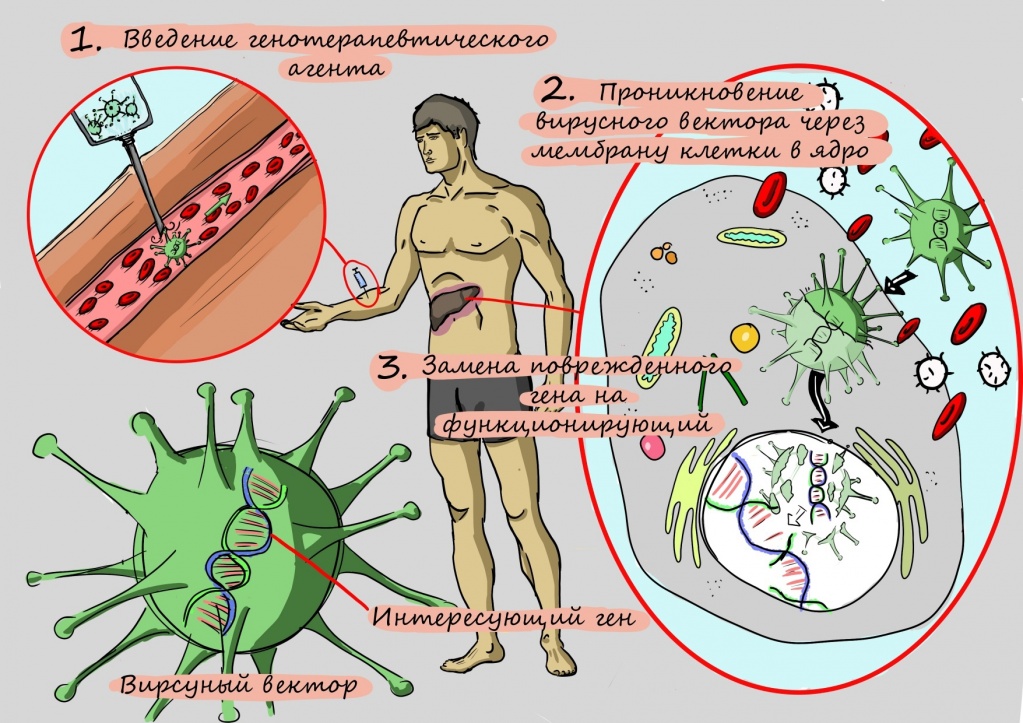
Молекулярное протезирование гена АТР7 — генная терапия
Однако при проведении этого вида терапии исследователи столкнулись с проблемой: аденовирус, который использовали для доставки гена в клетку, не может внедряться в собственный генетический аппарат клеток, — и это приводило к тому, что терапия работала недолго.
Следующим шагом в разработке терапии стало применение другого носителя — так называемого аденоассоциированного вирусного вектора.
Мышам с мутацией, которая похожа на мутацию в белке ATP7, вызывающую болезнь Вильсона-Коновалова, вводили такой вектор, и эффект оказался положительным.
Аденоассоциированный вирусный вектор имеет способность встраиваться в генетический аппарат клеток, поэтому результат лечения был более долгосрочным. Однако и этого оказалось недостаточно.
Успешный опыт подогревал ажиотаж исследователей: так, в 2021 году начались первые два клинических исследования по спасению «вильсонят» методами генной терапии (NCT04884815, NCT04537377). Через несколько лет мы узнаем — помогут ли эти разработки пациентам.
Материал подготовили: Роман Деев, Максим Пушкин, Екатерина Пичугина, Алексей Паевский, Виктория Рыжкова.
Иллюстрации Владислава Ефремова.
Болезнь Вильсона-Коновалова
Болезнь Вильсона-Коновалова – редкое наследственное заболевание, проявляющееся различными печеночными, неврологическими, психиатрическими, костно-мышечными нарушениями вследствие чрезмерного отложения меди в органах и тканях. Из-за длительного течения и многообразия клинических симптомов относится к числу труднодиагностируемых заболеваний.
Заболевание связано с нарушением метаболизма меди и избыточным ее накоплением в различных органах и тканях. Из-за преимущественно накопления меди в печени и в отделах центральной нервной системы оно проявляется в большей степени симптоматикой поражения печени и центральной нервной системы (ЦНС). Из-за токсического влияния свободной меди приданном заболевании нарушается функция органов зрения (роговицы), почек, желез внутренней секреции, сердца, костной ткани.
Первые описания болезни дали C. Westphal в 1883 г. и в A. Strumpell в 1898 г. Они изучали заболевание, при котором регистрировались признаки многоочагового поражения центральной нервной системы на фоне поражения печени. Патология была названа псевдосклерозом. В 1902-1903 г.г. у данных пациентов по периметру роговицы были обнаружены зеленовато-бурые отложения, которые были названные в честь описавших их авторов — кольца Кайзера–Флейшера.
Однако, целостное и подробное описание патологии было дано английским неврологом Самуэлем Вильсоном в 1912 году. Врач описал морфологические отклонения, которые происходят в организме при данном заболевании – двусторонние изменения чечевицеобразных ядер в головном мозге (лентикулярных ядер в подкорковом веществе головного мозга) в сочетании с циррозом печени. В клинической картине он выделил наличие признаков поражения экстрапирамидной системы, бульбарного синдрома и психических расстройств. Заболевание начинало проявлять себя в молодом возрасте и затем неуклонного прогрессировало. Это позволило Вильсону назвать данную патологию прогрессирующей лентикулярной дегенерацией.
Почти через 40 лет J.N. Cumings (1948) и H.G. Kunkel (1952) выявили у данных больных нарушение обмена меди — накоплением ее в мозговой ткани и гиперсекрециию с мочой из-за дефицита медьсодержащего белка церулоплазмина в плазме крови.
В России изучение болезни связано с именем Н.В.Коновалова. Ему принадлежат заслуги описания в 1960 году основных клинических форм данной патологии и создания подробной классификации заболевания.
Распространенность заболевания среди мужчин и женщин одинаковая. Данная патология редко выявляется до достижения 5-летнего возраста. По данным медицинской статистики, частота встречаемости болезни составляет 1 на 7 000 -10 000 человек. На территории Российской Федерации за 2014 и 2015 гг. болезнь Вильсона-Коновалова была выявлена у 572 и 602 человек соответственно.

Суперфуды в косметике: сочные коктейли для здоровья кожи и волос
Симптомы
Симптомы болезни Вильсона-Коновалова складываются из признаков поражения печени, неврологических и психических расстройств. Первыми у 42% пациентов появляются поражения печени, в четверти всех случаев – уже в детском возрасте. Неврологическая симптоматика болезни Вильсона проявляется, как правило, позже — на втором-третьем десятилетиях жизни.
В большинстве случаев поражение печени имеет длительное течение и без лечения приводит к развитию цирроза. Клинически поражение печени первоначально проявляется диспептическими проявлениями, повышенной утомляемостью, недомоганием, потерей аппетита вплоть до развития анорексии, снижением массы тела, суставными болями, увеличением печени, болью в правом подреберье, развитием желтухи, появлением темной мочи. Иногда заболевание может дебютировать снижением уровня лейкоцитов и тромбоцитов в крови. Клинически это проявляется кровотечениями из десен и повторяющимися носовыми кровотечениями.
Постепенно нарастают признаки функциональной недостаточности печени, формируется ее цирротическое поражение, появляются признаки портальной гипертензии, развиваются асцит и печеночная энцефалопатия. В этот период отмечаются нарастание желтухи, боли в животе, диспепсических расстройств. В биохимическом анализе крови выявляются повышение содержания аминотрансфераз (АСТ, АЛТ), снижение содержания альбумина, повышение содержания гаммаглобулинов, нарушение свертываемости крови. Часто заболевание впервые выявляется уже на стадии декомпенсированного цирроза печени с развитием отечно-асцитического синдрома на фоне варикозно расширенных вен пищевода. В ряде случаев больные погибают от печеночной недостаточности еще до развития неврологической симптоматики.
Концентрация меди в головном мозге и спинномозговой жидкости у пациентов с болезнью Вильсона-Коновалова по сравнению со здоровыми увеличивается в 10 раз. Неврологические признаки могут до поры до времени развиваться постепенно, а затем внезапно выйти на первое место в клинической картине заболевания. Определяются экстрапирамидные нарушения – размашистый тремор конечностей, изменение почерка, тремор головы, нарушение речи и ухудшение памяти. Нарастание неврологических симптомов характеризуется появлением насильственных движений – гиперкинезов в виде непроизвольных стереотипных, ритмических, вычурных движений небольшого объема (атетоз), насильственно плача или смеха. Поражение нервной системы может проявиться дрожанием рук, нарастанием тонуса мускулатуры, переходящим в ее ригидность. Затем развиваются клонические и тонические судороги. Дальнейшее прогрессирование болезни приводит к смене ригидности мышц на миогенные контрактуры и обездвиженность.
Нередки экстрапеченочные и экстраневрологические симптомы болезни Вильсона-Коновалова.
У 1% пациентов болезнь проявляется поражением почек из-за отложения меди в почечных канальцах. Это проявляется выведение с мочой аминокислот, продуктов из распада, глюкозы, мочевой кислоты, кальция, а также снижением почечного кровотока и фильтрации. В редких случаях развиваются пиелонефрит, гломерулонефрит и мочекаменная болезнь. Из-за потери кальция и фосфора при нарушении функции почек развиваются остеопороз, рахит, остеомаляция.
Отложение меди в суставах приводит к развитию остеоартрита.
Нарушения со стороны эндокринной системы могут проявляться в отставании полового развития, появлении гинекомастии у юношей, амeнореи или дисменореи у девушек, развитии ожирения, акромегалии, появлении striae gravidarum — полос на коже живота, как при беременности. В 33% случаев у женщин отмечались гипоплазия эндометрия по смешанному типу и кистозная атрезия фолликулов яичников.
Более, чем у половины пациентов с болезнью Вильсона-Коновалова при ультразвуковом исследовании были выявлены фиброзные изменения клапанов сердца и обнаружены признаки обратного тока крови из-за нарушения функции этих клапанов. В ряде исследований выявлена высокая распространенность гипертрофии левого желудочка.
Со стороны органов зрения обнаруживаются кольца Кайзера-Флейшера и помутнение хрусталика.
Формы
Формы болезни Вильсона-Коновалова с 1983 выделяют бессимптомную, печеночную, церебральную и смешанную форма.
Однако, в нашей стране широко распространена классификация Н.В.Коновалова (1960 г), который выделил 5 форм заболевания.
Брюшная (абдоминальная) форма – преневрологическая стадия болезни, развивается обычно в возрасте 5-17 лет, сопровождается быстрым нарастанием поражения печени в нескольких вариантах, без лечения заканчивающееся летально.
Ригидно-аритмогиперкинетическая (ранняя форма) — развивается в возрасте 7-15 лет, отличается быстрым течением. Клиническая картина характеризуется аритмичными гиперкинезами, мышечной ригидностью, развитием контрактур. Гиперкинезы охватывают различные мышечные группы (конечности, туловище, а также мышцы, ответственные за артикуляцию и глотание) и приводят к изменению позы тела, положения конечностей, дизартрии и дисфагии. Выявляется нарушение интеллекта, появляется нарушение речи, нарушение глотания, судорожный смех и плач. Без лечения заканчивается летально через 2-3 года.
Дрожательно-ригидная форма встречается чаще других в более позднем возрасте (17-25 лет) и имеет более доброкачественное течение. Для этого варианта характерно одновременное развитие ригидности и дрожания с варьированием их соотношения. В ряде случаев регистрируются атетоидные насильственные движения (гиперкинезы в виде непроизвольных стереотипных, ритмических, вычурных движения небольшого объема). Часто отмечаются дисфагия и дизартрия. Без лечения срок жизни таких пациентов составляет 5-6 лет.
Дрожательная форма считается наиболее доброкачественной. Она начинается в возрасте 20-30 лет и протекает довольно медленно в течение10-15 лет и более. Основным клиническим проявлением является дрожание. Мышечный тонус не изменен или снижен. По мере прогрессирования болезни дрожание резко усиливается, становится крупноамплитудным. Ригидность появляется только в конце болезни. Интеллектуальные способности длительное время сохраняются, но по мере прогрессирования болезни, наряду с повышением мышечного тонуса, возникают изменения психики, отличающиеся развитием аффективных расстройств.
Экстрапирамидно-корковая форма встречается реже других форм. Характеризуется присоединением к имеющимся типичным нарушениям остро развивающихся пирамидных парезов и эпилептических припадков, чаще очагового характера, и быстрым прогрессом психических нарушений. Эта форма длится в среднем 6-8 лет и заканчивается летально.
Причины
Основной причиной развития болезни Вильсона-Коновалова является нарушение обмена меди и ее отложение в различных органах и тканях. Токсическое действие меди приводит к нарушению функций органов. Причина нарушения обмена меди — дефект в гене, регулирующем ее обмен (АТР7В). В результате нарушаются два основных процесса — синтез медьсодержащего белка церулоплазмина и выведение меди с желчью. Все это ведет к повышению концентрации меди и ее отложению в органах.
В норме поступающая с пищей медь после усвоения в желудочно-кишечном тракте в комплексе с белками переносится в печень, где соединяется со специальным белком, синтезируемым в печени — церулоплазмином. Церулоплазмин необходим для нормального обмена железа, его всасывания и утилизации, поскольку этот белок участвует в мобилизации железа из клеток ретикулоэндотелиальной системы и переводит железо в трехвалентную форму. Медь также входит в состав супероксиддисмутазы – фермента, участвующего в защите клеток от оксидативного стресса при активации перекисного окисления липидов вследствие повышения уровня токсичных форм кислорода. Медь присутствует в ферменте цитохром С-оксидазе, осуществляющей транспорт электронов. Она необходима для работы V и VIII факторов свертывания крови, содержится в активном центре фермента дофамин-бета-гидроксилазы, которая катализирует реакцию перехода дофамина в норадреналин. Важным медьсодержащим белком является фермент лизилоксидаза, участвующая в образовании поперечных связей коллагена – основного белка, из которого строится костная ткань. Медь участвует в реакциях превращения аскорбиновой кислоты (витамина С).
Ген, ответственный за развитие заболевание был идентифицирован в 1993 г. двумя исследовательскими группами из США и Канады. Установлено, что этот ген кодирует синтез медьтранспортирующей аденозинтрифосфатазы Р-типа (медьтранспортирующую АТФ-азу 7В), и именно мутации в этом гене обусловливают нарушение обмена меди в организме.
В сыворотке крови 95 % меди находится в связанном состоянии с белком церулоплазмином. Включение меди в церулоплазмин происходит в аппарате Гольджи при участии медьтранспортирующей АРФ7В. Эта АТФ-аза 7В играет двоякую функциональную роль в клетках печени: одна из них – участие в биосинтезе путем доставки меди к апоцерулоплазмину внутри аппарата Гольджи, другая – транспорт избытка меди из клетки. В настоящее время известно несколько сотен мутаций в гене АТР7В, из которых более 70 идентифицированы в патогенезе заболевания. Такой широкий спектр повреждений в гене АТР7В и разнообразие их комбинаций находит отражение в полиморфизме клинических проявлений и тяжести течения патологии. Однако, пока убедительных данных о корреляциях «генотип-фенотип» получить не удается.
Наиболее распространенной мутацией в гене АТР7В среди европеоидной расы является мутация 3207C>A (H1069Q), при которой в положении 1069 происходит замена (мутация) аминокислоты гистидина на глутаминовую кислоту с образованием «патологического» фермента. Исследователи обнаруживают эту мутацию у 22-38% больных славян.
Генетически детерминируемое снижение функции медь-транспортирующей АТФ-азы в результате молекулярных дефектов в гене АТР7В приводит к снижению удалению меди из организма и нарушению встраивания меди в церулоплазмин, в результате экскретируется и циркулирует апоцерулоплазмин (белок ненагруженный медью, срок полувыведения которого сокращается вдвое, что и объясняет гипоцерулоплазминемию), а медь накапливается в различных органах и тканях, преимущественно в печени, головном мозге, роговице глаза, почках, обеспечивая полиморфизм клинических появлений болезни Вильсона-Коновалова. Перегруженные медью гепатоциты разрушаются и это приводит к формированию стойкого синдрома цитолиза (гибели клеток).
Тип наследования заболевания аутосомно-рецессивный. Это значит, что для клинического проявления болезни нужно, чтобы ребенок унаследовал измененный ген сразу об обоих родителей. Если же измененный ген будет унаследован только от одного из родителей, то ребенок будет «здоровым носителем» болезни.
В патогенезе болезни ведущая роль принадлежит нарушению баланса между объемом поступившей с пищей меди и ее экскрецией. При болезни Вильсона-Коновалова этот баланс нарушается, содержание свободной (токсичной) меди в крови и тканях возрастает, и ее выделение с мочой увеличивается.
Генетическая гетерогенность (большое количество возможных мутаций) может обусловливать и разнообразие механизмов дефекта экскреции меди: в одних случаях он может возникать из-за аномалии экпрессии гена на разных уровнях регуляции синтеза церулоплазмина, в других – из-за препятствия всасываемости меди в тонком кишечнике, в третьих – из-за нарушения выведения меди с желчью, в четвертых – из-за появления в печени патологически измененного металлотионейона (белок, связывающий медь и другие тяжелые металлы). Это приводит к накоплению в гепатоците так называемой регуляторной фракции меди. Избыточная концентрация последней провоцирует генерацию свободных радикалов, нарушение проницаемости плазматической мембраны и мембран митохондрий, истощение клеточных запасов и, как следствие, повреждение структур гепатоцита. При нарушении выведения меди с желчью при болезни Вильсона-Коновалова она долгое время депонируется в гепатоцитах. Избыток меди ведет к возникновению каскада патобиохимических реакций, вызывая развитие вильсоновского гепатита (гепатоза) с последующим переходом в атрофический нодулярный цирроз печени.
Хотя патогенез болезни еще недостаточно изучен, существует несколько его гипотез, две из которых считаются ведущими.
- Теория генетического дефекта синтеза церулоплазмина, который сопровождается нарушением поступления меди в печень. В результате возврат меди в кровь обеспечивает поступление ее с током крови к органам-мишеням (мозг, сердце, роговица, почки и др.).
- Существуют мнения, что дефект гена, ответственного за синтез церулоплазмина, по-видимому, не является ведущим фактором развития болезни Вильсона-Коновалова, а играет вторичную роль. Первичным звеном развития болезни следует считать изменение метаболизма меди в печени из-за нарушения ее выделения из аппарата Гольджи в желчь. Ионы меди, поступающие в избытке в ткани, очень токсичны и способны окислять белки и липиды клеточных мембран, связывать белки и нуклеиновые кислоты и усиливать синтез свободных радикалов. Эти радикалы окисляют липиды, ферменты и белки цитоскелета. Вследствие повышения внутриклеточной концентрации меди повреждается множество внутриклеточных систем.
Методы диагностики
Диагностика болезни Вильсона-Коновалова проводится обычно врачами гастроэнтерологом, неврологом, офтальмологом, генетиком на основании жалоб, данных анамнеза, клинического осмотра, обязательного применения лабораторных (включая генетические) и инструментальных методов обследования. Диагностика направлена на определение клинической формы заболевания, тяжести состояния и возникающих осложнений.
Из анамнеза можно выяснить наличие эпизодов желтухи, неврологических отклонений, заболеваний печени.
При объективном обследовании могут определяться умеренное увеличение печени и селезенки, признаки желтухи (желтушные склеры), наличие колец Кайзера-Флейшера на роговице.
Как правило наличие болезни не вызывает сомнений при обнаружении снижения в крови белка церулоплазмина, увеличения выведения меди с мочой и наличия колец Кайзера-Флейшера.
При размытых клинических симптомах может потребоваться проведение биопсии печени для определения содержания меди в ее клетках и проведение генетического обследования для обнаружения мутаций в гене АТР7В.
При определении меди в крови следует выделять два понятия – «общая медь» и «свободная медь». Для определения общей меди обычными рутинными методами ее содержание определяют по определения церулоплазмина, белка, который включает 90-95% меди. Поэтому количество общей меди, из-за падения содержания церулоплазмина при болезни Вильсона-Коновалова тоже уменьшается. Для точного подтверждения диагноза в качестве диагностического теста проводят определение несвязанной с церулоплазмином меди (свободной – токсичной) в моче методом масс-спектрометрии. Для установления факта усиления экскреции меди с мочой проводят пробу с пеницилламином. После его введения многократное увеличение меди в моче подтверждает диагноз.
В сыворотке крови также определяется повышение свободной (несвязанной) меди и снижение содержания церулоплазмина. Следует учитывать, что нормальной содержание церулоплазмина не всегда исключает диагноз болезни Вильсона-Коновалова, т.к. в 20% случаев у детей при подтвержденном диагнозе содержание этого белка оставалось в пределах нормы.
В ткани печени (биопсийный материал) определяется повышение содержания меди. У гетерозиготных носителей гена АТР7В (получивших от родителей один мутированный ген) концентрация меди в печени тоже повышена, но в меньшей степени.
При остром течении болезни в крови выявляется увеличение активности трансаминаз (АЛТ и АСТ), увеличение содержания билирубина и повышение содержания уробилина в моче.
При нарушении свойств печени синтезировать белки (синтетической функции) происходят нарушения в свертывающей системы крови, что проявляется снижением протромбинового индекса.
В клиническом анализе крови выявляются признаки анемии, ретикулоцитоз, ускорение СОЭ.
В общем анализе мочи при поражении почек — протеинурия, глюкозурия (наличие глюкозы), увеличение количества аминокислот и их продуктов (аминоацидурия).
Типичным признаком болезни являются кольца Кайзера-Флейшера на роговице глаза, определяющиеся у 55-70% взрослых пациентов. При вовлечении ЦНС это кольцо определяется практически у всех пациентов.
Генетическое исследование подразумевает выявление мутаций в гене АТР7В.
Проводится дородовая (пренатальная) диагностика болезни Вильсона-Коновалова на плодном материале. Следует иметь в виду, что если мутация обнаруживается только на одной из гомологичных хромосом, то достоверно диагноз поставить о наличии болезни нельзя. Диагноз является 100%, если мутация обнаружена в гомозиготном состоянии (в 2-х одинаковых генах в гомологичных хромосомах – ребенок унаследовал 2 мутированных гена).
Инструментальные исследования назначаются для оценки состояния печени (УЗИ печени и желчных протоков, селезенки). При клинических признаках нарушения ЦНС проводят МРТ и КТ головного мозга — обнаруживается атрофия коры и ствола мозга, увеличенные желудочки. При наличии судорожного синдрома и других неврологических признаках показано проведение электроэнцефалографии (ЭЭГ).
Обследование органов зрения, с целью выявления колец Кайзера-Флейшера проводится врачом-офтальмологом при помощи щелевой лампы.
При поражении сердца, почек, костей, эндокринных органов назначаются соответствующие инструментальные обследования (УЗИ почек, ЭКО-КГ и др.).
В пользу правильности диагноза будет свидетельствовать высокий терапевтический эффект при применении медьвыводящих препаратов.
Дифференциальная диагностики проводится в гепатитами неясной этиологии, циррозом печени. При развитии неврологических симптомов с паркинсонизмом.
Основные используемые лабораторные исследования.
- Клинический анализ крови.
- Общий анализ мочи.
- Биохимический анализ крови (включая АСТ, АЛТ, билирубин).
- Исследование свертывания крови.
- Определение меди в суточной моче (Масс-спектрометрия c источником ионов в виде индуктивно связанной плазмы/ИСП-МС).
- Определение меди в крови (колориметрический метод).
- Определение меди в ткани печени (биопсийный материал).
- Поиск 12 наиболее вероятных мутаций в гене АТР7В.
- Пренатальная диагностика болезни Вильсона. (выявление носительства мутаций в гене АТР7В).
Основные используемые инструментальные исследования.
- УЗИ органов брюшной полости (печень, поджелудочная железы, селезенка, почки).
- МРТ и КТ печени, поджелудочной железы, селезенки.
- Эластометрия печени.
- МРТ/КТ головного мозга.
- ЭХО-КГ сердца.
Лечение
Часто болезнь Вильсона-Коновалова диагностируют уже на тяжелой стадии с необратимыми изменениями, и лечение в этом случае уже не ведет к выздоровлению, а лишь к стабилизации патологического процесса.
Патогенетическое лечение направлено на выведение избытка меди и лечение сопутствующих осложнений.
Прогресс в лечении произошел в 1956 году, когда J.M. Walshe синтезировал из пенициллина препарат D-пеницилламин, обладающий медьвыводящим действием. Он представляет собой тиоловый препарат, содержащий сульфгидрильные группы, образующие комплексы с медь
Альтернативным методом является применение препаратов цинка (сульфат цинка, ацетат цинка). Цинк обладает минимальной токсичностью, связываясь с металлотионином кишечника, способствует экскреции меди с желчью и выведению ее с калом (а не с мочой, как при лечении тиоловыми препаратами).
Большое значение на всех стадиях болезни имеет диетотерапия, заключающаяся в ограничении продуктов с высоким содержанием меди – бобовые, баранина, куриное мясо, колбаса, рыба, шампиньоны, шоколад, кофе, орехи, редис, лук-порей и др.
При фульминантном (быстро развивающемся) гепатите прогноз крайне неблагоприятен. Патология приобретает стремительно прогрессирующее течение и обычно завершается летальным исходом. Единственно эффективным способом лечения таких больных становится трансплантация печени.
Осложнения
К основным осложнениям болезни Вильсона-Коновалова можно отнести – цирроз печени, анемию, поражение почек, нейропсихические расстройства, артриты, кардиомиопатию.
Профилактика
Профилактика возможного развития болезни Вильсона-Коновалова основана на выявлении носительства «патологического» гена у будущих родителей перед принятием решения о деторождении (при планировании беременности).
Другой способ определить возможность развития болезни — уже в период беременности — пренатальная диагностика, т.е. выявление мутаций у плода путем взятия ворсин хориона (часть плаценты забирается через шейку матки или через брюшную стенку) или при проведении амниоцентеза. Последняя методика заключается в исследовании клеток плода, находящихся в околоплодной жидкости, получаемых после прокола зародышевой оболочки.
Какие вопросы следует задать врачу
Следует ли всем лица, планирующим беременность (мужчинам и женщинам) проводить расширенный генетический тест на возможные наследственные заболевания?
Советы пациенту
Проведение генетического консультирования перед вступлением в брак – это нормальная практика во всех развитых странах.
Болезнь Вильсона ( Болезнь Вестфаля-Вильсона-Коновалова , Болезнь Вильсона-Коновалова , Гепатолентикулярная дистрофия , Гепатоцеребральная дистрофия , Лентикулярная прогрессирующая дегенерация )
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Болезнь Вильсона может протекать в брюшной, ригидно-аритмогиперкинетической, дрожательной или экстрапирамидно-корковой форме. Диагностика болезни Вильсона включает офтальмологическое обследование, биохимические анализы мочи и крови, МРТ или КТ головного мозга. Основу патогенетической терапии составляют тиоловые препараты, которые могут приниматься в течении нескольких лет и даже пожизненно.
МКБ-10
Общие сведения
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФ-азы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Первооткрыватель заболевания — А.К. Вильсон, описавший заболевание в 1912 году, в отечественной медицине — Н.А. Коновалов. Патогенез болезни Вильсона был выявлен в 1993 году. Понятию «болезнь Вильсона» соответствуют также: болезнь Вильсона-Коновалова, болезнь Вестфаля-Вильсона-Коновалова, дистрофия гепатоцеребральная, дистрофия гепатолентикулярная, дегенерация лентикулярная прогрессирующая.

Причины
Ген АТР7В картирован на длинном плече хромосомы 13 (13q14.3-q21.1). Организм человека содержит около 50-100 мг меди. Суточная потребность меди для человека — 1-2 мг. 95% абсорбированной в кишечнике меди, транспортируется в форме комплекса с церулоплазмином (один из глобулинов сыворотки, синтезируемых печенью) и только 5% в форме комплекса с альбумином. Кроме того, ион меди входит в состав важнейших метаболических ферментов (лизилоксидаза, супероксиддисмутаза, цитохром-С-оксидаза и др.). При болезни Вильсона происходит нарушение двух процессов обмена меди в печени — биосинтез главного медьсвязывающего белка (церулоплазмина) и выведение меди с желчью, следствием чего становится повышение уровня несвязанной меди в крови. Концентрация меди в различных органах (чаще всего в печени, почках, роговице и головном мозге) увеличивается, что приводит к их токсическому поражению.
Классификация
Согласно классификации Н.В. Коновалова различают пять форм болезни Вильсона:
- брюшная
- ригидно-аритмогиперкинетическая
- дрожательно-ригидная
- дрожательная
- экстрапирамидно-корковая
Симптомы
Для болезни Вильсона характерен клинический полиморфизм. Первые проявления заболевания могут появиться в детстве, юношестве, в зрелом возрасте и гораздо реже в зрелом возрасте. В 40-50% случаев Болезнь Вильсона манифестирует с поражения печени, в остальных — с психических и неврологических расстройств. С вовлечением в патологический процесс нервной системы обнаруживается кольцо Кайзера-Флейшера.
Брюшная форма развивается преимущественно до 40 лет. Характерный признак — тяжелое поражение печени по типу цирроза печени, хронического гепатита, фульминантного гепатита.
Ригидно-аритмогиперкинетическая форма манифестирует в детском возрасте. Начальные проявления — мышечная ригидность, амимия, смазанность речи, трудности при выполнении мелких движений, умеренное снижение интеллекта. Для этой формы заболевания характерно прогрессирующее течение, с наличием эпизодов обострения и ремиссии.
Дрожательная форма возникает в возрасте от 10 до 30 лет. Преобладающим симптомом является тремор. Кроме того, могут наблюдаться брадикинезия, брадилалия, тяжелый психоорганический синдром, эпилептические приступы.
Экстрапирамидно-корковая форма встречается весьма редко. Ее начало схоже с началом какой-либо из вышеперечисленных форм. Для нее характерны эпилептические припадки, экстрапирамидные и пирамидные нарушения и выраженный интеллектуальный дефицит.
Диагностика
Офтальмологическое исследование с помощью щелевой лампы выявляет кольцо Кайзера-Флейшера. Биохимические исследования мочи обнаруживают повышенную экскрецию меди в суточной моче, а также снижение концентрации церулоплазмина в крови. С помощью визуализационных методов (КТ и МРТ головного мозга) обнаруживают атрофию полушарий большого мозга и мозжечка, а также базальных ядер.
При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца. Основным дифференциально-диагностическим признаком этих заболеваний является отсутствие характерных для болезни Вильсона кольца Кайзера-Флейшера и расстройств обмена меди. Для подтверждения болезни Вильсона проводится генодиагностика.
Лечение болезни Вильсона
Основой патогенетического лечения является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола. Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов. Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза). Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца. В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов). В случае доминирования гиперкинезов рекомендовано назначение небольших курсов нейролептиков, при ригидности — леводопы, карбидопы, тригексифенидила.
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме. В дальнейшем лечение пациента составляет иммуносупрессивная терапия. В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень). Немедикаментозное лечение состоит в назначении диеты (стол №5) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т. д.).
Прогноз и профилактика
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме. Постоянный прием тиоловых препаратов по схеме, назначенной врачом-специалистом, позволяет поддерживать профессиональную и социальную активность пациента.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Источник https://media.nenaprasno.ru/articles/keysy/mednye-lyudi-chto-vazhno-znat-o-bolezni-vilsona-konovalova/
Источник https://medaboutme.ru/zdorove/spravochnik/bolezni/bolezn_vilsona_konovalova/
Источник https://www.krasotaimedicina.ru/diseases/zabolevanija_neurology/wilsons