Антибиотик-ассоциированная диарея
Антибиотик-ассоциированная диарея — это заболевание, которое характеризуется появлением неоформленного стула во время или после приема антибактериальных препаратов. Болезнь сопровождается диспепсической симптоматикой (послаблением стула, газообразованием). В тяжелых случаях появляются интенсивные боли в животе, слабость, лихорадка. Диагностика основывается на установлении связи приема АБ с развитием диареи. Дополнительно проводят анализ кала, эндоскопическое исследование кишечника. Лечение предполагает отмену АБ, назначение пробиотиков и дезинтоксикационных препаратов. При выявлении возбудителя болезни проводят этиотропную антибактериальную терапию.
МКБ-10
K91.8 Другие нарушения органов пищеварения после медицинских процедур, не классифицированные в других рубриках

Общие сведения
Антибиотик-ассоциированная диарея (ААД, нозокомиальный колит) — три и более эпизода жидкого стула, повторяющиеся на протяжении не менее двух дней и связанные с приемом антибактериальных препаратов (АБ). Расстройство может проявляться в течение 4-х недель после отмены АБ. В развитых странах поражение кишечника является наиболее частой реакцией на антибиотикотерапию: у лиц, принимающих антибиотики, ААД встречается в 5-30% случаев. Патология протекает как в легкой самокупирующейся форме, так и в виде тяжелого затяжного колита. В современной гастроэнтерологии не менее 70% случаев заболевания приходится на идиопатическую ААД, 30% — на Clostridium difficile-ассоциированную диарею. Болезнь в равной степени поражает мужчин и женщин.

Причины ААД
Антибиотик-ассоциированная диарея чаще развивается после назначения антибиотиков пенициллинового ряда, тетрациклинов, цефалоспоринов. Способ введения лекарств практически не влияет на вероятность появления диареи. При пероральном приеме медикаменты воздействуют на слизистый слой ЖКТ. При парентеральном пути введения метаболиты АБ выделяются с желчью и слюной, оказывая влияние на облигатную микрофлору. С учетом причин возникновения болезни различают 2 формы ААД:
- Идиопатическая (ИААД). Развивается в результате негативного воздействия АБ на эубиоз желудочно-кишечного тракта. Влияние патогенных микроорганизмов на ЖКТ является одной из возможных причин развития данного заболевания. Среди многообразия возбудителей часто встречаются стафилококки, протеи, энтерококки, клостридии, грибы. Риск возникновения ААД увеличивается при длительном (более 10 дней), частом и неправильном приеме АБ (превышении дозы).
- Clostridium difficile-ассоциированная диарея (C. difficile-АД). Этиологически связана с нарушением микрофлоры и избыточным заселением ЖКТ условно-патогенными бактериями Clostridium difficile. Дисбактериоз возникает в результате приема АБ из группы цефалоспоринов, амоксициллина, линкомицина. Известны случаи развития внутригоспитальной антибиотик-ассоциированной инфекции путем передачи возбудителя через средства личной гигиены (полотенца, мыло, посуда), медицинский инструментарий при некачественной обработке.
Помимо прямого воздействия антибактериальных средств на стенку кишечника, существуют факторы риска, увеличивающие вероятность развития болезни. К ним относят детский и пожилой возраст, наличие тяжелой соматической патологии (сердечная, почечная недостаточность), бесконтрольный прием антацидных препаратов, врожденные и приобретенные иммунодефицитные состояния, хирургические вмешательства на брюшной полости, зондовое питание. Хронические заболевания ЖКТ (болезнь Крона, неспецифический язвенный колит) также способствуют возникновению антибиотик-ассоциированного колита.
Патогенез
Противомикробные препараты уменьшают рост и размножение не только патогенных, но и симбионтных микроорганизмов. Происходит уменьшение облигатной микрофлоры кишечника, развивается дисбактериоз. Данный факт лежит в основе патогенеза обоих видов антибиотик-ассоциированной диареи. При идиопатической форме также играет роль усиление моторики кишечника, токсическое поражение слизистой оболочки или нарушение обменных процессов в кишечнике.
Антибиотик-ассоциированный клостридиальный колит возникает вследствие изменения состава эндогенной нормофлоры ЖКТ при приеме цефалоспоринов III и IV поколения, фторхинолонов, пенициллинов. Дисбактериоз способствует размножению C. Difficile, которые в большом количестве выделяют 2 вида токсинов (А и В). Находясь в просвете ЖКТ, энтеротоксины разрушают эпителиоциты и вызывают воспалительные изменения стенки кишечника. Колит преимущественно поражает толстый кишечник с формированием диффузной гиперемии и отечности слизистой. Стенка ЖКТ утолщается, образуются налеты фибрина, имеющие вид желтоватых бляшек (псевдомембраны).
Классификация
Выделяют две формы идиопатической антибиотик-ассоциированной диареи: инфекционную и неинфекционную. Среди возбудителей инфекционной формы ААД часто встречаются клостридии перфрингенс, золотистый стафилококк, сальмонеллы, клебсиеллы, грибы рода Кандида. Неинфекционная ИААД представлена следующими видами:
- Гиперкинетическая. Клавуланат и его метаболиты увеличивают двигательную активность ЖКТ, прием макролидов вызывает сокращение 12-перстной кишки и антрального отдела желудка. Данные факторы способствуют появлению неоформленного стула.
- Гиперосмолярная. Развивается за счет частичного всасывания АБ (цефалоспоринов) или при нарушении углеводного обмена. В просвете кишечника накапливаются метаболиты углеводов, которые вызывают повышенную секрецию электролитов и воды.
- Секреторная. Формируется за счет нарушения эубиоза кишечника и деконъюгации желчных кислот. Кислоты стимулируют выделение воды и солей хлора в просвет кишки, следствием этих процессов является частый неоформленный стул.
- Токсическая. Формируется из-за негативного воздействия метаболитов пенициллинов и тетрациклинов на слизистую кишечника. Развивается дисбактериоз и диарея.
Проявления C. difficile-АД могут варьировать от бессимптомного носительства до молниеносно развивающихся и тяжелых форм. В зависимости от клинической картины, данных эндоскопии выделяют следующие виды антибиотик-ассоциированной клостридиальной инфекции:
- Диарея без колита. Проявляется неоформленным стулом без интоксикационного и абдоминального синдромов. Слизистая оболочка кишечника не изменена.
- Колит без псевдомембран. Характеризуется развёрнутой клинической картиной с умеренной дегидратацией и интоксикацией. При эндоскопическом исследовании наблюдаются катаральные воспалительные изменения в слизистой оболочке.
- Псевдомембранозный колит (ПМК). Данное заболевание характеризуется выраженной интоксикацией, дегидратацией, частым водянистым стулом и болями в животе. При колоноскопии определяется фибринозный налет и эрозивно-геморрагические изменения слизистой.
- Фульминантный колит. Наиболее тяжелая форма антибиотик-ассоциированного расстройства ЖКТ. Развивается молниеносно (от нескольких часов до суток). Вызывает серьезные гастроэнтерологические и септические нарушения.
Симптомы ААД
При идиопатической антибиотик-ассоциированной диарее симптоматика возникает во время (у 70% пациентов) или после прекращения лечения антибиотиками. Основным, иногда единственным, проявлением болезни служит неоформленный стул до 3-7 раз в сутки без примесей крови и гноя. Редко отмечаются боли и чувство распирания в животе, метеоризм вследствие усиленной работы ЖКТ. Заболевание протекает без повышения температуры тела и симптомов интоксикации.
В отличие от идиопатической формы, клинический спектр проявлений Clostridium difficile-АД варьирует от бессимптомного колита до тяжелых фатальных форм болезни. Бактерионосительство выражается отсутствием симптоматики и выделением в окружающую среду клостридий с калом. Легкое течение заболевания характеризуется только жидким стулом без лихорадки и выраженного абдоминального синдрома. Чаще наблюдается C. difficile-ассоциированный колит средней степени тяжести, который проявляется повышением температуры тела, периодическими схваткообразными болями в околопупочной области, многократной диареей (10-15 раз/сутки).
Тяжелое течение болезни (ПМК) характеризуется частым (до 30 раз/сутки) обильным водянистым стулом, имеющим зловонный запах. Кал может содержать примеси слизи и крови. Болезнь сопровождается интенсивными абдоминальными болями, которые исчезают после акта дефекации. У пациентов отмечается ухудшение общего состояния, выраженная слабость и повышение температуры до 38-39°С. В 2-3% случаев регистрируется фульминантная форма заболевания, которая проявляется стремительным нарастанием симптомов, выраженной интоксикацией и появлением ранних тяжелых осложнений антибиотик-ассоциированной диареи.
Осложнения
Идиопатическая ААД хорошо поддается лечению и не вызывает осложнений у пациентов. Диарея, вызванная С.difficile, приводит к стойкому снижению артериального давления, развитию электролитных нарушений и обезвоживанию организма. Потери белка и воды способствуют возникновению отеков нижних конечностей и мягких тканей. Дальнейшее развитие болезни провоцирует появление мегаколона, изъявлений слизистой оболочки ЖКТ вплоть до перфорации толстой кишки, перитонита и сепсиса. Отсутствие своевременной диагностики и патогенетического лечения в 15-30% случаев приводит к летальному исходу.
Диагностика
При появлении обильного жидкого стула и дискомфорта в животе, вызывающих подозрение на развитие антибиотик-ассоциированной диареи, требуется консультация гастроэнтеролога. Специалист с помощью изучения анамнеза жизни и заболевания, физикального осмотра, данных лабораторных и инструментальных обследований составит соответствующее заключение.
Для диагностики идиопатической антибиотик-ассоциированной диареи достаточно выявить связь между приемом АБ и началом диареи, исключить сопутствующую патологию ЖКТ. В этом случае лабораторные показатели остаются нормальными, изменения слизистой оболочки кишечника отсутствуют. При подозрении на Clostridium difficile-ассоциированную диарею для подтверждения диагноза используются следующие методы:
- Лабораторные анализы крови. В общем анализе крови отмечается лейкоцитоз, увеличение СОЭ, анемия; в биохимическом — гипопротеинемия.
- Исследование кала. В копрограмме обнаруживаются лейкоциты и эритроциты. Основным диагностическим критерием заболевания служит выявление возбудителя в кале. Диагностикой выбора являются цитопатогенный тест (ЦТ) и реакция нейтрализации токсина (РНТ), которые определяют токсин В. Метод иммуноферментного анализа (ИФА) чувствителен к А и В-эндотоксинам. Полимеразная цепная реакция (ПЦР) используется для идентификации генов, кодирующих токсины. Культуральный метод позволяет обнаружить клостридии в посеве кала.
- Эндоскопия толстой кишки. Колоноскопию выполняют для визуализации патологических изменений кишечника (псевдомембран, фибриновых пленок, эрозий). Эндоскопическая диагностика при тяжелом колите может представлять опасность в связи с риском прободения кишки.
Диагностика антибиотик-ассоциированного расстройства стула обычно не вызывает трудностей. Идиопатическую форму болезни дифференцируют с пищевыми токсикоинфекциями легкой степени. Клиника C. difficile-ассоциированной диареи, а именно псевдомембранозного колита, может напоминать течение холеры, болезни Крона, язвенного колита и тяжелого пищевого отравления. Дополнительно проводят обзорную рентгенографию брюшной полости, КТ толстого кишечника.
Лечение ААД
Лечение неклостридиальной антибиотик-ассоциированной диареи предполагает отмену или снижение дозы антибактериального средства, назначение противодиарейных препаратов (лоперамид), эубиотиков и пробиотиков (лактобактерии, бифидобактерии). При многократных эпизодах жидкого стула целесообразно проводить нормализацию водно-солевого баланса.
Выявление клостридий диффициле является показанием для отмены АБ и назначения этиотропной, симптоматической и дезинтоксикационной терапии. Препаратом выбора для лечения заболевания является метронидазол. В тяжелых случаях и при непереносимости метронидазола назначают ванкомицин. Коррекция дегидратации и интоксикации осуществляется парентеральным введением водно-солевых растворов (ацесоль, р-р Рингера, регидрон и др.).
В комплексную терапию клостридиального колита входит использование энтеросорбентов, пробиотиков. Последние назначаются после проведения этиотропной терапии для восстановления нормофлоры кишечника курсом на 3-4 месяца. При осложнениях ПМК (перфорация кишки, мегаколон, рецидивирующее прогрессирующее течение колита) показано хирургическое лечение. Выполняют резекцию части или всей толстой кишки (гемиколэктомию, колэктомию).
Прогноз и профилактика
Прогноз идиопатической ААД благоприятный. Заболевание может купироваться самостоятельно после отмены антибиотиков и не требовать специфического лечения. При своевременной диагностике и адекватном лечении псевдомембранозного колита удается добиться полного выздоровления. Тяжелые формы диареи, игнорирование симптомов болезни могут повлечь осложнения как со стороны ЖКТ, так и всего организма.
Рациональная антибиотикотерапия предполагает прием медикаментов по строгим показаниям только при назначении врачом и под его тщательным контролем. Профилактика антибиотик-ассоциированной диареи включает применение пробиотиков для поддержания нормальной микрофлоры ЖКТ, рациональное питание и ведение активного образа жизни.
1. Антибиотикоассоциированные диареи / Малов В.А. // Клиническая микробиология и антимикробная химиотерапия — 2002 — Т.4, №1
2. Антибиотик-ассоциированная диарея: актуальность проблемы, профилактика и терапия / Успенский Ю.П., Фоминых Ю.А. // Архив внутренней медицины — 2015 — №2
3. Антибиотик-ассоциированные диареи: проблемы и решения / Ныркова О.И., Бехтерева М.К. и др. // Вопросы современной педиатрии — 2011 — Т.10, №5
Псевдомембранозный колит — симптомы и лечение
Что такое псевдомембранозный колит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Аверина Александра Анатольевича, гастроэнтеролога со стажем в 16 лет.
Над статьей доктора Аверина Александра Анатольевича работали литературный редактор Вера Васина , научный редактор Роман Васильев и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Псевдомембранозный колит (Pseudomembranous colitis) — это острое воспалительное заболевание толстого кишечника, вызываемое токсигенными штаммами бактерии Clostridium difficile [1] . Микроб вырабатывает токсины А и В, повреждающие кишечную стенку, и белок, угнетающий перистальтику кишечника. В результате возникает диарея, боль в животе, появляется слизь и иногда примесь крови в кале.
Характерным признаком заболевания являются фиброзные наложения на слизистой оболочке толстой кишки [27] [28] .
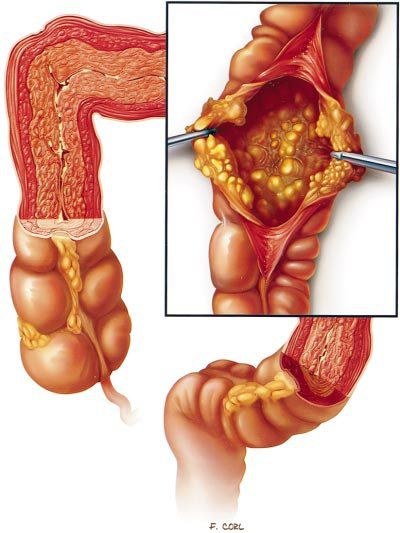
Псевдомембранозный колит (ПМК) чаще всего развивается после лечения антибиотиками. Его ещё называют Clostridium difficile-ассоциированным псевдомембранозным колитом, антибиотик-ассоциированным псевдомембранозным и клостридиозным колитом.
Эпидемиология
Заболеваемость ПМК лучше всего отслеживается в США и странах западной Европы [2] . В России статистический учёт заражения C. diff не ведётся. Согласно систематическому обзору за 2011 год, каждый 5-й случай из всех антибиотик-ассоциированных диарей (ААД) и каждый 2–3 случай внутрибольничной ААД в странах Европы и Северной Америки вызваны C. diff [3] .
В стационарах США среди внутрибольничных инфекций C. diff занимает первое место (12,1 % от общего количества), опережая K. pneumoniae (9, 7 %) и E. coli (9,3 %) [4] . В 2011 г. было зафиксировано более 450 тыс. случаев C. difficile-ассоциированной болезни и более 29 тыс. смертей от неё [29] .
В европейских странах заболеваемость C. diff составляет около 7 случаев на 10000 койко-дней, т. е. при средней госпитализации 10 дней, 7 случаев из 1000 госпитализаций заканчиваются ПМК. В 20 европейских странах это значение колеблется от 0,7 до 28,7 на 10000 койко-дней [5] .
В России в 2011 году было продано 295 млн упаковок антибиотиков, в 2019 — 379 млн [8] [26] . Антибактериальных препаратов потребляется всё больше, их продажа из аптек не контролируется, поэтому проблемы ААД и ПМК актуальны и в нашей стране.
В клиниках Санкт-Петербурга у пациентов с ААД тест на токсины C. diff был положительным в 47,7 % случаев [6] .
Смертность от ПМК колеблется от 9,3 до 22 % и зависит от возраста пациента, смерть чаще наступает при тяжёлом течении заболевания [7] [26] .
В настоящее время увеличилась внутри- и внебольничная заболеваемость C. difficile-ассоциированной болезнью, расширились группы риска, стали чаще встречаться рецидивы и тяжёлые формы, в том числе вызванные более патогенным штаммом BI/NAP1/027, возросла смертность [27] .
Причины псевдомембранозного колита
Основная причина болезни — это приём антибиотиков. ПМК могут вызывать любые антибактериальные препараты, но наиболее часто к нему приводит применение Клиндамицина, хинолонов, цефалоспоринов 2-го и 3-го поколения, карбапенемов. Реже ПМК развивается после приёма макролидов, пенициллина, Тетрациклина, Тигециклина.
К факторам риска, помимо приёма антибиотиков, относятся:
- возраст старше 65 лет;
- терапия ингибиторами протонной помпы и Н2-гистаминоблокаторами — препаратами, снижающими секрецию соляной кислоты в желудке;
- лечение в стационаре, особенно в отделениях реанимации, — каждые 7 дней госпитализации увеличивают риск ПМК на 8 % [1][9][10] ;
- наличие дополнительной патологии, в том числе воспалительных заболеваний кишечника, ВИЧ, сахарного диабета[31][32][33] ;
- хирургические вмешательства на органах ЖКТ;
- энтеральное питание, в том числе через назогастральный зонд;
- приём иммуносупрессивных препаратов (глюкокортикостероидов, Такролимуса) и противоопухолевых средств [31] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы псевдомембранозного колита
Наиболее частые симптомы лёгкого или умеренного псевдомембранозного колита:
- водянистая диарея (жидкие испражнения, похожие на кашицу) от трёх раз в сутки на протяжении двух и более дней в сочетании с болью в животе;
- лёгкие спазмы в животе, часто сопровождающиеся с позывами на стул, но не всегда приводящие к дефекации;
- примеси слизи, крови или гноя в испражнениях;
- температура тела 38,5 °С и более;
- тошнота или потеря аппетита.
При тяжёлом течении псевдомембранозного колита возникает водянистая диарея с кровью, уровень альбумина снижается менее 30 г/л, что сочетается с одним из следующих симптомов: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) и/или болезненностью при ощупывании живота. На фоне длительной диареи организм теряет много жидкости, что приводит к обезвоживанию и проявляется тёмно-жёлтой мочой, чувством жажды, усталости, головокружением, спутанностью сознания и заторможенностью [1] [9] .
При рецидиве болезни симптомы появляются повторно менее чем через 8 недель после окончания терапии.
Проявления псевдомембранозного колита схожи с симптомами других инфекций, поражающих толстый кишечник. Но в отличие от них признаки ПМК могут быть слабо выражены и, как правило, наблюдаются долго: от одной недели до нескольких месяцев. Также встречаются случаи, когда человек является носителем возбудителя ПМК — C. diff, но симптомы полностью отсутствуют.
Патогенез псевдомембранозного колита
В основе патогенеза ПМК лежит чрезмерное размножение бактерий C. diff на фоне уменьшения или гибели нормальной микробиоты толстого кишечника. C. diff вырабатывает токсины А и В, которые вызывают воспаление в кишечной стенке. На течение заболевания влияет состояние иммунной системы пациента и патогенные свойства бактерий, такие как вирулентность, наличие токсинов А и В.
Основной путь передачи инфекции — фекально-оральный. Бактерии попадают в организм с загрязнённых поверхностей, например с дверных ручек, смесителей, ручек смыва сливного бачка, мебели или медицинского инвентаря. Также переносить инфекцию может персонал больницы и заражённые пациенты.
Бактерии C.diff образуют споры, которые устойчивы к действию антибиотиков и могут длительно сохраняться в желудочно-кишечном тракте человека, заражая окружающих и вызывая рецидивы заболевания у самого пациента [12] .
Для некоторых людей C.diff — это часть нормальной микрофлоры ЖКТ, но в таком случае численность бактерий контролируется за счёт других микроорганизмов и работы иммунной системы.
Основные поражающие факторы C.diff — это выделяемые ею токсины [1] . Токсин А (энтеротоксин, белковая молекула с массой 308 кДа) влияет на секрецию жидкости, приводит к повреждению слизистой оболочки кишечника (мембран клеток) и вызывает воспалительный ответ со стороны иммунной системы.
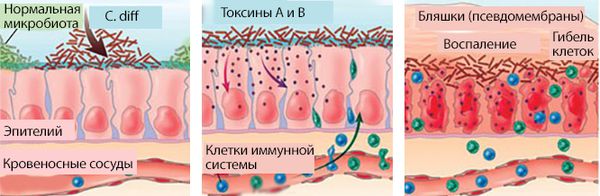
Токсин В (цитотоксин, белковая молекула с массой от 250 до 270 кДа) в 1000 раз более цитотоксичен по сравнению с токсином А. Он вызывает распад филаментного актина — белка, поддерживающего целостность клеток. В результате клетки слизистой разрушаются и гибнут. Токсин В опасен для человека, но не приводит к воспалению и повреждению слизистой оболочки кишечника у животных.
Под действием токсинов в кишечной стенке развивается специфическое воспаление с характерными изменениями на поверхности слизистой. Она становится отёчной, разрыхляется, приобретает ярко-красный цвет, на ней исчезает сосудистый рисунок. При контакте эндоскопа со слизистой капельки крови не появляются. Наблюдается множество желтовато-белых бляшек диаметром 3–5 мм, которые плотно фиксированы к слизистой оболочке. При взятии биопсии они отрываются с трудом, торцом эндоскопа не снимаются. Преобладает два типа воспалительных реакций: диффузно-катаральное воспаление слизистой и очаги фибриноидного некроза — бело-жёлтые бляшки, или псевдомембраны, поэтому такой тип колита называется псевдомембранозным.
![Бляшки при ПМК [35]](https://probolezny.ru/media/bolezny/psevdomembranoznyy-kolit/blyashki-pri-pmk-35_s.jpeg)
В биоптатах, полученных из воспалительно-изменённых участков слизистой, выявляют скопление иммунных клеток крови и слизистой, расширение капилляров и некроз клеток покровного эпителия [1] .
В биоптатах, взятых из бляшек, присутствует фибрин, обрывки некротизированного покровного эпителия, слизь, лейкоциты, плазматические клетки и колонии бактерий.
Чтобы определить патогенность клостридий, нужно выявить их токсины. Посев биоптатов на питательные среды удовлетворительных результатов не даёт. Метод в данном случае затратен и неинформативен, поэтому токсины C. diff определяют в кале.
Воспалительный процесс, как правило, захватывает несколько отделов толстого кишечника, но чаще поражена его прямая и сигмовидная часть, реже вовлекается вся толстая кишка. Протяжённость её поражения связана с тяжестью течения заболевания: чем больше толстого кишечника вовлечено в воспалительный процесс, тем тяжелее протекает колит и ярче симптомы.
Продолжительное воспаление в кишечной стенке приводит к следующим нарушениям:
- не всасывается жидкость, из-за чего развивается обезвоживание;
- потери крови из образующихся эрозий и язв приводят к анемии;
- кишечная стенка становится проницаемой для токсинов возбудителя и продуктов его жизнедеятельности, находящихся в просвете кишки, из-за чего нарастает общая интоксикация.
При тяжёлом течении прекращается перистальтика толстого кишечника, развивается токсический мегаколон и возникает полиорганная недостаточность, из-за чего пациент может погибнуть.
Классификация и стадии развития псевдомембранозного колита
ПМК входит в группу антибиотик-ассоциированных диарей. В Международной классификации болезней (МКБ-10) псевдомембранозный колит кодируется как АО 4.7 — Энтероколит, вызванный Clostridium difficile.
В зависимости от тяжести течения болезни и клинической картины выделяют следующие формы:
- ПМК лёгкой или умеренной тяжести. Проявляется диареей — неоформленным жидким, кашицеобразным стулом три или более раз в сутки и болью в животе.
- ПМК тяжёлого течения. Сопровождается водянистой диареей с кровью и изменениями в анализах. В биохимическом анализе крови отмечается низкий уровень альбумина (меньше 30 г/л), который сочетается с одним из следующих признаков: высоким уровнем лейкоцитов в клиническом анализе крови (> 15×10 9 /л) в клиническом анализе крови и/или болезненностью при ощупывании живота.
- Осложнённые формы ПМК. Протекают с водянистой диареей с кровью и одним из следующих симптомов: снижение артериального давления, температура тела ≥ 38,5 °C, отсутствие перистальтики тонкого кишечника, помрачение или угнетение сознания. В клиническом анализе крови лейкоциты повышены > 25×10 9 /л или снижены < 2×10 9 /л, возникает органная и почечная недостаточность, требуется искусственная вентиляция лёгких.
- Рецидивирующее течение ПМК. Заболевание развивается повторно менее чем через 8 недель после окончания терапии [1][14] .
Данная классификация используется для выбора схемы лечения.
Осложнения псевдомембранозного колита
Наиболее частые осложнения псевдомембранозного колита:
- Обезвоживание и электролитные нарушения — из-за сильной и длительной диареи нарушается ритм сердца, снижается артериальное давление и мышечный тонус. Чаще эти осложнения развиваются при недостаточном восполнении потерянной жидкости и солей.
- Почечная недостаточность — при стремительном обезвоживании нарушается работа почек, из-за чего снижается частота мочеиспусканий, появляются отёки, по анализам крови видно, что растёт содержание азотистых шлаков.
- Токсический мегаколон — расширение толстой кишки, редкое осложнение с плохим прогнозом. На фоне диареи частота стула резко урежается до одного раза в сутки, в дальнейшем дефекация прекращается полностью. Это происходит из-за замедления и полного прекращения перистальтики толстого кишечника. Из-за распирания толстого кишечника газами и содержимым нарастает вздутие живота, усиливается боль в нём. Интоксикация и электролитные нарушения приводят к резкому ухудшению самочувствия и выраженной слабости. В дальнейшем стенка кишки разрывается, содержимое изливается в брюшную полость (перфорация кишечника) и начинается перитонит. Как правило, это осложнение наблюдается у ослабленных пациентов, находящихся в отделении реанимации и хирургии.
- Перфорация кишечной стенки — образуется сквозное отверстие в кишечной стенке с излитием содержимого кишечника в брюшную полость и развитием перитонита.
- Полиорганная недостаточность — может привести к гибели пациента [1][15] .
Диагностика псевдомембранозного колита
Тесты на C. diff показаны при длительной диарее с болью в животе и/или примесью крови в стуле, возникшей спустя 3–60 суток после выписки из стационара и/или после приёма антибиотиков [1] .
Чтобы выявить токсигенные штаммы C. diff, токсины A и B определяют в кале [16] .
Для этого используют следующие методы:
- Цитотоксиновый копрологический тест. Чувствительность — 95 %, специфичность — 99 %, результат — в течение 2–3 дней.
- ELISA (Enzyme Linked Immuno Sorbent Assay) — фермент-связанный иммуносорбентный тест для определения токсинов. Чувствительность — 70–90 %, специфичность — 99 %, результат — через 4–6 часов.
- ПЦР (полимеразная цепная реакция) на токсин В. Чувствительность — 96 %, специфичность — 100 %, результат — в течение нескольких часов.
Чувствительность теста — это доля положительных результатов среди больных людей, т. е. вероятность правильно определить инфекцию у заболевших, отсутствие ложноотрицательных результатов. Специфичность — доля отрицательных результатов среди здоровых людей, т. е. отсутствие ложноположительных результатов.
Посев кала на C.diff не проводится, так как этим методом не удаётся определить токсигенные штаммы.
С помощью дополнительных методов можно оценить тяжесть состояния пациента и своевременно выявить осложнения.
К дополнительным обследованиям относятся:
- ректороманоскопия или сигмоидоскопия — позволяют обнаружить типичные изменения стенки кишки (множественные желтоватые бляшки 2–10 мм в диаметре, плотно фиксированные на поверхности слизистой оболочки);
- колоноскопия — помимо типичных изменений кишечной стенки, определяется распространённость процесса и поражение толстого кишечника выше сигмовидной кишки [17] ;
- обзорная рентгенография органов брюшной полости — используется, чтобы выявить признаки пареза кишечника и токсического расширения кишки;
- анализ крови — показывает уровень лейкоцитов (при ПМК повышен до 10–50 × 10 9 ), уровень креатинина (выше нормы) и альбумина (ниже нормы).
Гистологическое исследование биоптатов не является необходимым при C. difficile-ассоциированной болезни, но может быть крайне важным для дифференциальной диагностики.
Лечение псевдомембранозного колита
Методы лечения псевдомембранозного колита в российских и зарубежных клинических рекомендациях совпадают [1] [18] . При лёгком и среднетяжёлом течении его проводят в амбулаторных условиях (дома), при тяжёлом и/или осложнённом — в стационаре.
Для лечения ПМК назначаются антибиотики:
- Терапия первой линии — Метронидазол[19] . Препарат хорошо всасывается при приёме внутрь, применяется в течение 10 дней.
- Терапия второй линии — Ванкомицин. Применяется, если не эффективен Метронидазол и/или при тяжёлом течении заболевания. Плохо всасывается в кишечнике при приёме внутрь и оказывает преимущественно местное действие [20] . Курс также составляет 10 дней.
- Терапия резерва — Фидаксомицин, бактерицидный антибиотик группы макролидов местного действия, в России не зарегистрирован [21] .
- При осложнённом течении применяется комбинация Ванкомицин + Метронидазол. Лечение проводится в стационаре.
Антибиотики подавляют развитие C. diff. Бактерия чувствительна только к трём перечисленным антибактериальным препаратам.
При развитии осложнений ПМК могут применяться следующие методы:
- При токсическом мегаколоне показана колэктомия — удаление толстой кишки.
- Для лечения рецидивирующего ПМК в качестве экспериментального метода рассматривается трансплантация кишечной микробиоты (fecal microbiota transplantation, FMT) [23][24][25] . Кишечную микробиоту берут от здорового донора и при помощи назоинтестинального зонда, клизмы или колоноскопии переносят пациенту в кишечник. В России такое лечение считается экспериментальным. Проводится в научных клинических учреждениях, например в Федеральном научно-клиническом центре ФМБА России.
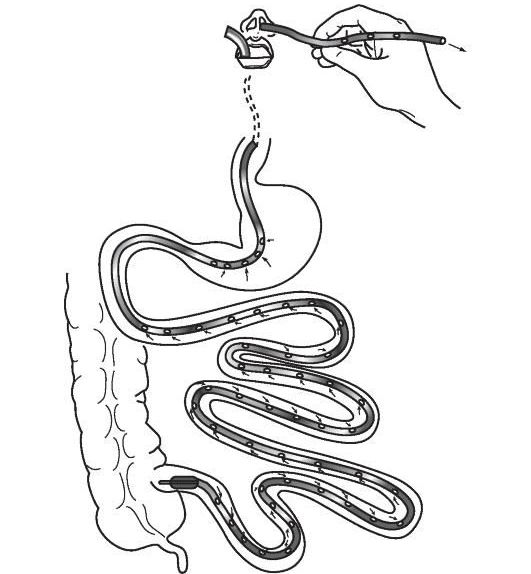
В качестве вспомогательных и симптоматических препаратов используются:
- Сорбенты (Диоктаэдрический смектит) — эффективно удаляет токсины C. diff, снижая их действие на кишечную стенку, улучшает качество стула.
- Пробиотики (Lactobacillus rhamnosus, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium infantis не менее 1×10 9 КОЕ/г) — подавляют активность C. diff. Данные об их эффективности пока противоречивы [22] .
- Препараты на основе дрожжей Saccharomyces cerevisiae (boulardii) — эффективны как вспомогательные и профилактические средства.
Прогноз. Профилактика
При лёгком или среднетяжёлом течении ПМК и хорошей реакции на стандартную терапию прогноз благоприятный, при тяжёлом и осложнённом — неблагоприятный. При рецидивирующем течении прогноз сомнительный, так как не разработаны эффективные схемы лечения.
Профилактика псевдомембранозного колита
Для профилактики развития ПМК следует:
- чаще мыть руки и соблюдать правила личной гигиены;
- рационально принимать антибиотики — строго по назначению врача с соблюдением всех указаний;
- изолировать пациентов с инфекцией C. diff в отдельные палаты, соблюдать меры санитарного режима;
- тщательно обрабатывать все поверхности хлорсодержащими или другими дезинфицирующими средствами, активными против спор C. diff;
- сокращать сроки госпитализации пациентов старше 65 лет [16] .
Чтобы предотвратить рецидив C. difficile-ассоциированной болезни, после завершения лечения Метронидазолом или Ванкомицином назначаются пробиотики курсом не менее трёх месяцев. Серьёзных побочных эффектов от них не выявлено [34] .
Язвенный колит у детей

2. Хроническое непрерывное течение (отсутствие более чем 6-месячных периодов ремиссии на фоне адекватной терапии).
3. Хроническое рецидивирующее течение (наличие более чем 6-месячных периодов ремиссии).
Тяжесть заболевания (активность) в целом определяется: тяжестью текущей атаки, наличием внекишечных проявлений и осложнений, рефрактерностью к лечению, в частности, развитием гормональной зависимости и резистентности. Для формулирования диагноза и определения тактики лечения следует определять тяжесть текущего обострения (атаки), для чего используют педиатрический индекс активности ЯК Pediatric Ulcerative Colitis Activity Index (PUCAI). Выделяют легкую, среднетяжелую и тяжелую атаки ЯК (Приложение Г1).
Классификация ЯК в зависимости от ответа на гормональную терапию облегчает выбор рациональной лечебной тактики, поскольку целью консервативного лечения является достижение стойкой ремиссии с прекращением терапии ГКС. Для этих целей выделяются:
• стероидрезистентность (сохранение активности заболевания несмотря на пероральный прием адекватной дозы ГКС в течение 7-14 дней).
• стероидзависимость (определяется при достижении клинической ремиссии на фоне терапии кортикостероидами и возобновлении симптомов при снижении дозы или в течение 3 месяцев после полной отмены, а также в случаях, если терапию стероидами не удается прекратить в течение 14-16 недель).
Клиническая ремиссия – отсутствие клинических симптомов заболевания и воспалительной активности по результатам лабораторных исследований крови (PUCAI
Клинико-эндоскопическая (или полная) ремиссия – наличие клинической ремиссии и полное заживление слизистой оболочки.
Появление типичных симптомов заболевания у больных ЯК в стадии клинической ремиссии, спонтанной или медикаментозно поддерживаемой.
При формулировании диагноза следует отразить характер течения заболевания, протяженность поражения, тяжесть текущей атаки или наличие ремиссии, наличие гормональной зависимости или резистентности, а также наличие внекишечных или кишечных осложнений ЯК. Ниже приведены примеры формулировок диагноза:
• Язвенный колит, хроническое непрерывное течение, левостороннее поражение, среднетяжелая атака. Гормональная зависимость. Внекишечные проявления (первичный склерозирующий холангит)
• Язвенный колит, хроническое рецидивирующее течение, тотальное поражение, тяжелая атака. Гормональная резистентность. Токсический мегаколон
Этиология и патогенез
Этиология воспалительных заболеваний кишечника (ВЗК), в том числе ЯК, не установлена: заболевание развивается в результате сочетания нескольких факторов, включающих генетическую предрасположенность, дефекты врожденного и приобретенного иммунитета, кишечную микрофлору и различные факторы окружающей среды. Генетический фон предрасполагает к изменениям врожденного иммунного ответа, аутофагии, механизмов распознавания микроорганизмов, эндоплазматического ретикулоцитарного стресса, функций эпителиального барьера и адаптивного иммунного ответа. Ключевым дефектом иммунитета, приводящим к развитию ВЗК, является нарушения распознавания бактериальных молекулярных маркеров дендритными клетками, что приводит к гиперактивации сигнальных провоспалительных путей. Также при ВЗК отмечается снижение разнообразия кишечной микрофлоры за счет снижения доли анаэробных бактерий, преимущественно Bacteroidetes и Firmicutes. При наличии указанных микробиологических и иммунологических изменений ВЗК развивается под действием пусковых факторов, к которым относят курение, нервный стресс, дефицит витамина D, питание с пониженным содержанием пищевых волокон и повышенным содержанием животного белка, кишечные инфекции, особенно инфекцию C.difficile.
Результатом взаимного влияния данных факторов риска является активация Th2-клеток, гиперэкспрессия провоспалительных цитокинов, в первую очередь, фактора некроза опухоли-альфа и молекул клеточной адгезии. Недостаточность иммунной регуляции приводит к неконтролируемым ответам на повреждение ткани и развитию локального воспаления. Результатом этих реакций становится лимфоплазмоцитарная инфильтрация слизистой оболочки толстой кишки с развитием характерных макроскопических изменений и симптомов ЯК.
При ЯК поражается только толстая кишка (за исключением ретроградного илеита), в процесс обязательно вовлекается прямая кишка, воспаление чаще всего ограничивается слизистой оболочкой (за исключением острого тяжелого колита) и носит диффузный характер.
Эпидемиология
Заболеваемость ЯК у детей колеблется от 1 до 4 случаев на 100 000 жителей в Северной Америке и Европе [3-5], что составляет приблизительно 15-20% от больных ЯК всех возрастов. Данные о распространенности ЯК в Российской Федерации ограничены. Распространенность ЯК выше в северных широтах и на Западе. Заболеваемость и распространенность ЯК в Азии ниже, однако, увеличивается. Европеоиды страдают заболеванием чаще, чем представители негроидной и монголоидной рас. Пик заболеваемости отмечается между 20 и 30 годами жизни, а второй пик заболеваемости описан в возрасте 60-70 лет. Заболеваемость приблизительно одинакова у мужчин и женщин.
Диагностика
Диагноз ЯК у детей должен устанавливаться на основании сочетания данных анамнеза, физикального осмотра и илеоколоноскопии с множественной биопсией, выполненной гастроэнтерологом с педиатрической специализацией.
Единого критерия для постановки диагноза ЯК не существует. Как правило, диагноз ЯК следует подозревать у ребенка с хронической (≥4 недель) или повторяющейся (≥2 эпизодов в течение 6 мес) диареей с кровью, тенезмами, болями в животе после исключения инфекционных и других причин, а в тяжелых случаях – с потерей массы тела, общей слабостью и рвотой. Особенно настораживающими данными в отношении ВЗК у ребенка являются сопутствующая задержка роста и/или пубертатного развития, наличии ВЗК в семье, повышении маркеров воспаления или наличии анемии.
Язвенный колит, дебютирующий в детском возрасте, оказывается тотальным в 60-80% всех случаев, то есть в два раза чаще, чем у взрослых [6]. Поскольку доказано, что протяженность поражения коррелирует с большей активностью заболевания, в детском возрасте при первой атаке течение болезни становится более тяжелым, приводя к колэктомии у 30-40% детей в течение 10 лет, по сравнению с 20% у взрослых [6,7]. Кроме того, при лечении детей приходится учитывать возрастные особенности, такие как рост, половое развитие, питание и прирост минеральной плотности костной ткани (МПК) в подростковом возрасте, а также особенности психосоциального поведения и развития [8,9,10].
• Для формулирования диагноза и определения тактики лечения рекомендовано определять тяжесть текущего обострения (атаки), для чего применяют педиатрический индекс активности ЯК (PUCAI). Выделяют легкую, среднетяжелую и тяжелую атаки ЯК (Приложение Г1) [81].
(Уровень убедительности рекомендаций В, Уровень достоверности доказательств 1b)
• Внекишечные симптомы (поражение кожи, слизистых, суставов, глаз, первичный склерозирующий холангит и др.)
При физикальном осмотре могут быть обнаружены различные проявления ЯК, включая лихорадку, периферические отеки, дефицит питания, наличие признаков перфорации или токсической дилатации толстой кишки, а также внекишечных проявлений.
• При проведении физикального обследования рекомендовано включать осмотр перианальной области, пальцевое исследование прямой кишки
• Для уточнения локализации и объема поражения рекомендовано обратить внимание на следующую симптоматику:
— Стул ежедневный 1-2 раза в день, может быть нормальным оформленным или спастического характера, кровь располагается на каловых массах в виде ректального «плевка» или мазка, учащение ночных дефекаций, частые тенезмы
— Стул учащенный до 20-50 раз в сутки, примесь крови в большом количестве и перемешана с каловыми массами
— Дефицит массы тела.
• Всем пациентам рекомендовано проводить клинический анализ крови (гематокрит, скорость оседания эритроцитов (СОЭ), определять С-реактивный белок, гемокоагулограмму, определять общий белок, альбумины, печеночные пробы, электролиты, оценить обмен железа.
Комментарии: лабораторные проявления ЯК носят неспецифический характер. При клиническом анализе крови могут быть диагностированы анемия (железодефицитная, анемии хронического заболевания), лейкоцитоз (на фоне хронического воспаления или на фоне стероидной терапии), тромбоцитоз. Биохимическое исследование позволяет выявить электролитные нарушения, гипопротеинемию (в частности, гипоальбуминемию), а также повышение щелочной фосфатазы, что является возможным проявлением ассоциированного с ЯК первичного склерозирующего холангита.
Уровень маркеров воспаления у детей с активным колитом может быть нормальным, особенно при слабой активности заболевания.[9,10]
• Серологические маркеры (антинейтрофильные цитоплазматические антитела, антитела к saccharomyces cerivisiae) рекомендовано использовать для дифференциальной диагностики между ЯК и БК; диагноз ЯК следует оценить повторно при положительных результатах анализа на антитела к saccharomyces cerivisiae. [10]
Комментарии: отсутствие серологических маркеров, особенно у детей раннего возраста, не является основанием для исключения или пересмотра диагноза ЯК.
• При остром течении ЯК (первой атаке заболевания) рекомендовано выполнить бактериологическое и микроскопическое исследование кала для исключения острой кишечной инфекции. Как при дебюте заболевания, так и при обострениях, рекомендуется исследование токсинов А и В C.difficile (особенно, при недавно проведенном курсе антибиотикотерапии или пребывании в стационаре), определение токсина Clostirium difficile рекомендуется проводить не менее, чем в 3 отдельных порциях стула. Данное исследование также рекомендуется выполнять при развитии тяжелой резистентности к проводимой терапии [11].
Комментарии: для выявления инфекции в 90% случаев требуется минимум 4 образца кала [14,15]. При первичной дифференциальной диагностике язвенного колита с функциональными заболеваниями кишечника, а также для неинвазивной оценки активности воспалительного процесса в кишечнике на фоне лечения [14,15] возможно исследование уровня фекального кальпротектина.
• Фекальные маркеры воспаления, в наибольшей степени – кальпротектин, позволяют эффективно дифференцировать колит от диареи невоспалительной природы. При наличии кровавой диареи, указывающей на воспаление толстой кишки, определение фекальных маркеров не рекомендовано для постановки диагноза ЯК, однако может оказаться полезным для наблюдения в динамике.
Комментарии: На момент дебюта концентрация маркеров воспаления оказывается выше при БК, чем при ЯК [16, 17]. При впервые выявленном ЯК у 54% пациентов с легкой атакой результаты анализа 4 наиболее часто используемых маркеров (гемоглобина, альбумина, тромбоцитов и СОЭ) могут находиться в пределах нормы, в то время как при легкой атаке БК доля нормальных результатов составляет 21% [16]. Несмотря на то, что фекальный кальпротектин превосходит по информативности маркеры воспаления, определяемые в крови [18,19], остается неизвестным, является ли рутинное исследование кальпротектина у детей более точным, чем обычная клиническая оценка. В условиях острой тяжелой атаки у детей клинический индекс PUCAI с большей точностью прогнозировал краткосрочный клинический ответ, чем 5 фекальных биомаркеров [20, 21]. Фекальные биомаркеры, вне сомнения, могут применяться в отдельных случаях, при которых связь симптомов с воспалением слизистой оболочки остается спорной (например, при диарее без крови).
Диагностика ЯК преимущественно основана на инструментальных методах исследования. Для подтверждения диагноза необходимы следующие мероприятия:
• Рекомендовано проводить осмотр перианальной области, пальцевое исследование прямой кишки, ректороманоскопию
• Рекомендовано проведение обзорной рентгенографии брюшной полости (при тяжелой атаке) для исключения токсической дилятации и перфорации толстой кишки;
• Рекомендовано проведение колоноскопии с илеоскопией. Данные исследования являются обязательной процедурой для установления диагноза ЯК, а также для решения вопроса о колэктомии. Визуализация тонкой кишки рекомендована для исключения болезни Крона (БК), особенно у пациентов с нетипичной клинической симптоматикой [9,10].
Комментарии: эндоскопическое исследование толстой кишки является основным методом диагностики ЯК, однако специфичные эндоскопические признаки отсутствуют. Наиболее характерными являются непрерывное воспаление, ограниченное слизистой оболочкой, начинающееся в прямой кишке и распространяющееся проксимальнее, с четкой границей воспаления. Эндоскопическую активность ЯК наилучшим образом отражают контактная ранимость (выделение крови при контакте с эндоскопом), отсутствие сосудистого рисунка и наличие или отсутствие эрозий и изъязвлений (Уровень достоверности доказательств 2b, уровень убедительности рекомендаций В).
Эндоскопическая оценка рекомендована при постановке диагноза, существенных изменениях схемы лечения и затруднениях в оценке клинических симптомов. Эндоскопическое исследование у детей не следует проводить рутинно при нетяжелых обострениях или в период ремиссии, при отсутствии подозрений на развитие колоректального рака [22].
Поскольку различные обнаруживаемые проявления в отдельности могут не соответствовать ЯК, при диагностике ВЗК у детей важно выполнить полную илеоколоноскопию и эндоскопическое исследование верхних отделов ЖКТ с серийной биопсией. У пациентов с острым тяжелым колитом, диагностическая сигмоскопия может использоваться в качестве первого исследования для оценки состояния, однако, в дальнейшем следует провести контрольную колоноскопию.
• Рекомендовано при проведении биопсии при постановке диагноза взятие биоптатов слизистой оболочки прямой кишки и не менее чем из 4 других участков толстой кишки, а также слизистой оболочки подвздошной кишки [8]
Комментарии: к микроскопическими признакам ЯК относятся деформация крипт (разветвленность, разнонаправленность, появление крипт разного диаметра, уменьшение плотности крипт, «укорочение крипт», крипты не достигают подлежащего слоя мышечной пластинки слизистой оболочки), «неровная» поверхность слизистой в биоптате слизистой оболочки, уменьшение числа бокаловидных клеток, базальный плазмоцитоз, инфильтрация собственной пластинки слизистой оболочки, наличие крипт-абсцессов и базальных лимфоидных скоплений. Степень воспалительной инфильтрации обычно уменьшается по мере удаления от прямой кишки.
• Рекомендовано при длительном анамнезе ЯК (более 7-10 лет) проведение хромоэндоскопии с прицельной биопсией или ступенчатой биопсии (из каждого отдела толстой кишки) для исключения дисплазии эпителия [8]
Комментарий: Интактность прямой кишки, очаговые макроскопические изменения, а также нормальная или минимально измененная архитектоника крипт на момент дебюта заболевания чаще встречается у детей младшего возраста [23,24]. Подобные особенности характерны для детей в возрасте 10 лет и младше [25]. Легкий неэрозивный илеит при наличии тяжелого панколита может быть следствием ретроградного илеита, ассоциированного с ЯК, и микроскопически может проявляться атрофией ворсинок, повышением содержания мононуклеарных клеток и несгруппированными крипт-абсцессами [26]. У 1 из 13 пациентов с колитом, диагноз БК может быть установлен на основании изменений, найденных при эндоскопии верхних отделов ЖКТ (24).
• При обнаружении стойкого сужения кишки на фоне ЯК рекомендовано обязательно исключить колоректальный рак.
• Рекомендовано проведение ультразвукового исследования органов брюшной полости, забрюшинного пространства, малого таза
• При необходимости дифференциальной диагностики или при невозможности проведения полноценной илеоколоноскопии рекомендовано проведение следующих визуализационных исследований:
— Компьютерная томография (КТ) с контрастированием кишечника.
• При невозможности выполнения МРТ или КТ рекомендовано проведение ирригоскопии с двойным контрастированием (для оценки протяженности поражения в толстой кишке, уточнения наличия образований, стриктур и др.).
Дифференциальный диагноз
Дополнительные инструментальные и лабораторные исследования выполняются преимущественно с целью проведения дифференциальной диагностики с рядом заболеваний. Это инфекционные, сосудистые, медикаментозные, токсические и радиационные поражения, а также дивертикулит и др. На следующем этапе дифференциальной диагностики проводится верификация клинических диагнозов ЯК и БК, относящихся к группе ВЗК. Таким образом, дифференциальный диагноз ЯК проводится с болезнью Крона толстой кишки, острыми кишечными инфекциями (дизентерия, сальмонеллез, кампилобактериоз, иерсиниоз, амебиаз), паразитозами, антибиотико-ассоциированными поражениями кишечника (псевдомембранозный колит, вызываемый C.difficile) [28], туберкулезом кишечника, системными васкулитами, раком толстой кишки, дивертикулитом, микроскопическими колитами (коллагеновым и лимфоцитарным) [29], радиационным проктитом. В приложении Г2 указаны основные заболевания, с которыми следует проводить дифференциальную диагностику ЯК у детей.
• С целью дифференциальной диагностики и подбора терапии при внекишечных проявлениях ЯК и сопутствующих состояниях рекомендовано провести консультации:
— Эндокринолога (стероидный сахарный диабет, надпочечниковая недостаточность у больных на длительной гормональной терапии);
— Ревматолога (артропатии, сакроилеит и т.п.).
• У детей моложе 2 лет рекомендовано исключать колит, связанный с первичным иммунодефицитом или аллергическими состояниями. [10]
Комментарии: Иммунологические исследования включает фенотипирование лимфоцитов (Т, В, NK, NK-T клетки), определение уровня иммуноглобулинов, а также функциональные анализы ответа лимфоцитов на антигены/митогены и нейтрофилы, включая анализ на хроническую гранулематозную болезнь (ХГБ). Аллергологические пробы у детей выполняются преимущественно путем исключения определенных продуктов питания.
Воспаление толстой кишки у младенцев (особенно младше 1 года) может являться проявлением аллергического колита или иммунодефицита, даже если это единственный симптом. Хотя в этом случаев ребенку следует провести аллергологическое обследование, только проба с элиминационной диетой позволяет подтвердить диагноз аллергического колита [30]. До подтверждения ВЗК, развившегося в раннем детском возрасте, следует исключить классические или скрытые иммунодефицитные состояния [31-33].
Лечение
Лечебные мероприятия при ЯК включают в себя назначение лекарственных препаратов, хирургическое лечение, психосоциальную поддержку и диетические рекомендации.
Выбор вида консервативного или хирургического лечения определяется тяжестью атаки, протяженностью поражения толстой кишки, наличием внекишечных проявлений, длительностью анамнеза, эффективностью и безопасностью ранее проводившейся терапии, а также риском развития осложнений ЯК [34,35].
Целью терапии является достижение и поддержание беcстероидной ремиссии (прекращение приема ГКС в течение 12 недель после начала терапии) [36], профилактика осложнений ЯК, предупреждение операции, а при прогрессировании процесса и развитии опасных для жизни осложнений – своевременное назначение хирургического лечения. Поскольку полное излечение больных ЯК достигается только путем удаления субстрата заболевания (колпроктэктомии), при достижении ремиссии неоперированный больной должен оставаться на постоянной поддерживающей (противорецидивной) терапии.
• Нутритивный статус и рост детей с ЯК должен регулярно оцениваться; при необходимости рекомендовано применять нутритивную поддержку [10].
• Энтеральное или парентеральное питание в качестве основного средства лечения ЯК не рекомендовано применять[10].
• Специальная диета или пищевые добавки неэффективны и не рекомендованы к использованию для индукции и поддержания ремиссии при ЯК у детей, а в некоторых случаях могут способствовать дефициту питательных веществ.
(Уровень убедительности рекомендаций 5; Уровень достоверности доказательств D)
• Рекомендовано дробное питание с обеспечением химического и механического щажения слизистой оболочки c исключением продуктов, усиливающих перистальтику и обладающих аллергенным и раздражающим действием (кофе, шоколад, жирная и острая пища).
• Пероральное назначение препаратов 5-АСК (Месалазин (Код АТХ: A07EC02) и сульфасалазинж,вк (Код ATX: A07EC01)) рекомендовано в качестве терапии первой линии для индукции и поддержания ремиссии у детей при легкой и среднетяжелой активности язвенного колита [36].
Комментарии: пероральный месалазин назначается дозе от 60 до 80 мг/кг в сутки (не более 4,8 г/сутки) в 2 приема. Сульфасалазин применяется в дозе 70-100 мг/кг/сут (максимальная доза 4 г/сутки). Максимальная доза пероральных и ректальных препаратов обычно не превосходит стандартную дозу для перорального приема более чем на 50% или 6,4 г/сутки у взрослых. Постепенное увеличение дозы сульфасалазина в течение 7-14 дней может снизить риск дозозависимых нежелательных явлений, таких как головные боли и расстройства желудочно-кишечного тракта (ЖКТ).
Возможен однократный прием препаратов 5-АСК, о чем сообщается в ряде исследований, свидетельствующих о равной эффективности однократного и двукратного применения дозы 5-АСК.
Острая непереносимость 5-СК может имитировать картину обострения колита. Улучшение состояния после отмены 5-СК и появление симптомов после повторного ее назначения позволяет верифицировать причину состояния и является противопоказанием к назначению любых препаратов, содержащих 5-АСК.
• Рекомендована комбинация пероральных 5-АСК с местным применением 5-АСК, так как этот метод более эффективен, чем применение каждого препарата по-отдельности [37].
Комментарии: ректальные препараты 5-АСК назначаются в дозе 25 мг/кг (до 1 г/сутки).
• Ректальное назначение 5-АСК более эффективно и рекомендовано ему отдавать предпочтение по сравнению с ректальным назначением стероидов [36].
Комментарии: Детям следует попытаться назначить ректальную терапию, однако не нужно на ней настаивать. Однократное введение ректальных форм может улучшить приверженность к лечению, не снижая клинической эффективности терапии.
Для эффективного местного лечения необходимо обеспечить оптимальную приверженность к лечению, что требует поддержки ребенка и родителей, их обучения, убеждения и разъяснения тревожащих их вопросов.
• Поддерживающую терапию препаратами 5-АСК рекомендовано проводить неограниченно долго (при условии переносимости). Поддерживающая доза должна равняться дозе, использованной для индукции ремиссии, хотя возможно применение меньшей дозы (не менее 40 мг/кг или 2,4 г/сутки; минимальная эффективная доза у взрослых составляет 1,2 г/сутки) после достижения устойчивой ремиссии [10].
• При отсутствии ответа на пероральный месалазин в течение 2 недель рекомендовано назначение альтернативного лечения, например, подключение местной терапии (если еще не проводится) или назначение пероральных кортикостероидов [10].
• Пероральные стероиды рекомендовано использовать для индукции ремиссии, но не для ее поддержания при язвенном колите у детей [10,36].
• Пероральные стероиды рекомендовано применять при среднетяжелой атаке с системными проявлениями и у отдельных пациентов детского возраста с тяжелой атакой без системных проявлений или у пациентов, не достигших ремиссии на фоне терапии оптимальной дозой 5-АСК. При тяжелой атаке проводится внутривенная стероидная терапия [10].
• Доза преднизона (Код АТХ: H02AB07) / преднизолонаж,вк (Код АТХ H02AB06) составляет 1 мг/кг и не рекомендовано ее превышать, у большинства детей она составляет 40 мг в сутки однократно [10]
Комментарии: с целью уменьшения потенциального риска подавления роста рекомендуется однократный прием всей дозы утром. Ориентировочная схема применения стероидов у детей представлена в Таблице 1

Таблица 1 — Схема снижения дозы преднизолона детям с язвенным колитом (в мг/сутки)
Первые 2-3 недели: начало терапии преднизолоном в дозе 1 мг/кг (до 60 мг) однократно в сутки (*для купирования атаки тяжелого язвенного колита может применяться доза до 60 мг/сутки перорально, а также внутривенно до 3-5 мг/кг). При отсутствии значимого клинического улучшения у пациентов со среднетяжелым и тяжелым колитом (снижение PUCAI на
После первых 2-3 недель терапии: при PUCAI от 15 до 30 продолжить прием преднизолона в той же дозе (увеличение общей продолжительности приема на 1 неделю); PUCAI >35: увеличение дозы до использовавшейся на 1-2 этапах лечения, в течение недели, затем начать снижение дозы с меньшей скоростью; PUCAI >60 или повышение PUCAI не менее чем на 20 баллов на любом этапе лечения: рассмотреть возможность усиления терапии. В любой ситуации следует избегать гормональной зависимости путем усиления поддерживающей терапии.
Риск обострения меньше при использовании дозы преднизолона >20 мг, однако, частота нежелательных явлений при использовании высокой дозы увеличивается. Снижение дозы в связи с этим следует начать как можно раньше и в начале курса стероидов снижать дозу более интенсивно, замедлив скорость уменьшения дозы в дальнейшем. В некоторых случаях возможно сокращение каждого этапа терапии с 7 до 5 дней. По достижению малой дозы для снижения риска нежелательных явлений возможен прием препарата через день. Следует помнить о возможности надпочечниковой недостаточности даже спустя много месяцев после отмены стероидов.
Заживление слизистой оболочки на фоне приема стероидов при ЯК достигается чаще, чем при БК, однако отстает от клинического улучшения [22]. У детей особенно важно оценить ответ на максимально раннем этапе для быстрого начала снижения дозы и уменьшения продолжительности лечения. Обязательным является сокращение необоснованного приема стероидов для минимизации задержки роста и других, связанных с приемом стероидов, нежелательных явлений. Гормональная терапия может снижать концентрацию кальпротектина по мере ослабления активности заболевания, однако нормализация его уровня отмечается нечасто [38]. Повышенный уровень кальпротектина не требует продолжения гормональной терапии, если пациент находится в состоянии клинической ремиссии.
Разделение суточной дозы на несколько приемов по эффективности не превышало однократный прием [39]. У детей, страдающих ЯК, по сравнению с взрослыми, частота осложнений стероидной терапии, включая остеопороз, глаукому и катаракту, может быть выше даже при назначении дозы, рассчитанной по массе тела [40]. В большинстве случаев при отсутствии клинической симптоматики применение препаратов, подавляющих секрецию соляной кислоты, не требуется. Их следует назначить при поражении верхних отделов ЖКТ или при приеме нестероидных противовоспалительных препаратов.
Способы профилактики гормональной зависимости включают оптимизацию дозы 5-АСК, сопутствующую терапию клизмами и усиление базисной терапии с подключением тиопуринов или инфликсимаба. Следует убедиться в соблюдении медицинских назначений, особенно у подростков. При невозможности преодолеть гормональную зависимость консервативными средствами следует рассмотреть возможность колэктомии.
• Антибактериальная терапия при ЯК у детей не рекомендована для индукции или поддержания ремиссии в амбулаторной практике [10].
Комментарии: однако применяется в случае развития осложнений или в качестве дополнения к стандартной терапии в острый период.
• Тиопурины (азатиоприн ж,вк , код ATX: L04AX01; или 6-меркаптопурин ж,вк (код АТХ: L01BB02) рекомендовано назначать для поддержания ремиссии у детей с непереносимостью 5-АСК или у пациентов с часто рецидивирующим течением (2-3 обострения в год) или развитием гормонозависимой формы заболевания на фоне проведения терапии 5-АСК в максимальных дозах [41]
Комментарии: терапевтический эффект тиопуринов достигается через 10-14 недель от начала лечения. Доза может корректироваться приблизительно до 2,5 мг/кг для азатиоприна или 1-1,5 мг/кг для 6-меркаптопурина и приниматься однократно.
Азатиоприн превосходит плацебо для поддержания ремиссии ЯК [41], обладая приблизительно 60% эффективностью [42, 43]. Ретроспективные исследования у детей подтвердили эффективность тиопуринов в поддержании ремиссии и преодолении стероидной зависимости [44-46]. Средний период времени до достижения стабильного уровня тиопуринов составил 55 сут [47].
С учетом эффективности и безопасности аминосалицилатов для поддержания ремиссии применение тиопуринов следует ограничить пациентами с непереносимостью 5-АСК и детям, у которых отмечена тяжелая атака ЯК, т. е. в случае повышенного риска агрессивного течения заболевания.
Учитывая хороший профиль безопасности и высокую эффективность 5-СК, в т. ч. и для профилактики колоректального рака, нельзя исключить целесообразность сочетанного применения 5-АСК с тиопуринами. В то же время увеличение числа принимаемых таблеток может снизить приверженность детей к лечению.
Не зависящие от дозы побочные эффекты тиопуринов включают лихорадку, панкреатит, артралгию, тошноту, рвоту и диарею, дозозависимые токсические реакции (лейкопению, тромбоцитопению, инфекции и гепатит) [48]. Панкреатит — наиболее часто обнаруживаемая реакция гиперчувствительности, отмечаемая у 3–4% пациентов и практически всегда развивающаяся в течение первых нескольких недель лечения. Наибольший риск для детей, принимающих иммуносупрессоры, представляют инфекции [49,50], хотя тяжелые инфекции развиваются редко.
• Тиопурины рекомендуются для поддерживающей терапии при остром тяжелом колите после индукции ремиссии при помощи стероидов [9].
Комментарии: Терапию тиопуринами рекомендовано прекратить при клинически значимой миелосупрессии или панкреатите. Назначать тиопурины повторно после лейкопении следует в меньшей дозе, после тщательной оценки риска и пользы от лечения. Переход с азатиоприна на 6-меркаптопурин может быть эффективен при острых гриппоподобных и желудочно-кишечных побочных эффектах.
• Терапию циклоспорином ж,7н (Код АТХ: L04AD01) или такролимусом ж,7н (Код АТХ: L04AD02), назначенную при острой тяжелой атаке язвенного колита рекомендовано прекратить спустя 4 месяца с переходом на прием тиопуринов [9].
• Применение метотрексата ж,вк (Код АТХ: L01BA01) при ЯК у детей в настоящее время не рекомендуется [10].
• У пациентов с хроническим непрерывным или гормонозависимым течением ЯК, не контролируемым 5-АСК и тиопуринами, рекомендовано рассмотреть возможность назначения инфликсимаба ж,вк (Код АТХ: L04AB02) [57].
Комментарии: У детей с ЯК в настоящее время рекомендовано назначать Инфликсимаб ж,вк в качестве препарата первой линии биологической терапии в дозе 5 мг/кг (3 индукционных на 0, 2 и 6 неделях с последующим введением по 5 мг/кг каждые 8 недель в качестве поддерживающей терапии). Может потребоваться индивидуальный подбор дозы.
Отсутствуют надежные данные о необходимости комбинации инфликсимаба с тиопуринами у детей с ЯК, не ответившими на терапию тиопуринами. Возможно, однако, применение биологических препаратов в сочетании с тиопуринами в течение 4-8 месяцев терапии, даже если ребенок не ответил на ранее проводившуюся терапию тиопуринами. Необходимо при комбинированном лечении дальнейшее подробное изучение соотношения польза/риск.
Учитывая потенциальное благоприятное действие (включая возможную профилактику колоректального рака) и высокую безопасность 5-АСК, представляется рациональным проведение комбинированного лечения 5-АСК с биологическими препаратами.
Показано, что инфликсимаб эффективен в индукции клинической ремиссии, обеспечивает заживление слизистой оболочки и снижает потребность в проведении колэктомии у больных с активным ЯК, не ответивших на стандартную терапию [51, 52]. Согласно данным рандомизированных двойных слепых плацебо-контролируемых исследований АСТ-1 и АСТ-2, инфликсимаб эффективен для индукции и поддержания ремиссии у взрослых пациентов со среднетяжелым и тяжелым ЯК [53]. Сопоставимые результаты были получены и в ходе проведенного у детей РКИ Т-72: через 8 нед лечения инфликсимабом (5 мг/кг внутривенно на 0-й, 2-й и 6-й нед) 73% пациентов ответили и 40% достигли клинической ремиссии; у 68% пациентов отмечалось заживление слизистой оболочки по данным эндоскопического исследования. При продолжении терапии в течениегода в режиме регулярных инфузий по 5 мг/кг каждые 8 нед стойкая клиническая ремиссия без применения ГК наблюдалась практически у 40% пациентов [54-56]. Имеются результаты и других педиатрических исследований, подтверждающие целесообразность применения инфликсимаба у детей с ЯК. Мета-анализ показал, что накопленная долгосрочная эффективность инфликсимаба при остром тяжелом колите составляет 64% [51]. Избежать колэктомии в течение 2 лет удалось у 61% больных.
• Инфликсимаб ж,вк рекомендовано назначить при гормонрезистетной форме заболевания (устойчивости как к пероральному, так и внутривенному введению). Если инфликсимаб был назначен при острой атаке у пациента, ранее не получавшего тиопурины, биологическая терапия может использоваться как вспомогательная для перехода на терапию тиопуринами. В этом случае, терапию инфликсимабом можно прекратить спустя приблизительно 4-8 месяцев [10].
Комментарии: В исследовании SUCCESS [57], проведенном у взрослых больных с ЯК, установлено, что комбинация инфликсимаба с азатиоприном превосходит по эффективности монотерапию каждым из препаратов по отдельности. Назначение комбинированной терапии следует проводить с учетом риска развития возможных нежелательных явлений, включая риск лимфомы, а также принимая во внимание тот факт, что эффективность комбинации препаратов при неэффективности тиопуринов пока надежно не доказана. Несмотря на то, что тиопурины снижают частоту инфузионных реакций и иммуногенность инфликсимаба, они не влияют на клинический исход терапии и его фармакокинетику [58]. Аналогичные результаты, свидетельствующие об отсутствии преимущества в проведении комбинированной терапии, были получены и в ходе исследования эффективности инфликсимаба у детей (Т-72) [54]. Вероятность колэктомии при долгосрочном наблюдении 52 детей с ЯК, получавших инфликсимаб, не различалась в группах монотерапии и комбинированного лечения [56]. У детей с гормональной резистентностью, ранее не получавших тиопурины, инфликсимаб может быть использован для перехода на терапию тиопуринами. В этом случае комбинированная терапия обычно продолжается в течение 4–8 мес [9].
Пациентам с потерей ответа во время поддерживающего лечения может потребоваться оптимизация дозы (увеличение дозы инфликсимаба до 10 мг/кг или сокращение интервалов между введениями до 4–6 нед) [54, 59]. По данным большинства клинических испытаний, наиболее существенным является риск инфузионных и аллергических реакций, тогда как вероятность развития других побочных эффектов невелика.
• Адалимумаб ж,вк (Код АТХ: L04AB04) рекомендовано применять только у пациентов с потерей ответа на инфликсимаб или непереносимостью инфликсимаба [10].
Комментарии: Терапию адалимумабом показано проводить по схеме: индукционная доза на 0 и 2 неделе 120 мг и 80 мг при массе тела ≥40 кг или 80 мг и 40 мг при массе тела
В настоящее время зарегистрированы биосимиляры (биоаналоги) анти-ФНО препаратов, которые эквивалентны им по строению. В клинических испытаниях они показали схожую с оригинальными препаратами эффективность, однако, возможность перехода с оригинальных препаратов на биоаналоги или обратно в настоящее время не доказана. Больные должны быть информированы о возможной замене на тот или другой препарат.
• Плановая колэктомия может быть рекомендована пациентам с активным или гормонозависимым ЯК, несмотря на терапию максимальными дозами 5-АСК, тиопуринами и анти-ФНО-препаратами или при обнаружении высокой дисплазии эпителия толстой кишки [10].
Комментарии: Колэктомия следует рассматривать в качестве разумной альтернативы у детей, с наличием постоянных симптомов болезни, несмотря на применение различных иммуносупрессоров, особенно стероидов. Наиболее частым показанием для плановой колэктомии у детей с ЯК является сохранение постоянной активности заболевания, иногда стероидзависимого; у взрослых также частым показанием является дисплазии [60]. В целом, перед направлением на колэктомию при неосложненном течении легкой и умеренной активности ЯК у детей должны быть применены эффективные дозы иммуномодулирующих и биологических препаратов. В случае потери ответ на инфликсимаб, может быть рассмотрен адалимумаб до проведения колэктомии.
Перед принятием решения о колэктомии рекомендовано повторно оценить состояние пациента, в том числе провести повторную илеоколоноскопию и исключить другие причины симптомов.
Решение вопроса о проведении колэктомии решается коллегиально с участием хирургов и детских гастроэнтерологов.
Предоперационная терапия стероидами (>20мг у взрослых), гипоальбуминемия, и недостаточное питание связаны с увеличением частоты хирургических осложнений [61], однако в острой ситуации не рекомендуется ожидать их улучшения перед операцией [62]. Мета-анализ 5 исследований показал более высокий процент краткосрочных послеоперационных осложнений в 706 взрослых, получавших инфликсимаб перед колэктомией [63]. В популяционном исследовании случай-контроль риск развития явлений венозной тромбоэмболии при ЯК был увеличен во всех возрастных группах, но значительно выше в пожилом возрасте [64].
• Лапароскопический хирургический доступ может безопасно применяться у детей с низким числом осложнений и прекрасными косметическими результатами.
Внекишечные осложнения наблюдаются до 30% педиатрических пациентов с ЯК включая поражение кожи, суставов, гепатобилиарной системы и глаз. Некоторые из них четко связаны с активностью заболевания кишечника (узловатая эритема, периферические артриты), в то время как другие происходят независимо друг от друга (гангренозная пиодермия, увеит, анкилозирующий спондилит и первичный склерозирующий холангит (ПСХ)) [65]. Данные из 2-х детских реестров в США [66,67] и Европе [65] показывают, что >1EIMs присутствуют на момент постановки диагноза от 6% до 17% педиатрических пациентов с ЯК, особенно у детей в возрасте старше 5 лет, с ростом почти на 50% с эволюцией болезни [68-71]. ВКП более вероятны у больных с распространенным колитом [67].
• Диагноз партикулярного артрита (тип 1, с поражением
• При наличии артрита, рекомендовано применение сульфосалазина, как препарата 5-АСК для поддерживающей терапии [10].
Первичный склерозирующий холангит (ПСХ) в 3 раза чаще встречаются при ЯК, чем при БК [67], и ассоциируется детьми более старшего возраста [67]. ПСХ может предшествовать появлению симптомов ВЗК на много лет, но может также развиваться у больных с ЯК после колэктомии. Кумулятивная частота ПСХ при ВЗК у детей увеличивается на 1,6% в течение 10 лет после установления диагноза [66]. Хотя внекишечные проявления язвенного колита, как правило, связаны с более тяжелым течением заболевания, это не верно для ПСХ [67]. В связи с тем, что эндоскопическую РХПГ трудно выполнить, особенно у маленьких детей, магнито-резонансная РХПГ может показать характерную картину нерегулярных желчных протоков, с зонами сужения и дилатации [72]. ПСХ может прогрессировать в цирроз печени, и, в конечном счете, требовать пересадки печени. У пациентов с ПСХ и ЯК имеется больший риск развития злокачественных опухолей, таких как колоректальный рак и холангиокарцинома (8%-30% пациентов с ЯК и длительным течением ПСХ) [73,74]. Пациенты, у которых диагноз ПСХ был установлен в детском возрасте, могут иметь более тяжелое течение болезни [74]. Сообщается, что у взрослых с ПСХ, урсодезоксихолевая кислота улучшает нарушенные функциональные пробы печени [75] и может улучшить исход. Исследования по лечению ПСХ у детей отсутствуют.
Магнитно-резонансная холангиография является исследование первой линии для ПСХ у детей, но интерпретация у маленьких детей может быть затруднена.
У всех пациентов следует оценить график вакцинаций. Иммунизацию живыми вакцинами следует проводить не позднее, чем за 6 нед до начала приема иммуносупрессоров, однако проведение вакцинаций не должно приводить к задержке в назначении препаратов, необходимых для контроля заболевания.
После начала терапии иммуносупрессорами иммунизацию следует проводить инактивированными вакцинами, включая введение вакцины против вируса гриппа (ежегодно), антипневмококковой вакцины и вакцины против вируса гепатита.
Учитывая применение в терапии ЯК в ряде случаев иммуносупрессоров, основным способом реабилитации пациентов является профилактика оппортунистических инфекций. К факторам риска развития оппортунистических инфекций относят: прием преднизолона 20 мг в сутки и более в течение 2 недель, прием иммуносупрессоров (азатиоприна, 6-меркаптопурина, метотрексата) и биологических препаратов, сопутствующие заболевания (хронические заболевания легких, органические заболевания головного мозга, сахарный диабет). В соответствии с Европейским консенсусом по профилактике, диагностике и лечению оппортунистических инфекций при ВЗК, такие пациенты подлежат обязательной вакцинопрофилактике. Необходимым минимумом вакцинопрофилактики является:
Для женщин до 26 лет, при отсутствии вируса на момент скрининга рекомендуется вакцинация от вируса папилломы человека.
• Перед началом биологической терапии консультация фтизиатра – скрининг на туберкулез (рентгенография органов грудной клетки, T-spot (или квантифероновый тест)или проба Манту, аллерген туберкулезный рекомбинантный в стандартном разведении);
• Биологическая терапия требует строгого соблюдения доз и графика введения (нерегулярное введение повышает риск инфузионных реакций и неэффективности);
• На фоне терапии иммуносупрессорами обязательным является контроль уровня лейкоцитов (общий анализ крови ежемесячно).
Уменьшение рисков, связанных с назначением ГКС, достигается строгим соблюдением принципов гормональной терапии. Глюкокортикостероиды не могут применяться в качестве поддерживающей терапии.
• Обязательным является сопутствующий прием препаратов кальция, витамина D, ингибиторов протонной помпы;
Пациентам, которым в результате хирургического лечения была сформирована кишечная стома может потребоваться консультация и наблюдение специалистом по реабилитации стомированных пациентов.
Медицинская реабилитация
Специфические меры реабилитации пациентов с ЯК отсутствуют. Меры медицинской реабилитации направлены на профилактику осложнений консервативной терапии.
Психосоциальная поддержка и приверженность терапии.
• У детей и подростков, особенно при нестабильном течении заболевания, рекомендовано учитывать возможное несоблюдение медицинских предписаний [76]. (Уровень убедительности рекомендаций B; уровень достоверности доказательств 3а)
Комментарии: Отсутствие приверженности терапии ВЗК является важной и частой проблемой, и отмечается от 50% до 66% детей [76,77], особенно в подростковом возрасте. Отсутствие приверженности связано с повышенной активностью заболевания у подростков [77]. Индивидуальные исследования среди подростков с ВЗК сообщили о наличии проблем, идентичных тем, которые существуют среди взрослых, а также собственно педиатрических конкретных проблем: страх побочных эффектов лекарств, убеждение, что болезнь является неактивной, убеждение, что лечение не работает, >1 ежедневно лекарства [76], забывчивость, вмешательство других видов деятельности, трудности при глотании таблеток [78], отсутствие мотивации, а также конфликты между родителями и ребенком [79].
Приверженность может быть оценена с помощью интервью как подростка и родителей, мониторинга лекарственных средств (например, определения уровня метаболита тиопурина), а также заказа препаратов в аптеке.
Приверженность к терапии может быть улучшена путем предоставления всеобъемлющей информации, касающейся предписанных лекарств, сохранения лекарственной нагрузки как можно ниже, а также однократного приема, когда это возможно, суточной дозы препаратов.
• Психологическая помощь рекомендована всем нуждающимся пациентам, поскольку она повышает качество жизни, облегчает адаптацию к заболеванию и препятствует депрессии [79,10]
Прогноз
Риск тяжелого обострения ЯК в течение жизни составляет 15%, при этом вероятность тяжелой атаки выше у больных с тотальным поражением толстой кишки. При проведении адекватной противорецидивной терапии в течение 5 лет обострений удается избежать у половины пациентов, а в течение 10 лет – у 20% больных. В течение первого года после постановки диагноза вероятность колэктомии составляет 4-9% (при тяжелой атаке — около 50%), в дальнейшем с каждым годом заболевания риск колэктомии увеличивается на 1%. Факторами риска агрессивного течения ЯК являются детский и подростковый возраст на момент начала заболевания, прогрессирование поражения от дистального (проктита) к тотальному и первичный склерозирующий холангит.
Профилактика
Язвенный колит характеризуется хроническим рецидивирующим течением. Целью диспансерного наблюдения является, в первую очередь, раннее выявление рецидивов заболевания, а также профилактика реколоректального рака. Особенности наблюдения за пациентами, получающими иммуносупрессоры и/или биологические препараты описаны в разделе 3 и п.6.2. Больному следует разъяснить необходимость постоянного приема лекарственных препаратов, поскольку соблюдение предписаний по терапии существенно (в 2-2,5) раза снижает частоту обострений, а сама терапия является методом химиопрофилактики колоректального рака.
Источник https://www.krasotaimedicina.ru/diseases/zabolevanija_gastroenterologia/antibiotic-associated-diarrhea
Источник https://probolezny.ru/psevdomembranoznyy-kolit/
Источник https://diseases.medelement.com/disease/%D1%8F%D0%B7%D0%B2%D0%B5%D0%BD%D0%BD%D1%8B%D0%B9-%D0%BA%D0%BE%D0%BB%D0%B8%D1%82-%D1%83-%D0%B4%D0%B5%D1%82%D0%B5%D0%B9-%D1%80%D0%B5%D0%BA%D0%BE%D0%BC%D0%B5%D0%BD%D0%B4%D0%B0%D1%86%D0%B8%D0%B8-%D1%80%D1%84/15980